静脉血管疾病是外科常见病,主要包括深静脉血栓形成、静脉瓣膜功能不全等,近年来发病率不断增高,有致残、致死风险,对健康危害极大[1]。研究表明,静脉血管疾病的发生、发展与血管内皮缺氧密切相关,缺氧可导致血管内皮细胞损伤,促进病情进展[2]。如能有效改善血管内皮细胞的缺氧状态,则可能加快细胞修复,从而达到治疗静脉血管疾病的目的。银杏二萜内酯(ginkgo diterpene lactones)是近年来临床治疗静脉血管疾病应用较广泛的药物,在脑静脉血管疾病治疗方面已取得一定的效果[3-4]。本研究探讨了银杏二萜内酯对缺氧静脉血管内皮细胞的影响及其作用机制,为了解该药在血管疾病治疗中的机制、将其用于缺氧性静脉血管疾病治疗提供实验依据。
1 材料和方法 1.1 材料及试剂人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)购自中国科学院典型培养物保藏委员会细胞库,于本院科研中心传代培养。RPMI 1640培养液及胰蛋白酶均购自美国Gibco公司;qRT-PCR试剂盒购自美国Promega公司;PCR引物由上海吉凯基因公司代为合成;银杏二萜内酯(纯度≥90%)、MTT试剂及蛋白质印迹法所用一抗[包括抗缺氧诱导因子1α(hypoxia-inducible factor 1α,HIF-1α)、抗Bcl-2、抗B细胞淋巴瘤2相关X蛋白(B-cell lymphoma 2-related X protein,Bax)、抗血管内皮生长因子(vascular endothelial growth factor,VEGF)和抗TGF-β]均购自美国Sigma公司。
1.2 方法 1.2.1 细胞培养与分组HUVEC于含10% FBS及100 U/mL青霉素、0.1 mg/mL链霉素的RPMI 1640培养液中培养传代,培养箱常规氧环境为37 ℃、5% CO2、21% O2,低氧环境为37 ℃、5% CO2、3% O2,传代后培养48 h开始实验。配制含6.25和25.00 mg/L银杏二萜内酯的完全培养液,分别用于培养低剂量和高剂量银杏二萜内酯处理组细胞,96孔板每孔加入100 μL;对照组用等量完全培养液培养。对照组细胞置于常规氧培养环境中培养,低氧处理组及低剂量和高剂量银杏二萜内酯处理组细胞均置于低氧环境中培养。干预24 h后进行后续实验。
1.2.2 MTT法检测细胞活性各组HUVEC经胰酶消化,按细胞密度1×105/mL接种于96孔板,每孔200 μL。细胞贴壁后常规培养20 h,然后每孔加入质量浓度为5 g/L的MTT试剂20 μL。继续培养4 h后吸弃培养液,每孔加入DMSO 150 μL,常温下震荡15 min,用酶标仪测定各孔490 nm波长处的光密度(D)值。以各孔D值与空白对照D值的比值作为细胞活性值。实验重复3次。
1.2.3 流式细胞术检测细胞凋亡情况各组HUVEC经胰酶消化、670.8×g离心5 min收集细胞,以PBS洗涤细胞2次后收集细胞1×105个,加入500 μL结合液重悬细胞。然后依次加入5 μL膜联蛋白Ⅴ(annexin Ⅴ)-增强绿色荧光蛋白(enhanced green fluorescent protein,EGFP)、5 μL PI混匀,室温避光静置15 min。采用流式细胞仪检测细胞凋亡情况并计算凋亡率。实验重复3次。
1.2.4 Transwell小室实验检测细胞迁移能力各组HUVEC经胰酶消化、670.8×g离心5 min收集细胞,以RPMI 1640培养液调整细胞密度为1×106/mL。取100 μL接种至Transwell小室上室,加入无血清RPMI 1640培养液。下室中则加入含20% FBS的RPMI 1640培养液。继续常规培养24 h后取出小室,用棉签擦除滤膜上层细胞,再以甲醇固定滤膜5 min。用Giemsa染料染色15 min。在显微镜100倍下随机选择5个视野,计数穿膜细胞数,并计算平均值。实验重复3次。
1.2.5 qRT-PCR检测HIF-1α、Bcl-2、Bax、VEGF、TGF-β mRNA表达收集各组HUVEC并提取总RNA,反转录合成cDNA。建立总体积为20 μL的反应体系进行qRT-PCR。反应条件:95 ℃预变性5 min,95 ℃变性30 s、60 ℃退火30 s、72 ℃延伸30 s循环37次,在每个循环的延伸阶段采集荧光信号。以GAPDH为内参照,用2-ΔΔCt法计算目的基因相对表达量。引物序列:HIF-1α上游引物5′-TCTGGGTTGAAACTCAAGCAACTG-3′,下游引物5′-CAACCGGTTTAAGGACACATTCTG-3′;Bcl-2上游引物5′-TGTGTGGAGAGCGTCAACC-3′,下游引物5′-TGGATCCAGGTGTGCAGGT-3′;Bax上游引物5′-GATGCGTCCACCAAGAAGC-3′,下游引物5′-AAGTCCAATGTCCAGCCCAT-3′;VEGF上游引物5′-GTGGAGAACTTGGAAATGGAAAC-3′,下游引物5′-TTGAAGAGAGTGGAGTGGCT-3′;TGF-β上游引物:5′-CGCGTGCTAATGGTGGAAA-3′,下游引物5′-CAGCCGGTTGCTGAGGTATC-3′;GAPDH上游引物:5′-TGAACGGGAAGCTCACTGG-3′,下游引物5′-GCTTCACCACCTTCTTGATGTC-3′。
1.2.6 蛋白质印迹法检测HIF-1α、Bcl-2、Bax、VEGF、TGF-β蛋白表达收集各组HUVEC总蛋白,采用Bradford法进行蛋白定量。各组取60 μg蛋白上样进行SDS-PAGE,然后电转移至PVDF膜。用脱脂奶粉溶液封闭后,先后加入凋亡相关基因Bcl-2、Bax和血管生成相关基因VEGF、TGF-β一抗(稀释比例均为1:1 000)及相应二抗(稀释比例均为1:10 000)。采用化学发光法显色,以β-actin为内参照计算各目的蛋白的相对表达量。
1.3 统计学处理应用SPSS 21.0软件进行统计学分析。呈正态分布的计量资料以x±s表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,事后两两比较采用LSD-t检验。检验水准(α)为0.05。
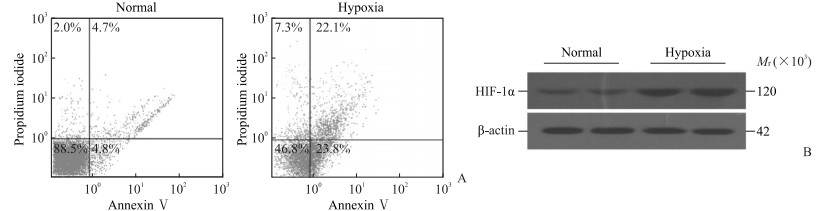
2 结果 2.1 低氧培养对HUVEC的影响MTT法检测结果显示,低氧培养24 h后HUVEC的活性低于常规氧培养组(0.577±0.171 vs 1.130±0.252),差异有统计学意义(t=8.826,P<0.01)。流式细胞术检测结果(图 1A)显示,低氧处理组细胞凋亡率高于常规氧培养组[(19.87±3.80)% vs(4.37±1.22)%],差异有统计学意义(t=8.784,P<0.01)。qRT-PCR和蛋白质印迹法结果(图 1B)显示,低氧处理组HIF-1α的mRNA和蛋白表达水平分别为1.130±0.252、0.920±0.195,均高于正常氧培养组(0.577±0.171、0.403±0.132),差异均有统计学意义(t=5.842、5.291,P=0.028、0.034)。
|
图 1 低氧培养对HUVEC凋亡和HIF-1α蛋白表达的影响 Fig 1 Effect of hypoxia culture on apoptosis and HIF-1α protein expression of HUVECs A: Apoptosis of HUVECs detected by flow cytometry; B: Expression of HIF-1α protein in HUVECs detected by Western blotting. HUVEC: Human umbilical vein endothelial cell; HIF-1α: Hypoxia-inducible factor 1α |
2.2 银杏二萜内酯对低氧处理HUVEC活性的影响
MTT法检测结果显示,低剂量与高剂量银杏二萜内酯处理组HUVEC活性均高于低氧处理组(0.813±0.129、1.106±0.180 vs 0.455±0.137),差异均有统计学意义(t=4.660、7.049,P均<0.01);高剂量银杏二萜内酯处理组HUVEC活性高于低剂量组,差异有统计学意义(t=3.241,P=0.009)。
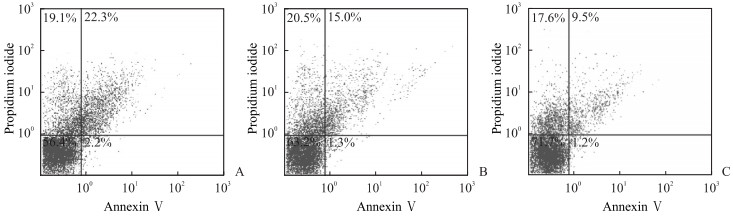
2.3 银杏二萜内酯对低氧处理的HUVEC凋亡的影响流式细胞术检测结果(图 2)显示,低剂量与高剂量银杏二萜内酯处理组细胞凋亡率均低于低氧处理组[分别为(14.84±2.32)%、(8.45±1.91)%、(20.64±3.08)%],差异均有统计学意义(t=-3.684、-8.239,P=0.004、P<0.01),并且高剂量银杏二萜内酯处理组的细胞凋亡率低于低剂量组(t=-5.209,P<0.01)。
|
图 2 流式细胞术检测银杏二萜内酯对低氧处理HUVEC凋亡的影响 Fig 2 Effect of ginkgo diterpene lactones on apoptosis of HUVECs exposed to hypoxia detected by flow cytometry A: Hypoxia group; B: Low-dose (6.25 mg/L) ginkgo diterpene lactones group; C: High-dose (25.00 mg/L) ginkgo diterpene lactones group. HUVEC: Human umbilical vein endothelial cell |
2.4 银杏二萜内酯对低氧处理HUVEC迁移能力的影响
Transwell小室实验检测结果(图 3)显示,低剂量与高剂量银杏二萜内酯处理组细胞迁移能力均高于低氧处理组(分别为52.00±12.85、76.83±15.36、32.17±6.85),差异均有统计学意义(t=-3.336、P=0.008,t=-6.505、P<0.01),并且高剂量银杏二萜内酯处理组HUVEC迁移能力高于低剂量组(t=3.037,P=0.013)。

|
图 3 Transwell小室实验检测银杏二萜内酯对低氧处理HUVEC迁移能力的影响 Fig 3 Effects of ginkgo diterpene lactones on migration of HUVECs exposed to hypoxia detected by Transwell assay A: Hypoxia group; B: Low-dose (6.25 mg/L) ginkgo diterpene lactones group; C: High-dose (25.00 mg/L) ginkgo diterpene lactones group. HUVEC: Human umbilical vein endothelial cell. Giemsa staining. Original magnificatiion: ×200 |
2.5 银杏二萜内酯对低氧处理HUVEC血管生成基因表达的影响
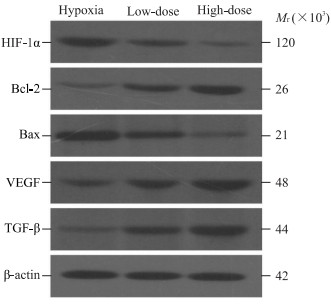
qRT-PCR和蛋白质印迹法检测结果(表 1、图 4)显示,低剂量银杏二萜内酯处理组HUVEC中HIF-1α蛋白表达低于低氧处理组(t=-5.12,P=0.007),但在mRNA水平差异无统计学意义(t=-2.05,P=0.110),Bax在mRNA和蛋白水平差异均无统计学意义(t=-2.15、-2.33,P=0.100、0.080);高剂量银杏二萜内酯处理组HIF-1α、Bax的mRNA和蛋白表达均低于低氧处理组(HIF-1α:t=-5.29、-11.99,P=0.006、P<0.01;Bax:t=-6.77、-6.64,P=0.002、P=0.003)和低剂量组(HIF-1α:t=-5.37、-5.18,P=0.006、0.007;Bax:t=-4.39、-5.28,P=0.012、0.006)。低剂量银杏二萜内酯处理组Bcl-2、TGF-β的mRNA和蛋白表达均高于低氧处理组(Bcl-2:t=7.25、6.49,P=0.002、0.003;TGF-β:t=6.95、5.46,P=0.002、0.005),VEGF仅在蛋白水平与低氧处理组相比差异有统计学意义(t=4.27,P=0.013);高剂量银杏二萜内酯处理组Bcl-2、VEGF和TGF-β的mRNA和蛋白表达均高于低氧处理组(Bcl-2:t=4.55、6.97,P=0.010、0.002;VEGF:t=4.30、7.82,P=0.013、0.001;TGF-β:t=8.43、6.60,P=0.001、0.003),且TGF-β mRNA表达高于低剂量组(t=3.19,P=0.033)。
|
|
表 1 银杏二萜内酯对低氧处理HUVEC凋亡和血管生成相关基因表达的影响 Tab 1 Effects of ginkgo diterpene lactones on expression of apoptosis- and angiogenesis-related genes in HUVECs exposed to hypoxia |
|
图 4 蛋白质印迹法检测银杏二萜内酯对低氧处理HUVEC凋亡和血管生成相关蛋白表达的影响 Fig 4 Effects of ginkgo diterpene lactones on apoptosisand angiogenesis-related protein expression in HUVECs exposed to hypoxia detected by Western blotting Low-dose group: The HUVECs exposed to hypoxia were treated with 6.25 mg/L ginkgo diterpene lactones; High-dose group: The HUVECs exposed to hypoxia were treated with 25.00 mg/L ginkgo diterpene lactones. HUVEC: Human umbilical vein endothelial cell; HIF-1α: Hypoxia-inducible factor 1α; Bcl-2: B-cell lymphoma 2; Bax: B-cell lymphoma 2-related X protein; VEGF: Vascular endothelial growth factor; TGF-β: Transforming growth factor β |
3 讨论
静脉疾病发病率不断增高,已成为临床常见疾病,严重时可造成肢体残疾,甚至导致患者死亡,危害较大[5],因此,明确其发病机制对探寻新的治疗方法有重要意义。研究发现,缺氧在静脉疾病的发生、发展中发挥了重要作用,在发生静脉疾病时,血管内皮细胞处于缺氧环境,导致血管内皮细胞损伤,并且细胞中HIF-1α表达增高,这对血管内皮细胞凋亡及新生血管生成能力造成不利影响,从而加重病情[6-8]。本研究结果也显示,缺氧状态HUVEC活性降低,凋亡增加,细胞内HIF-1α表达增加。因此,应用药物改善细胞缺氧及HIF-1α表达可能对静脉疾病治疗有益。
银杏二萜内酯是我国传统中药银杏叶的重要有效成分,具有较好的微循环改善作用,在多种血管疾病的治疗中取得了良好效果,但银杏二萜内酯作用的分子机制还未完全阐明。本研究结果显示,应用银杏二萜内酯干预缺氧处理的HUVEC后细胞活性增高、凋亡减少、迁移能力增强。提示银杏二萜内酯可使血管内皮细胞生存能力增强、凋亡减少、血管生成能力增强,对缺氧性血管疾病治疗有益。
凋亡增加及新生血管生成能力减弱是导致血管疾病迁延及进展的重要原因,在此过程中具有凋亡调节作用的P53、Bcl-2、Bax及具有调控血管生成作用的VEGF、TGF-β等基因均发挥了重要作用[9-12]。为进一步了解银杏二萜内酯对血管内皮细胞作用的分子机制,本研究检测了HIF-1α及凋亡和血管生成相关基因mRNA和蛋白的表达变化,结果显示,银杏二萜内酯具有抑制HIF-1α、Bax及促进Bcl-2、VEGF、TGF-β表达的作用。说明银杏二萜内酯可以通过调节HIF-1α、Bax、Bcl-2、VEGF、TGF-β等基因表达减少细胞凋亡、增强血管生成能力,从而发挥对缺氧性血管疾病的治疗作用。
总之,银杏二萜内酯能有效缓解缺氧对血管内皮细胞的损伤,增强血管内皮细胞活性、降低凋亡、提高血管生成能力,提示银杏二萜内酯可能成为缺氧性血管疾病的有效治疗药物。但本研究有一定局限性,因为缺氧状态下血管内皮细胞凋亡增加、迁移能力减弱的结论已十分明确[13-14],因此本研究仅随机验证了缺氧和常规氧培养细胞凋亡水平的差异,未再进一步验证迁移能力的变化。另外该研究结论还需体内研究及大规模临床试验进行验证。
| [1] |
HATTAB Y, KÜNG S, FASANYA A, MA K, SINGH A C, DUMONT T. Deep venous thrombosis of the upper and lower extremity[J]. Crit Care Nurs Q, 2017, 40: 230-236. DOI:10.1097/CNQ.0000000000000165 |
| [2] |
YU F C, YUAN C X, TONG J Y, ZHANG G H, ZHOU F P, YANG F. Protective effect of sphingosine-1-phosphate for chronic intermittent hypoxia-induced endothelial cell injury[J]. Biochem Biophys Res Commun, 2018, 498: 1016-1021. DOI:10.1016/j.bbrc.2018.03.106 |
| [3] |
李福军, 陈可, 马海玲, 朱晓会, 王超. 依达拉奉联合银杏二萜内酯对老年急性脑梗死患者的影响[J]. 实用心脑肺血管病杂志, 2019, 27: 93-96. |
| [4] |
曹志勇, 李新玲, 沈海林, 宋坚, 丁莉, 黄怀宇. 银杏二萜内酯葡胺治疗动脉粥样硬化性脑梗死临床观察[J]. 中国实用神经疾病杂志, 2018, 21: 279-282. |
| [5] |
RAMASWAMY R S, AKINWANDE O, GIARDINA J D, KAVALI P K, MARKS C G. Acute lower extremity deep venous thrombosis:the data, where we are, and how it is done[J]. Tech Vasc Interv Radiol, 2018, 21: 105-112. DOI:10.1053/j.tvir.2018.03.006 |
| [6] |
JEON D, KIM S J, KIM H S. Anti-inflammatory evaluation of the methanolic extract of Taraxacum officinale in LPS-stimulated human umbilical vein endothelial cells[J]. BMC Complement Altern Med, 2017, 17: 508. DOI:10.1186/s12906-017-2022-7 |
| [7] |
LI L C, WANG Z W, HU X P, WU Z Y, HU Z P, RUAN Y L. MDG-1 inhibits H2O2-induced apoptosis and inflammation in human umbilical vein endothelial cells[J]. Mol Med Rep, 2017, 16: 3673-3679. DOI:10.3892/mmr.2017.6957 |
| [8] |
TU F, PANG Q, CHEN X, HUANG T, LIU M, ZHAI Q. Angiogenic effects of apigenin on endothelial cells after hypoxia-reoxygenation via the caveolin-1 pathway[J]. Int J Mol Med, 2017, 40: 1639-1648. |
| [9] |
GU J, WANG S, GUO H, TAN Y, LIANG Y, FENG A, et al. Inhibition of p53 prevents diabetic cardiomyopathy by preventing early-stage apoptosis and cell senescence, reduced glycolysis, and impaired angiogenesis[J/OL]. Cell Death Dis, 2018, 9:82. doi:10.1038/s41419-017-0093-5.
|
| [10] |
CHEN M H, REN Q X, YANG W F, CHEN X L, LU C, SUN J. Influences of HIF-lα on Bax/Bcl-2 and VEGF expressions in rats with spinal cord injury[J]. Int J Clin Exp Pathol, 2013, 6: 2312-2322. |
| [11] |
CHEN M C, HSU W L, HWANG P A, CHOU T C. Low molecular weight fucoidan inhibits tumor angiogenesis through downregulation of HIF-1/VEGF signaling under hypoxia[J]. Mar Drugs, 2015, 13: 4436-4451. DOI:10.3390/md13074436 |
| [12] |
MU X, FANG C, ZHOU J, XI Y, ZHANG L, WEI Y, et al. Fusion with human lung cancer cells elongates the life span of human umbilical endothelial cells and enhances the anti-tumor immunity[J]. J Cancer Res Clin Oncol, 2016, 142: 111-123. DOI:10.1007/s00432-015-2002-6 |
| [13] |
吴胜春, 石晓明, 唐雷, 吕柏楠, 杨永宾. HIF-1α对缺氧条件下人脐静脉内皮细胞ECV304增殖和凋亡的影响[J]. 第二军医大学学报, 2013, 34: 808-811. WU S C, SHI X M, TANG L, LÜ B N, YANG Y B. Effect of HIF-1α on proliferation and apoptosis of human umbilical vein endothelial ECV304 cells exposed to hypoxia[J]. Acad J Sec Mil Med Univ, 2013, 34: 808-811. |
| [14] |
吴胜春, 石晓明, 杨永宾, 吕柏楠, 唐雷. 低氧状态下血管内皮细胞HIF-1α表达及与细胞凋亡的关系[J]. 中国现代医学杂志, 2014, 24(10): 6-10. |
 2020, Vol. 41
2020, Vol. 41


