原发性开角型青光眼(primary open angle glaucoma,POAG)是一组以特征性视神经萎缩和视野缺损为共同特征的疾病,病理性眼压增高是其主要危险因素。POAG在眼压升高时房角始终保持开放,并且没有与眼压升高相关的病因性眼部或全身其他异常,病程进展缓慢,而且多数没有明显症状,不易早期发现,部分POAG患者就诊时已发生严重的视功能损害,甚至已到达青光眼的晚期。青光眼在视野缺损出现之前已有视乳头的改变、视网膜神经纤维层(retinal nerve fiber layer,RNFL)厚度的变薄及视网膜神经节细胞(retinal ganglion cell,RGC)的丢失[1-4]。曾有文献报道,当一例青光眼患者发生特征性视野损害时,相当于有28% RGC的丢失[2]及17% RNFL厚度的变薄[5]。
目前有研究发现,利用频域光学相干断层扫描(spectral domain-optical coherence tomography,SD-OCT)对视盘周围视网膜神经纤维层厚度(peripapillary retinal nerve fiber layer,pRNFL)进行测量可以早期诊断POAG,且诊断准确率较高[6-7]。利用SD-OCT测量神经节细胞复合体(ganglion cell complex,GCC)也可发现POAG的早期损害[8-10]。GCC包括RNFL、神经节细胞层(ganglion cell layer,GCL)和内丛状层(inner plexiform layer,IPL),其中RNFL厚度正常范围变异较大,稳定性欠佳。CirrusTM HD-OCT应用了神经节细胞分析(ganglion cell analysis,GCA)算法,可精确测量黄斑GCL-IPL厚度,与GCC算法相比,其测量不包含RNFL厚度,在正常人群中的变异更小,因此具有良好稳定性与重复性,对于POAG的早期诊断及进展监测具有一定的价值[11-14]。上述参数均可应用于POAG的早期诊断,而目前认为年龄、性别、眼轴长度、种族及信号强度等都会对这些测量参数产生影响[15]。本研究利用SD-OCT检测健康对照和早中期开角型青光眼患者的视盘及黄斑参数,分析其相关影响因素,寻找更精准的POAG早期诊断指标。
1 资料和方法 1.1 研究对象选取2015年9月至2018年8月在我科就诊的POAG患者,按照经典H-P-A视野分期方法[16],以视野平均缺损(mean defect,MD)值为参考,MD > -6 dB为早期,-12~-6 dB为中期,< -12 dB为晚期。入组早期及中期的POAG患者40例(40眼), 男17例、女23例,20~39岁者20例、60~79岁者20例。纳入标准:房角镜检查为房角开放,最佳矫正视力(best corrected vision acuity,BCVA)≤0.3(logMAR视力),球镜度数绝对值< 6 D、柱镜度数绝对值< 2 D,年龄为20~39岁或60~79岁。排除标准:眼内手术或激光手术后,视网膜或黄斑部疾病,系统性疾病或神经系统疾病患者,以及无法完成可靠的视野检查的患者。入组的早期及中期POAG患者基础非接触眼压 > 21 mmHg(1 mmHg=0.133 kPa),青光眼的视盘异常由经验丰富的青光眼专家诊断,主要包括盘沿变窄、视盘出血、垂直方向杯盘比增大、视杯凹陷加深或视神经纤维层变薄;同时自动静态视野检查表现为青光眼性的视野缺损,并且符合早期或中期损害标准[16]。再选取同期在我科就诊的健康对照40名(40眼),男21名、女19名,20~39岁者20名、60~79岁者20名。健康对照主要表现为正常的视乳头表现、正常的眼压值(非接触眼压≤21 mmHg)及正常视野等。
所有受试者在接受检查前均签署知情同意书。根据上述纳入和排除标准,每例患者的患眼被纳入研究,如果两眼都符合纳入标准,则随机选择一眼纳入研究。
1.2 测量方法所有受试者入组后均接受眼科全面检查,包括BCVA、角膜厚度测量、裂隙灯检查(眼前节及眼后节)、非接触眼压、房角镜检查、眼底照相,使用瑞士Interzeag公司生产的标准自动静态视野计(型号:OCTOPUS 101 Perimeter)分别测量双眼的视野。
使用CirrusTM HD-OCT 4000(德国Carl Zeiss公司)对所有受试者黄斑区和视盘区进行SD-OCT扫描,黄斑区扫描程序为Macular Cube 512×128,视盘区扫描程序为Optic Disc Cube 200×200。测量信号需≥5(满格信号10)。由熟练掌握SD-OCT操作技术的眼科医师完成测量,主要测量项目包括pRNFL(分为平均厚度及上方、鼻侧、下方、颞侧厚度5个参数)、黄斑区平均GCL-IPL厚度、黄斑区最薄GCL-IPL厚度和黄斑区平均整体厚度(图 1)。
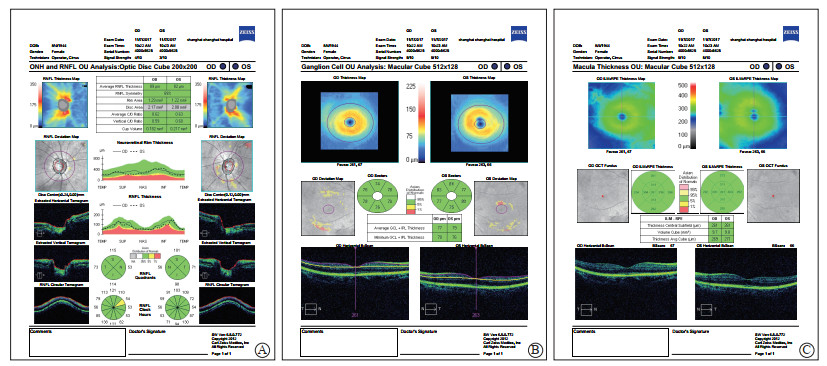
|
图 1 1名健康对照的视盘和黄斑参数SD-OCT图像 Fig 1 SD-OCT images of optic disc and macular parameters in a healthy control A: Optical Disc Cube 200×200 program was used for the optic disc scanning, the average RNFL thickness of the left eye was 82 μm, the superior side was 101 μm, the nasal side was 56 μm, the inferior part was 98 μm, and the temporal side was 71 μm; B: The macular area was scanned by Macular Cube 512×128 program, the average thickness of GCL-IPL in the left eye was 79 μm, and the minimum GCL-IPL was 76 μm; C: The macular area was scanned by Macular Cube 512×128 program, and the average thickness of macular cube in the left eye was 271 μm. SD-OCT: Spectral domain-optical coherence tomography; GCL-IPL: Ganglion cell layer combined with inner plexiform layer; RNFL: Retinal nerve fiber layer; ONH: Optic nerve head; OU: Oculus unati |
1.3 统计学处理
采用SPSS 19.0软件进行统计学分析。呈正态分布的计量资料以x±s表示,组间比较采用独立样本t检验。计数资料以例数表示,组间比较采用χ2检验。检验水准(α)为0.05。
2 结果 2.1 一般资料由表 1可见,相同年龄组的早中期POAG患者与健康对照者相比,在性别、屈光度、BCVA、角膜厚度等方面差异均无统计学意义(P > 0.05)。无论是健康对照还是早中期POAG患者,60~79岁年龄组的屈光度均低于20~39岁年龄组,差异有统计学意义(P < 0.01)。
|
|
表 1 不同年龄组健康对照和早中期POAG患者的一般资料 Tab 1 General data of healthy controls and POAG patients in different age groups |
2.2 黄斑区SD-OCT测量参数
黄斑区SD-OCT测量结果(表 2)显示,健康对照和早中期POAG患者黄斑区平均GCL-IPL厚度及最薄GCL-IPL厚度均随着年龄增长而变薄,60~79岁年龄组与20~39岁年龄组相比差异均有统计学意义(P < 0.05,P < 0.01);相同年龄组的早中期POAG患者黄斑区平均GCL-IPL厚度及最薄GCL-IPL厚度均较健康对照变薄,差异均有统计学意义(P均 < 0.01)。随着年龄的增长,健康对照和早中期POAG患者黄斑区平均整体厚度均无明显变化,差异无统计学意义(P > 0.05);60~79岁年龄组早中期POAG患者黄斑区平均整体厚度较健康对照变薄(P < 0.05),但20~39岁年龄组健康对照和早中期POAG患者黄斑区平均整体厚度差异无统计学意义(P > 0.05)。
|
|
表 2 不同年龄组健康对照和早中期POAG患者黄斑区SD-OCT测量参数 Tab 2 SD-OCT measurement parameters in macular area of healthy controls and POAG patients in different age groups |
2.3 视盘区SD-OCT测量参数
视盘区SD-OCT测量结果(表 3)显示,健康对照视盘区各参数(pRNFL平均厚度、上方厚度、鼻侧厚度、下方厚度和颞侧厚度)随着年龄的增长均无明显变化,60~79岁年龄组与20~39岁年龄组相比差异均无统计学意义(P > 0.05)。早中期POAG患者pRNFL平均厚度、上方厚度、下方厚度和颞侧厚度随着年龄增长均变薄,60~79岁年龄组与20~39岁年龄组相比差异均有统计学意义(P < 0.05,P < 0.01);pRNFL鼻侧厚度随年龄变化不大,60~79岁年龄组与20~39岁年龄组相比差异无统计学意义(P > 0.05)。相同年龄组的早中期POAG患者pRNFL平均厚度、上方厚度、下方厚度和颞侧厚度均较健康对照变薄,差异均有统计学意义(P < 0.05,P < 0.01);相同年龄组的早中期POAG患者和健康对照pRNFL鼻侧厚度差异无统计学意义(P > 0.05)。
|
|
表 3 不同年龄组健康对照和早中期POAG患者视盘区SD-OCT测量参数 Tab 3 SD-OCT measurement parameters in optic disc area of healthy controls and POAG patients in different age groups |
3 讨论
POAG发病隐匿且进展缓慢,早期发现对提高患者的视觉质量及生活质量非常重要,SD-OCT为POAG的早期检出提供了重要手段。目前有学者认为,利用SD-OCT检测pRNFL是早期诊断POAG的最灵敏指标[6-7]。但是视盘参数也有一定的局限性,个体差异大,特别是发生高度近视后对pRNFL厚度也有干扰。青光眼早期就可以对黄斑区产生损害,而且发生的比例较高[17]。已有研究表明,黄斑区内层厚度对青光眼的诊断准确性可以等同于视盘RNFL厚度的测量[18-21]。不同类型的SD-OCT对黄斑区的分割和测量功能也不同,本研究使用的CirrusTM HD-OCT(德国Carl Zeiss公司)可以测量黄斑区平均GCL-IPL厚度、黄斑区最薄GCL-IPL厚度和黄斑区平均整体厚度。Mwanza等[22]提出黄斑区GCL-IPL诊断早期青光眼的价值甚至可等同于pRNFL。但是,SD-OCT对黄斑区的扫描也存在一定的局限性,对周边视野损害的青光眼显示出一定的不足,且易受到并存的一些黄斑疾病及屈光介质混浊的影响,因此对于此类患者不适合利用黄斑厚度反映青光眼的损害和进展[23]。一般认为标准化自动视野检查(standard automated perimetry,SAP)是视网膜功能测试的“金标准”,在POAG患者中随着内层视网膜变薄,扩大的空间区域总和能代偿性保持此区域相对稳定的视野阈值,从而降低SAP的灵敏性,可能会影响形态学检查(黄斑厚度)与SAP灵敏度之间相关性比较,因此SD-OCT对黄斑区厚度的测量能否成为早期诊断及之后随访青光眼神经损害的一个有力指标还有待进一步研究[24]。
上述研究表明SD-OCT有助于提高POAG早期诊断率,但是却很少考虑SD-OCT的测量影响因素。本研究发现,健康对照和早中期POAG患者黄斑区GCL-IPL厚度(包括平均GCL-IPL厚度和最薄GCL-IPL厚度)受年龄因素影响较大,随着年龄的增长明显变薄。GCL-IPL为黄斑区内层视网膜组织,青光眼及年龄增长对其影响较大,而临床上POAG患者年龄差异也较大,青年患者和老年患者均多见,因此利用SD-OCT测量黄斑区GCL-IPL厚度来诊断POAG时仍需考虑年龄因素。黄斑区平均整体厚度随着年龄的增长无明显变化,在20~39岁年龄组即使是发生青光眼后,其平均厚度也未见明显变薄,原因可能是黄斑区视网膜包括多层结构,影响因素较多,对于诊断POAG不够灵敏,在临床上通常也不作为诊断POAG的首选测量方法。
本研究还发现,pRNFL厚度在健康对照中随着年龄增长无明显变薄,但在早中期POAG患者中随着年龄的增长大部分区域(除鼻侧外)明显变薄,这与既往报道的研究结果[11-14]一致。推测pRNFL受年龄因素影响较小,而受青光眼性因素影响较大,因此在诊断POAG时较灵敏,这一结果支持了既往文献报道的pRNFL是早期诊断POAG的最灵敏指标的观点[6-7]。我们发现无论是早中期POAG患者还是健康对照,60~79岁年龄组的屈光度均低于20~39岁年龄组,这符合我国年轻人近视屈光度相对较高、老年人近视屈光度相对较低的实际情况。研究发现高度近视是青光眼发病的危险因素之一,也是一种使诊断复杂化的干扰因素,因为它呈现出结构性变化,可逐渐导致类似青光眼视野缺损的变化[25]。因此,为排除干扰,本研究将高度近视患者排除在外。但在临床工作中利用SD-OCT测量pRNFL诊断青光眼时,如果遇到高度近视患者,仍需考虑到其可能会对测量结果产生影响。
综上所述,本研究发现早中期POAG组患者pRNFL大部分区域(除鼻侧外)的厚度及黄斑区GCL-IPL厚度相对于同年龄的健康对照明显变薄,表明发生POAG后不管在青年组还是老年组,都会对视盘及黄斑区结构产生损伤,并且鼻侧损伤可能最后发生。因此,我们认为青光眼是影响pRNFL厚度测量结果的主要因素,而年龄对测量结果的影响不大;pRNFL厚度仍是早期发现青光眼的最灵敏指标,联合黄斑区平均GCL-IPL厚度和最薄GCL-IPL厚度检测可进一步提高早中期POAG的诊断率。
| [1] |
HOOD D C. Improving our understanding, and detection, of glaucomatous damage:an approach based upon optical coherence tomography (OCT)[J]. Prog Retin Eye Res, 2017, 57: 46-75. DOI:10.1016/j.preteyeres.2016.12.002 |
| [2] |
QUIGLEY H A, MILLER N R, GEORGE T. Clinical evaluation of nerve fiber layer atrophy as an indicator of glaucomatous nerve damage[J]. Arch Ophthalmol, 1980, 98: 1564-1571. DOI:10.1001/archopht.1980.01020040416003 |
| [3] |
WEINREB R N, AUNG T, MEDEIROS F A. The pathophysiology and treatment of glaucoma:a review[J]. JAMA, 2014, 311: 1901-1911. DOI:10.1001/jama.2014.3192 |
| [4] |
KIM Y J, KANG M H, CHO H Y, LIM H W, SEONG M. Comparative study of macular ganglion cell complex thickness measured by spectral-domain optical coherence tomography in healthy eyes, eyes with preperimetric glaucoma, and eyes with early glaucoma[J]. Jpn J Ophthalmol, 2014, 58: 244-251. DOI:10.1007/s10384-014-0315-7 |
| [5] |
WOLLSTEIN G, KAGEMANN L, BILONICK R A, ISHIKAWA H, FOLIO L S, GABRIELE M L, et al. Retinal nerve fiber layer and visual function loss in glaucoma:the tipping point[J]. Br J Ophthalmol, 2012, 96: 47-52. DOI:10.1136/bjo.2010.196907 |
| [6] |
MICHELESSI M, RIVA I, MARTINI E, FIGUS M, FREZZOTTI P, AGNIFILI L, et al. Macular versus nerve fibre layer versus optic nerve head imaging for diagnosing glaucoma at different stages of the disease: Multicenter Italian Glaucoma Imaging Study[J/OL]. Acta Ophthalmol, 2019, 97: e207-e215. doi: 10.1111/aos.13930.
|
| [7] |
PAZOS M, DYRDA A A, BIARNÉS M, GÓMEZ A, MARTÍN C, MORA C, et al. Diagnostic accuracy of spectralis SD OCT automated macular layers segmentation to discriminate normal from early glaucomatous eyes[J]. Ophthalmology, 2017, 124: 1218-1228. DOI:10.1016/j.ophtha.2017.03.044 |
| [8] |
CIFUENTES-CANOREA P, RUIZ-MEDRANO J, GUTIERREZ-BONET R, PEÑA-GARCIA P, SAENZ-FRANCES F, GARCIA-FEIJOO J, et al. Analysis of inner and outer retinal layers using spectral domain optical coherence tomography automated segmentation software in ocular hypertensive and glaucoma patients[J/OL]. PLoS One, 2018, 13: e0196112. doi: 10.1371/journal.pone.0196112.
|
| [9] |
赵军, 徐漫, 周颖. OCT测量黄斑区GCC与视盘周围RNFL厚度在早期青光眼诊断中的应用[J]. 国际眼科杂志, 2017, 17: 1289-1292. |
| [10] |
RIMAYANTI U, LATIEF M A, ARINTAWATI P, AKITA T, TANAKA J, KIUCHI Y. Width of abnormal ganglion cell complex area determined using optical coherence tomography to predict glaucoma[J]. Jpn J Ophthalmol, 2014, 58: 47-55. DOI:10.1007/s10384-013-0281-5 |
| [11] |
周紫霞, 吴蓉, 傅培, 李金瑛. 双眼黄斑区神经节细胞-内丛状层厚度与视神经纤维层不对称分析在早期开角型青光眼诊断中的价值[J]. 临床眼科杂志, 2017, 17: 409-412. |
| [12] |
刘杏, 徐晓宇. 频域OCT测量黄斑区节细胞-内丛状层厚度在青光眼早期诊断中的应用[J]. 眼科, 2016, 25: 1-5. |
| [13] |
JANG J W, LEE M W, CHO K J. Comparative analysis of mean retinal thickness measured using SD-OCT in normal young or old age and glaucomatous eyes[J]. Int Ophthalmol, 2018, 38: 2417-2426. DOI:10.1007/s10792-017-0744-7 |
| [14] |
FRANCOZ M, FENOLLAND J R, GIRAUD J M, EL CHEHAB H, SENDON D, MAY F, et al. Reproducibility of macular ganglion cell-inner plexiform layer thickness measurement with cirrus HD-OCT in normal, hypertensive and glaucomatous eyes[J]. Br J Ophthalmol, 2014, 98: 322-328. DOI:10.1136/bjophthalmol-2012-302242 |
| [15] |
厉君, 段宣初. 光相干断层扫描测量视网膜神经节细胞复合体在青光眼中的研究进展[J]. 中华实验眼科杂志, 2018, 36: 299-304. |
| [16] |
SUSANNA R Jr, NICOLELA M T, SORIANO D S, CARVALHO C. Automated perimetry:a study of the glaucoma hemifield test for the detection of early glaucomatous visual field loss[J]. J Glaucoma, 1994, 3: 12-16. |
| [17] |
HOOD D C, RAZA A S, DE MORAES C G, LIEBMANN J M, RITCH R. Glaucomatous damage of the macula[J]. Prog Retin Eye Res, 2013, 32: 1-21. DOI:10.1016/j.preteyeres.2012.08.003 |
| [18] |
RENARD J P, FÉNOLLAND J R, GIRAUD J M. Glaucoma progression analysis by spectral-domain optical coherence tomography (SD-OCT)[J]. J Fr Ophtalmol, 2019, 42: 499-516. DOI:10.1016/j.jfo.2019.03.001 |
| [19] |
ROSENBERG R, MARILL A F, FENOLLAND J R, EL CHEHAB H, DELBARRE M, MARÉCHAL M, et al. [Evaluation of the new Canon HS-100 SD-OCT:reproducibility of macular ganglion cell complex (GCC) thickness measurement in normal, hypertensive and glaucomatous eyes][J]. J Fr Ophtalmol, 2015, 38: 832-843. DOI:10.1016/j.jfo.2015.03.015 |
| [20] |
TAN O, CHOPRA V, LU A T, SCHUMAN J S, ISHIKAWA H, WOLLSTEIN G, et al. Detection of macular ganglion cell loss in glaucoma by fourier-domain optical coherence tomography[J/OL]. Ophthalmology, 2009, 116: 2305-2314.e1-2. doi: 10.1016/j.ophtha.2009.05.025.
|
| [21] |
SEONG M, SUNG K R, CHOEI E H, KANG S Y, CHO J W, UM T W, et al. Macular and peripapillary retinal nerve fiber layer measurements by spectral domain optical coherence tomography in normal tension glaucoma[J]. Invest Ophthalmol Vis Sci, 2010, 51: 1446-1452. DOI:10.1167/iovs.09-4258 |
| [22] |
MWANZA J C, DURBIN M K, BUDENZ D L, SAYYAD F E, CHANG R T, NEELAKANTAN A, et al. Glaucoma diagnostic accuracy of ganglion cell-inner plexiform layer thickness:comparison with nerve fiber layer and optic nerve head[J]. Ophthalmology, 2012, 119: 1151-1158. DOI:10.1016/j.ophtha.2011.12.014 |
| [23] |
WONG J J, CHEN T C, SHEN L Q, PASQUALE L R. Macular imaging for glaucoma using spectral-domain optical coherence tomography:a review[J]. Semin Ophthalmol, 2012, 27(5/6): 160-166. |
| [24] |
何雪瑞, 刘涛. 频域OCT检测mGCC厚度在原发性青光眼诊断中的应用进展[J]. 国际眼科杂志, 2016, 16: 2039-2043. |
| [25] |
CHANG R T, SINGH K. Myopia and glaucoma:diagnostic and therapeutic challenges[J]. Curr Opin Ophthalmol, 2013, 24: 96-101. DOI:10.1097/ICU.0b013e32835cef31 |
 2020, Vol. 41
2020, Vol. 41


