化学治疗药物对女性生殖系统有明确损伤作用,严重的卵巢损伤可使卵泡丧失而导致卵巢功能不全,引起低雌激素症状及不孕等一系列问题。随着恶性肿瘤发病的年轻化,女性患者所面临的化学治疗性卵巢损伤问题引起研究者们的重视[1-2]。干细胞疗法能一定程度上恢复受损组织的正常功能,被认为是一种极具潜力的治疗方式[3]。本课题组前期研究发现,大鼠骨髓间充质干细胞(mesenchymal stem cell,MSC)移植能部分改善化学治疗药物所致的卵巢损伤[4],但细胞移植后存活率低下导致治疗效果不如预期,如何提高移植细胞的存活率是提高疗效的关键。热休克是干细胞移植前的一种预处理方法,文献报道其可通过上调热休克蛋白的表达提高细胞抗凋亡能力,使之存活力增加[5-6]。目前尚未见热休克预处理干细胞用于防治化学治疗性卵巢早衰的相关报道。
本研究首先确定了提高大鼠骨髓MSC抗凋亡能力的最佳热休克预处理条件,再通过体外实验以顺铂模拟化学治疗局部微环境探讨其对热休克预处理MSC活性的影响,最后检测化学治疗微环境下经热休克预处理的MSC对卵巢颗粒细胞(granulosa cell,GC)凋亡及存活的影响,探讨经热休克预处理的MSC对化学治疗性损伤的预防作用。
1 材料和方法 1.1 实验动物4~5周龄雌性SPF级Wistar大鼠4只,体质量80~100 g,购自南方医科大学实验动物中心[许可证号:SYXK(粤)2011-0074]。动物饲养条件:室温(23±2)℃,湿度45%~55%,光照周期12 h光明/12 h黑暗,自由摄食饮水,适应性饲养3~5 d。
1.2 大鼠骨髓MSC的分离、培养及鉴定无菌条件下分离大鼠双侧胫骨和股骨,从中间剪断股骨及胫骨,用注射器抽取适量完全培养基(含10%胎牛血清的DMEM/F12培养基)向骨髓腔中冲洗,获得单细胞悬液,以体积比1:1加入含有Percoll分离液的离心管内,1 048×g离心20 min,吸取中间乳白色的单个核细胞层,PBS洗2次后加完全培养基重悬,按1×106/mL的密度将细胞接种在25 cm2塑料透气培养瓶中。培养瓶放置在37 ℃、5% CO2培养箱中常规培养,48 h后观察到有细胞贴壁后半量更换细胞生长液,此后每隔3 d换液1次。细胞铺满培养瓶约80%时进行1:2传代,取生长状态良好的第3代大鼠骨髓MSC制成单细胞悬液,用流式细胞仪(美国BD Bioscience公司)检测细胞表面标志物CD44、CD45、CD29、CD34。
1.3 大鼠卵巢GC的分离、培养及鉴定 1.3.1 GC的分离、培养每只大鼠皮下注射孕马血清(北京索莱宝科技有限公司)100 IU,48 h后处死,无菌条件下迅速取出双侧卵巢,用含有1%双抗的PBS漂洗,用注射器针头刺破卵泡并轻轻挤压,使卵母细胞及GC逸出到预冷的、含有1%双抗的DMEM/F12培养基中,用200目不锈钢细胞筛过滤,168×g离心10 min。加入含10% FBS的DMEM/F12培养基重悬,置于37 ℃、5% CO2培养箱中培养,48 h后观察,每3 d换液1次。
1.3.2 GC的鉴定H-E染色观察细胞形态:制备GC爬片,用4%多聚甲醛固定20 min,用PBS洗3次,在苏木精水溶液中染色3 min,盐酸乙醇分化液分化15 s,冲洗后以返蓝液返蓝15 s,流水冲洗,伊红染色3 min,用流水冲洗后进行脱水、透明,以中性树脂封片,置于光学显微镜下观察细胞形态。
免疫细胞化学染色检测卵泡刺激素受体(follicle-stimulating hormone receptor,FSHR)蛋白表达:在培养板中将已爬好细胞的培养皿用PBS浸洗3次,每次3 min,后加入4%多聚甲醛固定15 min,用0.5% Triton X-100(PBS配制)室温通透20 min。在培养皿中加入新鲜配制的3%双氧水以去除内源性过氧化物酶封闭液,室温孵育10 min,PBS充分淋洗。吸净PBS后,在培养皿内滴加5%牛血清白蛋白封闭液,37 ℃封闭30 min。吸去封闭液,每个培养皿滴加稀释后的一抗(FSHR抗体,北京博奥森生物技术有限公司,货号bs-20658R,工作浓度1:500),放入湿盒中,4 ℃孵育过夜。取出培养皿,室温静置45 min,PBS浸洗后滴加聚合HRP标记的抗兔IgG二抗工作液(武汉博士德生物工程有限公司,货号SV0002),37 ℃孵育30 min,PBS充分淋洗。DAB显色5~10 min,自来水冲洗1 min;苏木精复染3 min,盐酸乙醇分化,返蓝;自来水冲洗1 min,脱水、透明、封片、镜检。
1.4 MSC热休克预处理最佳时间的确定实验分为5组:对照组、30 min组、1 h组、2 h组、3 h组。后4组将MSC培养瓶密封后置于42 ℃恒温水浴箱分别水浴30 min、1 h、2 h、3 h,从恒温水浴箱中取出后立即更换新鲜培养液,放置在37 ℃、5% CO2培养箱中常规培养24、48、72 h,用流式细胞仪(Annexin-Ⅴ/PI双染法)检测MSC凋亡情况,每组每个时间点检测4个样品。
1.5 最佳热休克预处理条件下MSC生物学特性的变化将MSC分为4组:对照组,不做处理;热休克预处理组,给予热休克预处理;顺铂组:直接于培养基中加入5 mg/L顺铂进行处理;热休克预处理+顺铂组,给予热休克预处理后于培养基中加入5 mg/L顺铂进行处理。
1.5.1 CCK-8法检测MSC增殖能力将细胞按照2×104/孔的密度铺于96孔板,每孔体积100 µL,每组5孔细胞。细胞贴壁生长后加入最适浓度(5 mg/L)的顺铂,24 h后分别加入10 μL CCK-8测试液(日本Dojindo公司),放入37 ℃、5% CO2培养箱中孵育1~4 h后上机检测。每组于每天相同时间各取5孔细胞,再分别加入10 μL CCK-8测试液,放入37 ℃、5% CO2培养箱中孵育1~4 h,用全自动酶标仪(美国Thermo公司)检测490 nm处光密度(D)值,连续7 d。
1.5.2 流式细胞术检测MSC凋亡情况培养72 h后收集各组细胞,制成单细胞悬液,用流式细胞仪(Annexin-Ⅴ/PI双染法)检测MSC凋亡情况,实验重复3次。
1.5.3 Hoechst33342/PI染色检测MSC存活情况收集细胞制成单细胞悬液,用固定液固定15 min,去固定液,PBS浸洗培养皿3次(每次3 min);加入Hoechst33342染色液染色5 min;去染色液,用PBS洗3次(每次3 min),加入PI染色液,于4 ℃冰箱孵育30 min;去染色液,用PBS洗3次(每次3 min),吸尽液体,洗涤时轻轻晃动,之后用抗淬灭封片液封片,在荧光显微镜(德国Carl Zeiss公司)下观察并拍照。
1.6 热休克预处理MSC对顺铂诱导GC凋亡的影响将GC分为4组:对照组,不做处理;顺铂组,加入2.5 mg/L顺铂诱导GC凋亡;MSC预防+顺铂组及热休克预处理MSC(heat shock-pretreated MSC,HS-MSC)预防+顺铂组,以1:1比例加入MSC或HS-MSC共培养24 h,后加入2.5 mg/L顺铂诱导GC凋亡。48 h后用流式细胞术检测GC凋亡率,Hoechst33342/PI染色测定GC存活率。具体实验方法同前。
1.7 统计学处理采用SPSS 20.0软件进行统计学分析。计量资料若符合正态分布及方差齐性,以x±s表示,多组间比较采用单因素方差分析(多重比较采用SNK法),两组间比较采用独立样本t检验。检验水准(α)为0.05。
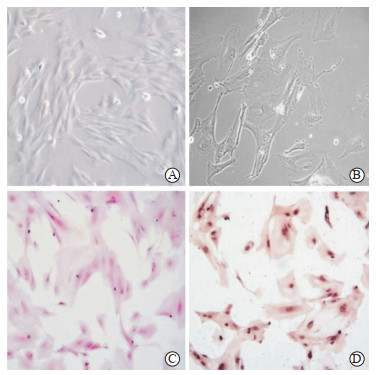
2 结果 2.1 大鼠骨髓MSC的培养及鉴定显微镜下观察第3代大鼠骨髓MSC,可见细胞形态均一,为成纤维细胞样的长梭形,排列有序(图 1A)。流式细胞术分析结果表明90%以上细胞表达CD44和CD29,而不表达CD34和CD45,为非造血干细胞的MSC。
|
图 1 光镜下大鼠骨髓MSC和卵巢GC的形态 Fig 1 Observation of rat bone marrow-derived MSCs and ovarian GCs morphology under microscope A: The 3rd generation bone marrow-derived MSCs; B: Rat ovarian GCs cultured in vitro for 3 d; C: Hematoxylin-eosin staining for identification of ovarian GCs; D: Immunocytochemical staining of FSHR for identification of ovarian GCs. MSC: Mesenchymal stem cell; GC: Granulosa cell; FSHR: Follicle-stimulating hormone receptor. Original magnification:×100 (A), ×400 (B-D) |
2.2 大鼠卵巢GC的分离、培养及鉴定
大鼠卵巢原代GC培养2~3 d可完全贴壁,呈单层贴壁集落样生长,胞质内可见颗粒样物质(图 1B)。经H-E染色后,显微镜下观察可见GC呈多角形或短梭形,细胞核大而圆、深染,细胞质呈淡红色,富含颗粒和空泡(图 1C)。通过免疫细胞化学染色检测细胞中FSHR表达情况,可见 > 95%的细胞质目的蛋白呈阳性(图 1D)。
2.3 热休克预处理MSC的最佳时间采用流式细胞术检测热休克处理不同时间(0 min、30 min、1 h、2 h、3 h)后再培养24、48及72 h的MSC凋亡率,单因素方差分析显示组间差异有统计学意义(F24 h=29.408,P24 h < 0.001;F48 h=39.206,P48 h < 0.001;F72 h=4.884,P72 h=0.010)。其中,热休克处理后再培养24 h时,对照组(0 min)、30 min组、1 h组、2 h组、3 h组的凋亡率分别为(5.88±1.80)%、(4.67±1.91)%、(3.93±1.11)%、(14.58±3.42)%、(19.61±3.66)%,1 h组的凋亡率最低;热休克处理后再培养48、72 h时,后4组凋亡率均有所下降,仍以1 h组的凋亡率最低。因此,热休克预处理MSC的最佳时间为1 h,后续实验中预处理均采用该条件。
2.4 热休克预处理对MSC生物学特性的影响 2.4.1 CCK-8法检测MSC增殖能力采用CCK-8检测MSC增殖能力,取各孔平均D值后绘制细胞生长曲线,结果显示热休克预处理组第2天、第3天细胞增殖加快(td2=29.198,Pd2 < 0.001;td3=33.686,Pd3 < 0.001),提示热休克预处理对MSC增殖有促进作用。第3天以后,随着培养时间的增加细胞生长趋于平稳。
2.4.2 流式细胞术检测MSC凋亡率采用流式细胞术检测细胞凋亡,结果显示对照组、热休克预处理组、顺铂组、热休克预处理+顺铂组MSC凋亡率分别为(8.08±0.44)%、(4.62±0.08)%、(14.30±0.80)%、(11.94±0.63)%,其中热休克预处理组MSC凋亡率低于对照组(P < 0.01),热休克预处理+顺铂组MSC凋亡率低于顺铂组(P < 0.05),提示热休克预处理有助于抗MSC凋亡。
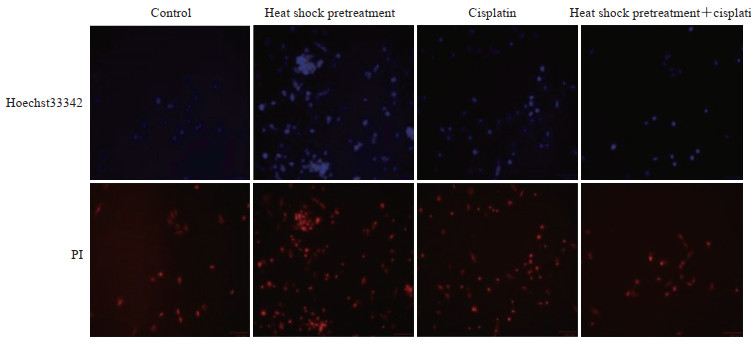
2.4.3 Hoechst33342/PI检测MSC存活情况由图 2可见,正常细胞呈现低蓝/低红色荧光,凋亡细胞呈现高蓝/低红色荧光,坏死细胞呈现低蓝/高红色荧光。热休克预处理组凋亡细胞比例低于对照组,热休克预处理+顺铂组凋亡细胞比例低于顺铂组,提示热休克预处理有助于抗MSC凋亡。
|
图 2 Hoechst33342/PI染色检测大鼠骨髓MSC凋亡 Fig 2 Rat bone marrow-derived MSCs apoptosis detected by Hoechst33342/PI staining PI: Propidium iodide; MSC: Mesenchymal stem cell. Original magnification: ×40 |
2.5 热休克预处理的MSC抑制顺铂诱导的GC凋亡
流式细胞术检测结果显示,对照组、顺铂组、MSC预防+顺铂组和HS-MSC预防+顺铂组GC凋亡率分别为(31.13±2.81)%、(53.81±1.89)%、(50.21±1.68)%、(39.88±1.65)%,4组的凋亡率差异有统计学意义(P < 0.001)。其中HS-MSC预防+顺铂组GC凋亡率低于顺铂组,差异有统计学意义(P < 0.05),说明热休克预处理的MSC可抑制顺铂诱导的GC凋亡,对GC有预防性保护作用。由图 3可见,MSC预防+顺铂组和HS-MSC预防+顺铂组凋亡GC(呈现高蓝/低红色荧光表现)比例均低于顺铂组,其中HS-MSC预防+顺铂组凋亡GC比例低于MSC预防+顺铂组,说明MSC和热休克预处理的MSC与GC共培养均能一定程度地预防顺铂诱导的GC凋亡,但热休克预处理的MSC预防作用更加明显。

|
图 3 Hoechst33342/PI染色检测大鼠卵巢GC凋亡 Fig 3 Rat ovarian GCs apoptosis detected by Hoechst33342/PI staining PI: Propidium iodide; GC: Granulosa cell; MSC: Mesenchymal stem cell; HS-MSC: Heat shock pretreatment mesenchymal stem cell. Original magnification: ×40 |
3 讨论
化学治疗是导致卵巢功能不全的常见原因之一。目前,化学治疗性卵巢早衰的治疗方法主要包括激素替代[7]、卵子和卵巢组织的冷冻保存[8]、卵巢的体外激活[9]、体外受精-胚胎移植等,这些方法均不能从根本上解决卵巢功能不全的问题,更不能预防卵巢功能的减退。本课题组前期将骨髓MSC应用于化学治疗性卵巢早衰的治疗中,通过构建动物模型和体外实验,证实骨髓MSC对卵巢的结构和功能有一定的修复作用[4]。本研究首先通过观察热休克预处理对大鼠骨髓MSC生物学特性的影响,进而探讨热休克预处理过的MSC对大鼠卵巢GC的影响。
目前热休克预处理已经作为一种提高细胞存活率的有效方法被深入研究[10-11]。Gao等[12]发现热休克反应能诱导大鼠MSC的HSP90上调,并进一步通过PI3K/Akt和ERK1/2通路促进MSC的迁移。Feng等[13]发现热休克处理后MSC移植存活率提高,并能有效改善心功能,减少心肌纤维化进程。为进一步探索热休克处理后骨髓MSC生物学特性的变化,本研究在顺铂诱导的化学治疗微环境下,检测了MSC的增殖能力、存活情况及凋亡率,结果提示热休克预处理可抑制顺铂诱导的MSC凋亡,并提高了MSC的增殖能力及存活率。说明热休克预处理可增加MSC对化学治疗微环境的耐受能力,可作为一种抗细胞凋亡的有效方法,有望解决移植后干细胞存活率低下的问题。同时,本研究以顺铂建立卵巢GC损伤的体外模型,发现与热休克预处理的MSC共培养的GC凋亡率更低,说明热休克预处理过的MSC对GC更具有预防性保护作用。
热休克反应是指生物体在热休克(或其他应激)状态下所表现的防御适应反应。热休克蛋白几乎存在于所有的原核生物和真核生物中[14],当细胞发生热休克反应后其表达能迅速上调[15]。多项研究表明在体内外实验中热休克蛋白被激活上调后可保护细胞免受外界损伤,提高细胞的存活率或生物活性[16-19]。Koga等[20]报道热休克治疗可增加内皮细胞中热休克蛋白72的表达,促进胰腺干细胞分化成胰岛β细胞,增加胰岛素分泌。还有研究发现小鼠胚胎干细胞中热休克蛋白27的过度表达能增加其对氯化物、顺铂等毒性作用的耐受性[21-22]。本研究将热休克预处理的方法应用于干细胞治疗卵巢早衰的研究中,发现热休克预处理后的MSC能抑制卵巢GC凋亡,保护卵巢功能。其具体作用机制是否与热休克蛋白有关,有待进一步探究。
综上所述,热休克预处理可提高化学治疗微环境下大鼠骨髓MSC的生物活性,抑制其凋亡。热休克预处理后的大髓骨髓MSC对顺铂诱导的大鼠卵巢GC凋亡有预防作用,但其具体机制仍有待探究。
| [1] |
RODRIGUEZ-WALLBERG K A, OKTAY K. Fertility preservation medicine:options for young adults and children with cancer[J]. J Pediatr Hematol Oncol, 2010, 32: 390-396. DOI:10.1097/MPH.0b013e3181dce339 |
| [2] |
WALLACE W H. Oncofertility and preservation of reproductive capacity in children and young adults[J]. Cancer, 2011, 117(10 Suppl): 2301-2310. |
| [3] |
JOHNSON J, CANNING J, KANEKO T, PRU J K, TILLY J L. Germline stem cells and follicular renewal in the postnatal mammalian ovary[J]. Nature, 2004, 428: 145-150. DOI:10.1038/nature02316 |
| [4] |
FU X, HE Y, XIE C, LIU W. Bone marrow mesenchymal stem cell transplantation improves ovarian function and structure in rats with chemotherapy-induced ovarian damage[J]. Cytotherapy, 2008, 10: 353-363. DOI:10.1080/14653240802035926 |
| [5] |
CHOUDHERY M S, BADOWSKI M, MUISE A, HARRIS D T. Effect of mild heat stress on the proliferative and differentiative ability of human mesenchymal stromal cells[J]. Cytotherapy, 2015, 17: 359-368. DOI:10.1016/j.jcyt.2014.11.003 |
| [6] |
SART S, MA T, LI Y. Preconditioning stem cells for in vivo delivery[J]. Biores Open Access, 2014, 3: 137-149. DOI:10.1089/biores.2014.0012 |
| [7] |
MACLARAN K, PANAY N. Premature ovarian failure[J]. J Fam Plann Reprod Health Care, 2011, 37: 35-42. DOI:10.1136/jfprhc.2010.0015 |
| [8] |
Practice Committees of American Society for Reproductive Medicine, Society for Assisted Reproductive Technology. Mature oocyte cryopreservation:a guideline[J]. Fertil Steril, 2013, 99: 37-43. DOI:10.1016/j.fertnstert.2012.09.028 |
| [9] |
KAWAMURA K, KAWAMURA N, HSUEH A J. Activation of dormant follicles:a new treatment for premature ovarian failure?[J]. Curr Opin Obstet Gynecol, 2016, 28: 217-222. DOI:10.1097/GCO.0000000000000268 |
| [10] |
VISSER Y P, WALTHER F J, LAGHMANI El H, LAARSE Av, WAGENAAR G T. Apelin attenuates hyperoxic lung and heart injury in neonatal rats[J]. Am J Respir Crit Care Med, 2010, 182: 1239-1250. DOI:10.1164/rccm.200909-1361OC |
| [11] |
ALLAMI N, JAVADI-PAYDAR M, RAYATNIA F, SEHHAT K, RAHIMIAN R, NOROUZI A, et al. Suppression of nitric oxide synthesis by L-NAME reverses the beneficial effects of pioglitazone on scopolamine-induced memory impairment in mice[J]. Eur J Pharmacol, 2011, 650: 240-248. DOI:10.1016/j.ejphar.2010.10.007 |
| [12] |
GAO F, HU X, XIE X, LIU X, WANG J. Heat shock protein 90 stimulates rat mesenchymal stem cell migration via PI3K/Akt and ERK1/2 pathways[J]. Cell Biochem Biophys, 2015, 71: 481-489. DOI:10.1007/s12013-014-0228-6 |
| [13] |
FENG Y, HUANG W, MENG W, JEGGA A G, WANG Y, CAI W, et al. Heat shock improves Sca-1+stem cell survival and directs ischemic cardiomyocytes toward a prosurvival phenotype via exosomal transfer:a critical role for HSF1/miR-34a/HSP70 pathway[J]. Stem Cells, 2014, 32: 462-472. DOI:10.1002/stem.1571 |
| [14] |
DOKLADNY K, MYERS O B, MOSELEY P L. Heat shock response and autophagy-cooperation and control[J]. Autophagy, 2015, 11: 200-213. DOI:10.1080/15548627.2015.1009776 |
| [15] |
JACOB P, HIRT H, BENDAHMANE A. The heat-shock protein/chaperone network and multiple stress resistance[J]. Plant Biotechnol J, 2017, 15: 405-414. DOI:10.1111/pbi.12659 |
| [16] |
ZHANG Y, BISHOP P A. Can L-glutamine augmented heat shock protein 70 expression prevent exercise-induced exertional heat stroke and sudden cardiac death?[J]. CNS Neurosci Ther, 2020, 26: 148-150. DOI:10.1111/cns.13217 |
| [17] |
MORI H, SAITO Y U, IWAHASHI S, IKEMOTO T, IMURA S, MORINE Y, et al. Impact of bevacizumab on liver damage after massive hepatectomy in rats[J]. In Vivo, 2019, 33: 1469-1476. DOI:10.21873/invivo.11626 |
| [18] |
XU W, GUO Y, HUANG Z, ZHAO H, ZHOU M, HUANG Y, et al. Small heat shock protein CRYAB inhibits intestinal mucosal inflammatory responses and protects barrier integrity through suppressing IKKβ activity[J]. Mucosal Immunol, 2019, 12: 1291-1303. DOI:10.1038/s41385-019-0198-5 |
| [19] |
GERAZOVA-EFREMOVA K, DINEVSKA-KJOVKAROVSKA S, MIOVA B. Heat-shock protein 70-mediated heat preconditioning attenuates hepatic carbohydrate and oxidative disturbances in rats with type 1 diabetes[J]. Can J Diabetes, 2019, 43: 345-353. DOI:10.1016/j.jcjd.2019.01.002 |
| [20] |
KOGA T, SHIRAKI N, YANO S, SUICO M A, MORINO-KOGA S, SATO T, et al. Mild electrical stimulation with heat shock guides differentiation of embryonic stem cells into Pdx1-expressing cells within the definitive endoderm[J/OL]. BMC Biotechnol, 2017, 17: 14. doi: 10.1186/s12896-017-0331-z.
|
| [21] |
TAI-NAGARA I, MATSUOKA S, ARIGA H, SUDA T. Mortalin and DJ-1 coordinately regulate hematopoietic stem cell function through the control of oxidative stress[J]. Blood, 2014, 123: 41-50. DOI:10.1182/blood-2013-06-508333 |
| [22] |
LIN T, CHAO C, SAITO S, MAZUR S J, MURPHY M E, APPELLA E, et al. p53 induces differentiation of mouse embryonic stem cells by suppressing Nanog expression[J]. Nat Cell Biol, 2005, 7: 165-171. DOI:10.1038/ncb1211 |
 2020, Vol. 41
2020, Vol. 41


