2. 海军军医大学(第二军医大学)长海医院药学部, 上海 200433
2. Department of Pharmacy, Changhai Hospital, Naval Medical University(Second Military Medical University), Shanghai 200433, China
微透析技术最早于20世纪60年代用于测量大鼠大脑中的神经递质浓度,后应用于动物其他组织中的药物研究[1]。应用微透析技术开展抗菌药物体内分布及其动力学的研究可以为临床个体化治疗提供实验依据[2]。左氧氟沙星是一种氟喹诺酮类抗菌药物,适用于皮肤软组织及各种感染(包括细菌性前列腺炎)的治疗。了解左氧氟沙星在前列腺和血液中的药代动力学特征对合理制定给药方案具有重要意义。应用微透析法进行药代动力学研究前必须先进行体外回收率和体内回收率的测定,一般体外回收率实验包括透析法和反透析法,而体内回收率实验仅可采用反透析法。本研究利用微透析法测定比格犬血液和前列腺组织中左氧氟沙星的体内、外回收率,以期为应用微透析技术研究前列腺组织的药代动力学提供实验基础。
1 材料和方法 1.1 仪器LC-2010AHT高效液相色谱仪(日本岛津公司),MS-H-Pro磁力加热搅拌器[大龙兴创实验仪器(北京)有限公司]。微透析设备(瑞典CMA公司)包括CMA4004四通道微量注射泵、CMA820型4 ℃的微量收集器、1 mL注射器、CMA20同心圆探针(探针透析膜长度10 mm、直径0.5 mm、相对分子质量截留20 000)。
1.2 试药左氧氟沙星标准品(批号130455-2016607,中国食品药品检定研究院),复方氯化钠注射液(林格液,成分为140 mmol/L Na+、3.0 mmol/L Ca2+、4.0 mmol/L K+),盐酸赛拉嗪注射液(速眠新Ⅱ,批号20180601,敦化市圣达动物药品有限公司),注射用盐酸替来他明盐酸唑拉西泮(舒泰50,批号:6VUL,法国维克有限公司)。水为超纯水(自制),乙腈为色谱纯,磷酸、磷酸二氢钾均为色谱级。
1.3 实验动物健康成年雄性比格犬4只,年龄1~2岁,体质量(12±1)kg,由海军军医大学(第二军医大学)实验动物中心提供,动物生产许可证号:SCXK(沪)2015-0005。
1.4 色谱条件Kromasil-C18色谱柱(150 mm×4.6 mm,5 μm),流动相为乙腈-10 mmol/L磷酸二氢钾溶液(用磷酸调节pH至3.0±0.1,体积比为15:85),紫外检测波长为294 nm,流速为1 mL/min,柱温为30 ℃,进样量为10 μL。
1.5 溶液配制称取适量左氧氟沙星标准品于容量瓶中,加林格液定容,制成1 mg/mL的母液并保存在4 ℃冰箱中待用。用林格液将母液依次稀释成50.0、25.0、10.0、5.0、2.5、1.0、0.5、0.25、0.1 μg/mL等质量浓度的微透析液样品溶液,同法配制定量下限(lower limit of quantitation,LLOQ)样品0.10 μg/mL、低浓度质控(low quality control,LQC)样品0.20 μg/mL、中浓度质控(medium quality control,MQC)样品3.0 μg/mL、高浓度质控(high quality control,HQC)样品40.0 μg/mL等4种样品溶液,微透析中的灌流液分别为1、8、40 μg/mL质量浓度的左氧氟沙星溶液。
1.6 方法学验证 1.6.1 专属性实验在1.4项色谱条件下,依次进样空白林格液、空白体内微透析液(颈静脉、前列腺)、体外含药微透析液(林格液配制而成)、体内含药微透析液(颈静脉、前列腺),考察林格液和内源性成分对药物的测定有无干扰。
1.6.2 标准曲线的建立对9个浓度水平的微透析液样品分别进行3次标准曲线评价。横坐标为左氧氟沙星质量浓度X(μg/mL),纵坐标为色谱峰面积Y,进行1/X2加权最小二乘法线性回归,拟合回归曲线方程。LLOQ信噪比 > 10,最低的检测限信噪比 > 3。
1.6.3 精密度和准确度实验将LLOQ、LQC、MQC、HQC 4个样品溶液分别平行制备6份,进样检测,样品中左氧氟沙星浓度根据当天制得的标准曲线计算,考察日内精密度及其准确度和日间精密度及其准确度。相对标准偏差(relative standard deviation,RSD;%)用于表示精密度,相对误差(relative error,RE;%)用于表示准确度,要求LQC、MQC、HQC的RSD和RE < 15%,LLOQ的RSD和RE < 20%。1.6.4稳定性实验为考察左氧氟沙星在模拟体温下的稳定性,将LQC、HQC的质控样品放在37 ℃烘箱中,分别在0、4、8、12、16 h后取样检测;为考察样品在室温条件下的稳定性,将其放在室温下,分别在0、8、12、16、20、24 h后取样检测;为考察样品在进样和收集条件下的稳定性,将其放在4 ℃冰箱中,分别在0、8、12、16、20、24 h后取样检测。所有样品均根据当日制得的标准曲线计算药物的浓度。
1.7 体外校正 1.7.1 流速对探针回收率的影响透析法:校正反应瓶中加入150 mL左氧氟沙星溶液(8 μg/mL),探针的半透膜部分悬在校正反应瓶正中间,空白林格液作为灌流液模拟体内环境,温度保持在(37±0.5)℃,磁力搅拌速度为200 r/min。参考文献[3]提出的典型流速值1~2 μL/min,本实验依次考察2.0、1.5、1.0 μL/min流速时的相对回收率,每改换一种流速均平衡1 h后接样,每一种流速共接5个样品,每一样品体积为30 μL。由于灌流期间校正反应瓶中的药物不断被带走,浓度不断被稀释,因此在接样前、接样后各取校正反应瓶中的溶液30 μL,以两种溶液浓度的平均值为原液浓度[4]。样品获得后直接进行HPLC测定。正向回收率按下式计算:RRD(%)=(Cdial/C0)×100%,其中Cdial为左氧氟沙星微透析液浓度,C0为左氧氟沙星的原液浓度。反透析法:探针的半透膜部分浸没在150 mL林格液中,灌流液为左氧氟沙星溶液(8 μg/mL),其余条件同透析法,每组流速接样结束后收集注射器中的药液为原液。反向回收率按下式计算:RRRD(%)=(C0-Cdial)/C0×100%,其中Cdial为左氧氟沙星微透析液浓度,C0为左氧氟沙星的原液浓度。
1.7.2 浓度对探针回收率的影响透析法:探针的半透膜部分浸没在不同浓度的左氧氟沙星溶液(1、8、40 μg/mL)中,林格液作为灌流液,流速为1.5 μL/min,其他实验条件和计算公式同1.7.1项中的透析法。反透析法:探针的半透膜部分浸没在林格液中,灌流液为不同浓度的左氧氟沙星溶液(1、8、40 μg/mL),流速为1.5 μL/min,其他实验条件和计算公式同1.7.1项中的反透析法。
1.8 体内校正 1.8.1 探针植入探针植入颈静脉:将比格犬用12 mg/kg剂量的舒泰50麻醉后,以混合麻醉(速眠新Ⅱ与舒泰50质量比为2:3)维持[5]。固定动物,在其右肩胛骨上用手术刀划开表皮皮肤,用止血钳分离周围结缔组织,找到右颈静脉,近心端用动脉夹夹住,远心端用缝合线结扎。用针刺破静脉后,立即将探针从刺破位置下方平行插入,直至半透膜完全进入血管后再抽回针,将探针与周围皮肤固定好,松开动脉夹查看回血情况,解开远心端缝合线,最后缝合伤口,并用蘸了生理盐水的纱布盖住伤口[6]。超声引导下将微透析探针植入前列腺组织:在超声引导下找到前列腺,将穿刺针(穿刺针套管和钢芯)刺入体内,抽出穿刺针里的钢芯,放入导丝,取出穿刺针套管,导管鞘套住导丝插入体内,探针由导管鞘进入前列腺组织,取出导丝和导管鞘,留下探针在前列腺部位。
1.8.2 探针稳定性考察探针植入后,血管同心圆探针用左氧氟沙星溶液(8 μg/mL)灌流,流速为1.5 μL/min,采样间隔1 h,采样时间共计12 h。样品接完后进行HPLC检测,按反向回收率的计算公式计算相对回收率。1.8.3反透析法考察不同浓度的左氧氟沙星对探针回收率的影响探针植入后,依次用不同浓度左氧氟沙星溶液(1、8、40 μg/mL)进行灌流,其他实验条件和计算公式同1.7.1项下的反透析法。
1.9 统计学处理采用SPSS 22.0软件进行统计学分析。结果以x±s表示,采用单因素方差分析比较探针在不同流速和不同浓度下回收率的差异,配对t检验比较同一探针的正向回收率和反向回收率间的差异。检验水准(α)为0.05。
2 结果 2.1 微透析样品的HPLC分析HPLC谱图显示,左氧氟沙星的峰值和保留时间不受林格液中内源性物质干扰,出峰时间为8.0 min(图 1),证明该方法的专属性良好,可用于后续左氧氟沙星浓度的检测。在0.1~50.0 μg/mL的浓度范围内左氧氟沙星具有良好的线性关系,回归曲线方程:Y=54 693.71X-441.016 9,r=0.998 7。本法LLOQ为0.1 μg/mL(信噪比 > 10),最低检测限为0.036 μg/mL(信噪比 > 3)。左氧氟沙星的日内精密度和准确度分别为0.12%~2.27%、-5.83%~2.41%,日间精密度和准确度分别为0.12%~3.39%、-2.01%~3.94%,表明该法精密度和准确度良好。在37 ℃下RE为-1.29%~-4.16%,25 ℃下RE为-6.74%~1.54%,4 ℃下RE为-7.43%~1.41%,表明在上述存放条件下左氧氟沙星均保存稳定。

|
图 1 左氧氟沙星的HPLC谱图 A:空白林格液;B:左氧氟沙星标准溶液(0.036 μg/mL左氧氟沙星);C:空白血微透析样品;D:含药血微透析样品;E:空白前列腺微透析样品;F:含药前列腺微透析样品. 1:左氧氟沙星. HPLC:高效液相色谱法 |
2.2 不同流速对探针回收率的影响
结果见表 1,不同流速下的相对回收率差异有统计学意义(P < 0.05),相对回收率随流速的增大而减小。在相同流速下,同一探针的正向回收率和反向回收率差异无统计学意义(P > 0.05)。
|
|
表 1 透析法、反透析法测定流速对血管同心圆探针相对回收率的影响 |
2.3 不同浓度对探针回收率的影响
结果显示,在左氧氟沙星溶液1、8、40 μg/mL浓度下正向回收率分别为(58.81±2.20)%、(58.74±1.59)%、(60.10±3.51)%,反向回收率分别为(59.07±1.94)%、(60.58±2.24)%、(59.32±2.60)%。在不同浓度下,两种方向上的回收率差异无统计学意义(P > 0.05),表明在1~40.0 μg/mL浓度范围内探针回收率与左氧氟沙星浓度无关。
2.4 探针体内回收率稳定性考察如图 2,12 h内颈静脉中的探针体内平均回收率为47.53%,RSD为5.21%;12 h内前列腺中的体内探针平均回收率为13.44%,RSD为7.86%。两者的RSD均 < 10%,表明探针回收率在体内稳定,可用于体内采样。
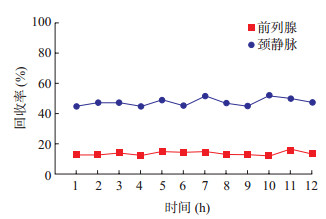
|
图 2 左氧氟沙星回收率稳定性考察 |
2.5 在体回收率的测定结果
在左氧氟沙星不同浓度下颈静脉和前列腺中探针的回收率分别为(48.46±1.94)%和(13.23±1.44)%,差异无统计学意义(P > 0.05)。
3 讨论体外测定同心圆探针相对回收率的目的是:(1)筛选出合适的流速,使得体外透析法和反透析法的相对回收率一致,在此前提下,可以用反透析法对左氧氟沙星的体内相对回收率进行校正[7-8],且流速要同时满足良好的时间分辨率及分析方法的要求;(2)药物可能会与探针塑料成分中的亲脂分子结合[9],且在药代动力学实验中待测部位的药物浓度一直在变化,因此必须要考察药物浓度对探针相对回收率是否有影响。
由于药代动力学实验采样在达峰时间点附近应密集(如每隔20 min采样1次),且HPLC的进样量是10 μL,同时参考既往报道[10]中的流速(1.5 μL/min),本研究取1.5 μL/min为最终的微透析流速。本研究结果显示,相同条件下,透析法和反透析法的回收率差异无统计学意义,说明药物在半透膜的不同方向透过量一致,左氧氟沙星不与半透膜结合,左氧氟沙星的药代动力学研究可使用微透析技术[10]。
本研究发现,比格犬麻醉程度若过深,探针的体内反向回收率将降低。原因为麻醉程度过深导致动物呼吸减弱、心脏泵血能力减弱、血液循环速度下降,从而导致半透膜周围的血液与药液对流不充分,药液累积在半透膜附近,产生浓度边界效应,半透膜中的药液与血液中的药液浓度差缩小,因此体内反向回收率将会降低。詹淑玉等[11]指出在体外当搅拌速率在200 r/min以下时回收率随搅拌速率的增大而增大,达到200 r/min或以上时回收率将达到稳定。因此,为保证回收率的稳定性,动物或人体进行微透析实验时麻醉程度不宜过深。
本研究中,体外的反向回收率高于体内的反向回收率,原因可能是在体内情况下半透膜所处位置有各种蛋白存在,有些蛋白(如糖蛋白)会黏附在半透膜上,导致半透膜的有效透过面积降低。另外与体外探针所处环境相比(仅林格液)体内环境更复杂,左氧氟沙星的分子运动受到阻滞。
志谢感谢河北燕达医院中心实验室王丹副主任药师对本研究中微透析技术的指导!
| [1] |
CHAURASIA C S, MüLLER M, BASHAW E D, BENFELDT E, BOLINDER J, BULLOCK R, et al. AAPS-FDA workshop white paper: microdialysis principles, application and regulatory perspectives[J]. Pharm Res, 2007, 24: 1014-1025. DOI:10.1007/s11095-006-9206-z |
| [2] |
ROBERTS J A, UDY A A, JARRETT P, WALLIS S C, HOPE W W, SHARMA R, et al. Plasma and target-site subcutaneous tissue population pharmacokinetics and dosing simulations of cefazolin in post-trauma critically ill patients[J]. J Antimicrob Chemother, 2015, 70: 1495-1502. DOI:10.1093/jac/dku564 |
| [3] |
BURAU D, PETROFF D, SIMON P, EHMANN L, WEISER C, DORN C, et al. Drug combinations and impact of experimental conditions on relative recovery in in vitro microdialysis investigations[J]. Eur J Pharm Sci, 2019, 127: 252-260. DOI:10.1016/j.ejps.2018.10.030 |
| [4] |
徐红燕, 汤湛, 王俏, 张望刚. 川芎嗪体内外微透析回收率实验研究[J]. 中国药学杂志, 2012, 47: 1750-1753. |
| [5] |
段明军, 陈冰心, 张春, 姜涛, 寿玺, 李志强, 等. 速眠新Ⅱ与舒泰复合麻醉剂对比格犬麻醉效果分析[J]. 动物医学进展, 2016, 37: 132-136. |
| [6] |
杨盟, 杨帝顺, 顾永卫, 唐晓萌, 刘继勇. 基于皮肤、血液双位点同步微透析技术的雷公藤甲素纳米乳体内药动学研究[J]. 中国药学杂志, 2018, 53: 894-899. |
| [7] |
谢毅, 凌家俊, 古锦辉. 羟基喜树碱微透析回收率的体外研究[J]. 中国中药杂志, 2012, 37: 1491-1493. |
| [8] |
刘春生, 刘德鼎, 姜云云, 周莉, 王丹. 高效液相色谱串联质谱法研究环磷酰胺线性微透析探针体内外校正影响因素[J]. 国际药学研究杂志, 2015, 42: 362-364. |
| [9] |
HURTADO F K, LAUREANO J V, DE A LOCK G, DERENDORF H, DALLA COSTA T. Enhanced penetration of moxifloxacin into rat prostate tissue evidenced by microdialysis[J]. Int J Antimicrob Agents, 2014, 44: 327-333. DOI:10.1016/j.ijantimicag.2014.06.011 |
| [10] |
ZIMMERMANN E S, LAUREANO J V, DOS SANTOS C N, SCHMIDT S, LAGISHETTY C V, DE CASTRO W V, et al. Simultaneous semimechanistic population analyses of levofloxacin in plasma, lung, and prostate to describe the influence of efflux transporters on drug distribution following intravenous and intratracheal administration[J]. Antimicrob Agents Chemother, 2016, 60: 946-954. DOI:10.1128/AAC.02317-15 |
| [11] |
詹淑玉, 阮钰尔, 刘国强, 丁宝月, 邵青. 葛根素微透析体外回收率测定及其影响因素研究[J]. 浙江大学学报(医学版), 2018, 47: 64-70. DOI:10.3785/j.issn.1008-9292.2018.02.09 |
 2020, Vol. 41
2020, Vol. 41


