2. 同济大学附属东方医院营养科, 上海 200120
2. Department of Nutrition, East Hospital, Tongji University, Shanghai 200120, China
消化道手术后患者消化道解剖生理结构发生变化,吸收面积减少,代谢过程也随之改变,出现如倾倒综合征、营养摄入不足、肠道吸收障碍等,这些均易继发营养不良[1],因此围手术期营养治疗尤为重要[2-3]。研究表明营养不良的手术患者容易发生感染性并发症[4]。营养治疗为患者安全度过术后应激反应期、促进伤口愈合、加快康复提供了营养物质[5-6]。因年龄、性别、民族、病种、机体对疾病的耐受力和机体应激程度的不同,机体能量代谢的改变亦有很大差异[7-8]。个体化营养治疗是基于循证医学,根据患者年龄、性别、体质、器官功能、实际能量消耗、代谢改变、疾病阶段等选择的营养方案,并定期监测[9],它更符合疾病治疗机制,可避免营养治疗量的不足或过度、营养治疗途径不科学等导致的不良后果,有利于改善患者的临床结局[10-11]。
本研究采用前瞻性、随机对照临床试验方案,对存在营养风险的消化系统手术围手术期患者分别给予个体化营养和非个体化营养治疗,探讨个体化营养治疗对患者营养状态和并发症的影响。
1 资料和方法 1.1 研究对象与分组选择2013年10月至2014年10月入住同济大学附属东方医院、复旦大学附属浦东医院、复旦大学附属肿瘤医院和中南大学湘雅医院胸外科、大肠外科、普通外科行择期消化道手术的684例患者作为研究对象。排除标准:(1)重度心肺功能障碍;(2)血肌酐水平超过正常上限的2倍;(3)天冬氨酸转氨酶水平超过正常上限的3倍或重度胆汁淤积,结合型胆红素水平超过正常上限的2倍;(4)存在肠外、肠内营养禁忌(生命体征不平稳、凝血障碍、胃肠功能严重障碍、无法纠正的代谢性疾病等);(5)对研究用肠外或肠内营养制剂的任何成分过敏;(6)在研究开始前6周或同时参加了其他临床研究;(7)妊娠期或哺乳期妇女;(8)研究者认为不适合参加本研究的患者。纳入标准:(1)年龄≥18岁;(2)具有营养治疗指征的消化系统择期中、大部手术患者,如食管切除术、胃局部或胃大部切除术、胰十二指肠切除术、结直肠局部或区段切除手术等;(3)营养风险筛查(nutritional risk screening,NRS)评分(依据NRS 2002[12])≥3分;(4)患者或亲属知情同意并签署研究知情同意书;(5)住院时间≥14 d;(6)能正常沟通和交流。最终纳入231例患者,根据入院顺序编号,利用Stata 13.0软件生成随机数字,再按照随机数字排序,将患者按1︰1比例分配到研究组(115例)和对照组(116例)。研究组患者接受个体化营养治疗,对照组接受非个体化营养治疗。本研究获得同济大学附属东方医院伦理委员会审批。
1.2 营养治疗方法 1.2.1 个体化营养治疗通过代谢车或采用Harris-Benedict(HB)公式计算监测个体化营养治疗患者的实际消耗能量,结合患者各脏器的功能,选择符合患者病理的营养方案,并按照病情变化及时调整治疗方案。
患者每天实际消耗的能量(kcal,1 kcal=4.186 kJ)计算:每天的静息能量消耗(resting energy expenditure,REE)=每天的基础能量消耗(basal energy expenditure,BEE)×应激系数。采用HB公式[13]计算BEE,BEE(男性)=66.47+13.75W+5.003 3H-6.755A,BEE(女性)=655.1+9.563W+1.85H-4.676A,其中W为体质量(kg),H为身高(cm),A为年龄(岁)。应激因素(应激系数)为无并发症的大手术(1.0~1.1),中等创伤、中等腹膜炎(1.25),严重创伤、感染、器官衰竭(1.3~1.5),大于体表面积40%的烧伤(2),体温升高1 ℃(1.1),体温升高2 ℃(1.2)。
营养供给原则:(1)能量为25~30 kcal•kg-1•d-1,氮量为0.15~0.20 g•kg-1•d-1,脂肪应占总能量的25%~40%;(2)肠外营养的热氮比为120 kcal:1 g,以葡萄糖:胰岛素(4~6):1比例给予外源性胰岛素;(3)术前在胃肠道有功能的条件下,口服或管饲肠内营养,肠内营养热量不能满足的部分,按热量计算给予肠外营养、实施肠内营养与肠外营养联合应用;(4)术后第1天开始给予肠外营养,患者肠蠕动恢复后开始向肠内营养过渡,并逐步增加肠内营养,减少肠外营养,直至完全过渡到肠内营养;(5)肠外营养选择经周围静脉置管或中心静脉供给。
1.2.2 非个体化营养治疗根据医师临床经验、患者病情和饮食习惯,术前和术后给予非个体化营养治疗。患者自由饮食或口服肠内营养或静脉营养,补充碳水化合物、脂肪乳、氨基酸、复合维生素、无机盐等。
1.3 观测指标 1.3.1 社会人口学及其他基线资料研究采集的基线数据包括性别、年龄、民族、身高、体质量、BMI、文化程度、居住地、医疗费用支付方式、病程、临床主要诊断、NRS评分和入院时间等。
1.3.2 临床监测指标分别于入组时(D0)、营养治疗第5天(D5,即术前1 d)、第9天(D9,即术后第3天)、第15天(D15,即术后第9天)清晨7:30至8:30采集患者空腹静脉血,用美国雅培全自动C8000生物化学测定仪测定血常规(白细胞计数、血红蛋白)、肝功能(血清总蛋白、血清白蛋白、血清前白蛋白、转氨酶、胆红素)、肾功能(尿素氮、血肌酐)、免疫功能(淋巴细胞计数)、血脂(三酰甘油、总胆固醇)等。
1.4 统计学处理对收集的资料进行编号,通过Epidata 3.1软件对研究数据进行双录入,建立数据库;用SPSS 19.0软件进行统计学分析,以Excel软件作为辅助分析工具。计数资料以例数和百分数表示,两组间比较采用χ2检验、校正χ2检验或Fisher确切概率检验。计量资料以Kolmogorov-Smimov法进行正态性检验、Levene法进行方差齐性检验,呈正态分布且方差齐的计量资料以x±s表示,组间比较采用独立样本t检验;等级资料、非正态分布或方差不齐资料采用Mann-Whitney U秩和检验。采用重复测量资料的方差分析对上述各临床监测指标进行组内和组间比较,首先对数据进行Mauchly球对称检验,若符合球对称假设,则不需要进行自由度校正,否则采用Greenhouse-Geisser校正法进行自由度校正。营养生物化学指标随NRS评分的变化情况采用Spearman等级秩相关分析。检验水准(α)为0.05。
2 结果 2.1 研究对象社会人口学特征比较14例患者在研究结束前退出本研究,其中研究组3例[因不良事件提前退出1例、病例脱落2例(肠外或肠内营养不耐受1例、失访1例)]、对照组11例[因不良事件提前退出3例、病例脱落8例(肠外或肠内营养不耐受2例、患者要求退出4例、失访2例)],最终完成临床试验研究的患者共计217例,研究组112例、对照组105例。社会人口学资料分析显示,两组患者中男性占比均较高;研究组平均年龄低于对照组,高中学历的患者占比高于对照组,农村患者及医保付费患者占比高于对照组,但差异均无统计学意义(P均 > 0.05)。见表 1。
|
|
表 1 研究对象社会人口学特征比较 Tab 1 Comparison of social demographic characteristics of subjects |
2.2 研究对象生物化学指标及手术类型比较
两组患者入组时身高、体质量、血压、心率、尿素氮、血肌酐、血清总蛋白、血清白蛋白、血清前白蛋白、血糖、血红蛋白、总胆固醇、三酰甘油、淋巴细胞计数、白细胞计数及手术类型差异均无统计学意义(P均 > 0.05),见表 2。
|
|
表 2 两组患者生物化学指标基线数据及手术类型比较 Tab 2 Comparison of baseline biochemical indicators and surgical types between two groups |
2.3 研究对象NRS评分比较
研究组患者NRS评分3分45例、4分45例、5分17例、6分3例、7分2例,对照组患者NRS评分3分50例、4分36例、5分11例、6分6例、7分2例。两组NRS评分差异无统计学意义(P > 0.05)。
2.4 营养生物化学指标与NRS评分的相关性分析Spearman等级秩相关分析显示,两组患者在入组时血清总蛋白、血清白蛋白、血清前白蛋白和血红蛋白水平均随NRS评分的增加而减少,呈负相关性(研究组:rs=-0.930、-0.766、-0.807、-0.681,P均 < 0.05;对照组:rs=-0.913、-0.793、-0.719、-0.652,P均 < 0.05),且两组之间呈相同趋势(图 1)。
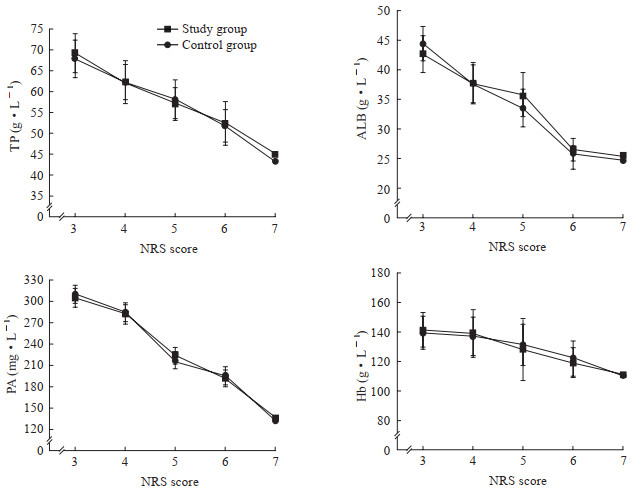
|
图 1 两组患者营养生物化学指标随NRS评分的变化 Fig 1 Changes of nutritional biochemical indexes with NRS score of patients in two groups Study group: The patients received individualized nutritional therapy; Control group: The patients received non-individualized nutritional therapy. NRS: Nutritional risk screening; TP: Total protein; ALB: Albumin; PA: Prealbumin; Hb: Hemoglobin. n=45, 45, 17, 3 and 2 in study group, and 50, 36, 11, 6 and 2 in control group, with NRS score of 3, 4, 5, 6, and 7, respectively; x±s (there were only two patients with NRS score of 7 in both group, so the data were described by x) |
2.5 研究对象围手术期临床监测指标的比较 2.5.1 两组患者围手术期相关临床监测指标的组内比较
研究组患者在D0、D5、D9和D15时血清总蛋白、血清白蛋白、血清前白蛋白水平均呈先上升后下降再上升趋势(P < 0.05),淋巴细胞计数、白细胞计数均呈先下降后上升趋势(P < 0.05),但各指标变化均在正常范围内。对照组患者在D0、D5、D9和D15时血清白蛋白水平呈先下降后上升趋势(P < 0.05),血清前白蛋白水平、淋巴细胞计数均呈先上升后下降再上升趋势(P < 0.05),但各指标变化均在正常范围内。其余指标组内比较差异均无统计学意义(P均 > 0.05)。见表 3。
|
|
表 3 两组患者围手术期相关临床监测指标的变化 Tab 3 Changes in perioperative clinical monitoring indicators of patients in the two groups |
2.5.2 两组患者围手术期临床监测指标的组间比较
分别在D0、D5、D9和D15时对研究组和对照组患者各相关营养指标进行组间比较,两组重复测量资料的方差分析显示,入组后研究组患者血清总蛋白和血清白蛋白水平均高于对照组(F=19.340,P < 0.05;F=5.430,P < 0.05)。术前1 d(D5)研究组患者白细胞计数低于对照组,术后第9天(D15)研究组患者白细胞计数高于对照组(F=14.370,P < 0.05)。血清总蛋白、血清白蛋白、白细胞计数变化均在正常范围内,其余指标组间差异均无统计学意义(P均 > 0.05)。见表 3。
2.5.3 两组患者围手术期临床监测指标分组与时间交互效应两组重复测量资料的方差分析显示,研究组和对照组患者各相关营养指标分组因素和时间因素均不存在交互效应(P > 0.05),即组间比较结果排除了时间因素对各相关营养和免疫指标的影响。
3 讨论营养不良或营养风险严重影响着围手术期患者预后和生活质量[14-16]。本研究入选围手术期患者共684例,经NRS评估存在营养风险的患者为231例,营养风险发生率为33.8%,接近已有流行病学调查数据中我国住院患者的营养风险发生率(35.3%)[17]。本研究最终共纳入217例消化系统手术围手术期患者,研究组和对照组患者基线特征比较差异均无统计学意义,表明两组具有较好的可比性。对两组患者的社会人口学特征分析结果显示,就性别因素而言,两组男性患者均多于女性,合并比例为2.24:1,与已有研究报道的消化系统疾病男女发病率之比2:1~4:1[18]相似。入组患者以中老年患者居多,其中研究组的平均年龄为(64.1±10.7)岁,对照组为(66.7±10.2)岁,虽然两组年龄差异无统计学意义,但与已有研究报道的消化系统手术患者逐年低龄化结果[19]相似,提示做好围手术期营养治疗及保证患者术后远期生活质量的意义重大。两组患者中,城镇人口占就诊人口的大多数,医疗费用支付方式以城镇医保为主。
本研究入组患者的一般生物化学指标无组间差异,均为NRS评分3~7分的消化系统择期手术患者,包括食管切除术、胃局部或胃大部切除术、胰十二指肠切除术、结直肠局部或区段切除术等。随着NRS评分的增加,患者人数减少,且两组患者NRS评分分布相似。其中,NRS评分3分、4分人数分别占总人数的43.8%(95/217)、37.3%(81/217),即超过80%存在营养风险的患者NRS评分集中在分数较低的阶段,提示消化系统疾病围手术期患者应该尽早采取有效营养治疗,有利于改善患者的营养状态。
本研究对两组患者血清总蛋白、血清白蛋白、血清前白蛋白和血红蛋白与NRS评分进行相关性分析,结果均呈负相关,即NRS评分越高,相关营养指标水平越低,且无组间差异,表明NRS评价消化系统疾病围手术期患者的营养状态具有良好的预测价值和准确性。
由于病变累及消化道,患者常存在恶心、呕吐、食欲不振等症状,影响食物的摄入和营养物质的消化与吸收。同时由于疾病因素使机体代谢异常,影响脂肪代谢和蛋白质合成,进一步加重消化道症状,使患者入院时就存在营养状态下降[20]。本研究纳入NRS评分≥3分的患者,入组时其血清总蛋白、血清白蛋白及淋巴细胞计数偏低。
尽管手术切除了病变部位,但是术后第3天(即营养治疗第9天)患者的各项营养及免疫生物化学检测指标均有所下降。这可能是由于消化系统疾病围手术期患者需要完善各项对患者饮食有特殊要求的术前检查,如胃镜、肠镜等,这些医源性因素导致摄入减少。同时,由于术后消化道重建、麻醉、疼痛和术后患者应多卧床休息的传统观念等原因,患者术后活动量明显降低,影响胃肠道功能恢复[21]。临床医师担心过早给予肠内营养或经口进食,患者容易出现恶心、呕吐、腹胀等消化道反应症状,因此按照非个体化营养治疗,患者需要等到胃肠道功能恢复后才开始经口进食,并要求饮食从流质-半流质-固体进行过渡,而这个过程达到患者正常营养需求一般需要3 d以上。
BMI、血清总蛋白、血清白蛋白和血清前白蛋白是临床常用的评价营养状态的指标,其中血清白蛋白是反映机体蛋白代谢、肝损伤程度及营养状况的灵敏指标之一[22],研究认为血清白蛋白是评价营养状态高度可靠的指标,低于30 g/L的低蛋白血症是死亡的最单一指标[23]。本研究发现,研究组患者在术后第9天(即营养支持治疗第15天)其血清总蛋白、血清白蛋白及血清前白蛋白等营养生物化学指标均较入组时或术后第1天增加,提示实施个体化营养有利于患者术后营养状况的改善。而对照组患者虽在术后第9天其血清前白蛋白较术前1 d增加,但增加幅度低于研究组患者,提示个体化营养在改善患者术后营养状况方面优于非个体化营养治疗。其原因可能是在实施非个体化营养治疗时,临床医师对所有患者均采用相同或相似的营养配方,如卡文三腔袋、静脉营养“全合一”或自由进食等,这不可避免导致营养治疗不足或过度,从而造成摄入能量和营养物质缺乏或偏高,不利于患者术后恢复。
通过外科手术切除病变部位,减少疾病产生的免疫抑制效应,可解除其对机体产生的免疫功能抑制[24]。但手术本身对机体是一种创伤,会导致机体的免疫功能下降。由于术前机体免疫功能受到抑制和手术创伤导致的免疫功能下降,许多研究发现围手术期营养支持尤其免疫增强的营养支持在降低术后感染性并发症发生率方面有积极作用[25-27]。本研究中,术后第9天研究组与对照组患者的淋巴细胞计数较入组时均上升,且术前1 d研究组患者白细胞计数低于对照组患者,但术后第9天高于对照组患者,差异有统计学意义,提示个体化营养在维持患者免疫功能方面优于非个体化营养支持治疗。
综上所述,消化系统手术围手术期实施个体化营养治疗有利于患者术后营养状况的改善,并且个体化营养支持治疗在改善患者术后营养状况方面优于非个体化营养支持治疗。
志谢 感谢复旦大学附属浦东医院、复旦大学附属肿瘤医院和中南大学湘雅医院对本研究的大力支持与帮助。
| [1] |
黎介寿. 营养与加速康复外科[J]. 肠外与肠内营养, 2007, 14: 65-67. |
| [2] |
KEHLET H, WILMORE D W. Evidence-based surgical care and the evolution of fast-track surgery[J]. Ann Surg, 2008, 248: 189-198. DOI:10.1097/SLA.0b013e31817f2c1a |
| [3] |
黎介寿. 营养支持治疗与加速康复外科[J]. 肠外与肠内营养, 2015, 22: 65-67. |
| [4] |
CORREIA M I T D, PERMAN M I, WAITZBERG D L. Hospital malnutrition in Latin America:a systematic review[J]. Clin Nutr, 2017, 36: 958-967. DOI:10.1016/j.clnu.2016.06.025 |
| [5] |
江志伟, 黎介寿, 汪志明, 李宁, 柳欣欣, 李伟彦, 等. 加速康复外科用于直肠癌前切除病人价值探讨[J]. 中国实用外科杂志, 2008, 28: 59-61. |
| [6] |
DUDRICK S J, WILMORE D W, VARS H M, RHOADS J E. Long-term total parenteral nutrition with growth, development, and positive nitrogen balance[J]. Surgery, 1968, 64: 134-142. |
| [7] |
黎介寿. 胃肠手术的"围手术期营养处理"[J]. 肠外与肠内营养, 2013, 20: 65-67. |
| [8] |
KORETZ R L, LIPMAN T O, KLEIN S; American Gastroenterological Association. AGA technical review on parenteral nutrition[J]. Gastroenterology, 2001, 121: 970-1001. DOI:10.1016/S0016-5085(01)92000-1 |
| [9] |
THOMAS S K, HUMPHREYS K J, MILLER M D, CAMERON I D, WHITEHEAD C, KURRLE S, et al. Individual nutrition therapy and exercise regime: a controlled trial of injured, vulnerable elderly (INTERACTIVE trial)[J/OL]. BMC Geriatr, 2008, 8: 4. doi: 10.1186/1471-2318-8-4.
|
| [10] |
TAVAKOLI-ARDAKANI M, NEMAN B, MEHDIZADEH M, HAJIFATHALI A, SALAMZADEH J, TABARRAEE M. Clinical effect of individualized parenteral nutrition vs conventional method in patients undergoing autologous hematopoietic SCT[J]. Bone Marrow Transplant, 2013, 48: 958-962. DOI:10.1038/bmt.2012.280 |
| [11] |
Wernerman J. Individualized ICU nutrition for a better outcome[J]. Intensive Care Med, 2011, 37: 564-565. DOI:10.1007/s00134-011-2149-9 |
| [12] |
RABITO E I, MARCADENTI A, DA SILVA FINK J, FIGUEIRA L, SILVA F M. Nutritional risk screening 2002, short nutritional assessment questionnaire, malnutrition screening tool, and malnutrition universal screening tool are good predictors of nutrition risk in an emergency service[J]. Nutr Clin Pract, 2017, 32: 526-532. DOI:10.1177/0884533617692527 |
| [13] |
FRANKENFIELD D C, MUTH E R, ROWE W A. The Harris-Benedict studies of human basal metabolism:history and limitations[J]. J Am Diet Assoc, 1998, 98: 439-445. DOI:10.1016/S0002-8223(98)00100-X |
| [14] |
CAREY S, FERRIE S, RYAN R, BEATON J, YOUNG J, ALLMAN-FARINELLI M. Long-term nutrition intervention following major upper gastrointestinal surgery:a prospective randomized controlled trial[J]. Eur J Clin Nutr, 2013, 67: 324-329. DOI:10.1038/ejcn.2013.17 |
| [15] |
VAN DEN BERG M G, RASMUSSEN-CONRAD E L, VAN NISPEN L, VAN BINSBERGEN J J, MERKX M A. A prospective study on malnutrition and quality of life in patients with head and neck cancer[J]. Oral Oncol, 2008, 44: 830-837. DOI:10.1016/j.oraloncology.2007.11.002 |
| [16] |
ZACHARIAS C, ZACHARIAS T. Outcome 1 year after digestive surgery in malnourished, elderly patients, with an emphasis on quality of life analysis[J]. Can J Surg, 2013, 56: 128-134. DOI:10.1503/cjs.025411 |
| [17] |
蒋朱明, 陈伟, 朱赛楠, 姚晨. 我国东、中、西部大城市三甲医院营养不良(不足)、营养风险发生率及营养支持应用状况调查[J]. 中华临床营养杂志, 2008, 16: 335-337. |
| [18] |
董颖, 杨文君. 消化道恶性肿瘤流行病学特征与发病现状分析[J]. 医学综述, 2014, 20: 429-431. |
| [19] |
HERSZÉNYI L, TULASSAY Z. Epidemiology of gastrointestinal and liver tumors[J]. Eur Rev Med Pharmacol Sci, 2010, 14: 249-258. |
| [20] |
NORMAN K, PICHARD C, LOCHS H, PIRLICH M. Prognostic impact of disease-related malnutrition[J]. Clin Nutr, 2008, 27: 5-15. DOI:10.1016/j.clnu.2007.10.007 |
| [21] |
吴国豪. 胃肠手术患者围手术期营养支持治疗[J]. 中华胃肠外科杂志, 2015, 18: 638-641. |
| [22] |
ARINZON Z, PEISAKH A, BERNER Y N. Evaluation of the benefits of enteral nutrition in long-term care elderly patients[J]. J Am Med Dir Assoc, 2008, 9: 657-662. DOI:10.1016/j.jamda.2008.06.002 |
| [23] |
GILBRIDE J A, SPECTOR S. Nutritional consideration for the stroke patient with dysphagia[J]. Top Stroke Rehabil, 1996, 3: 51-68. DOI:10.1080/10749357.1996.11754122 |
| [24] |
彭俊平, 胡勇, 冯燮林. 晚期胰腺癌围手术期免疫调节治疗的疗效评价[J]. 中华肝胆外科杂志, 2000, 2: 29-31. |
| [25] |
KLEK S, SZYBINSKI P, SZCZEPANEK K. Perioperative immunonutrition in surgical cancer patients:a summary of a decade of research[J]. World J Surg, 2014, 38: 803-812. DOI:10.1007/s00268-013-2323-z |
| [26] |
PLANK L D, MATHUR S, GANE E J, PENG S L, GILLANDERS L K, MCILROY K, et al. Perioperative immunonutrition in patients undergoing liver transplantation:a randomized double-blind trial[J]. Hepatology, 2015, 61: 639-647. DOI:10.1002/hep.27433 |
| [27] |
RUIZ-TOVAR J, GARCIA J G. Evidence of the effect of immunonutrition on the prevention of surgical site infection[J]. Surg Technol Int, 2014, 24: 41-44. |
 2020, Vol. 41
2020, Vol. 41


