2. 焦煤集团中央医院妇科, 焦作 454150
2. Department of Gynecology, Central Hospital of Jiaozuo Coalfield Group Corporation, Jiaozuo 454150, Henan, China
在西方发达国家,子宫内膜癌的发病率居女性生殖系统恶性肿瘤的首位,并且近20年在全球范围内其发生率升高50%以上[1-3]。子宫内膜癌发病机制不详,近年研究发现瞬时受体电位(transient receptor potential,TRP)通道家族中的多个成员与肿瘤的发生有关[4-6]。本研究旨在观察子宫内膜癌组织中瞬时受体电位阳离子通道亚家族C成员6(transient receptor potential cation channel subfamily C member 6,TRPC6)的表达变化,并探讨TRPC6对子宫内膜癌细胞周期的调控作用。
1 材料和方法 1.1 组织标本收集2011年1月至2015年6月在河南省人民医院手术治疗的子宫内膜癌患者的组织标本32例,患者年龄为28~75岁,平均年龄为(55.1±10.4)岁;同时取因子宫平滑肌瘤切除子宫的正常子宫内膜组织标本30例(术后病理证实为良性病变)和不典型增生组织标本30例(术后病理证实为子宫内膜不典型增生)。患者术前均未接受放射治疗、化学治疗或内分泌治疗。1.2细胞培养和分组子宫内膜癌细胞株HEC-1A购自美国典型培养物保藏中心,培养于含8% FBS的DMEM/F12培养液中。
1.2.1 TRPC6阻断剂处理将HEC-1A细胞分为不同浓度4组,其中3组分别以5、10、20 μmol/L的TRPC6阻断剂SKF96365(美国Sigma公司)刺激24 h,另一组则加入相同体积的DMSO(SKF96365的溶剂)作为对照。1.2.2 TRPC6 RNA干扰实验按脂质体Lipofectamine 2000(美国Invitrogen公司)操作步骤分别将TRPC6小干扰RNA(small interfering RNA,siRNA)和阴性对照siRNA转染HEC-1A细胞,转染后培养48 h。TRPC6 siRNA序列为5′-TTC CCG CCA TGA GCC AGA-3′(正义链)、5′-TCT GGC TCA TGG CGG GAA-3′(反义链),阴性对照siRNA的序列为5′-UAA GGC UAU GAA GAG AUA C-3′(正义链)、5′-AUU CCG AUA CUU CUC UAU G-3′(反义链)。
1.3 qRT-PCR检测TRPC6 mRNA的表达使用TRIzol一步法提取组织总RNA,用分光光度计测定总RNA浓度。按反转录试剂盒(加拿大Fermentas公司)说明书操作合成cDNA。TRPC6上游引物序列为5′-GCC AAT GAG CAT CTG GAA AT-3′,下游引物序列为5′-TGG AGT CAC ATC ATG GGA GA-3′;GAPDH上游引物序列为5′-ATG GGG AAG GTG AAG GTC G-3′,下游引物序列为5′-GGG GTC ATT GAT GGC AAC AAT A-3′。引物均由中国金斯瑞生物科技有限公司合成。qRT-PCR反应体系:上、下游引物各0.5 μL,cDNA模板溶液1 μL,10×PCR缓冲液5 μL,dNTP(各2.5 mmol/L)4 μL,MgCl2(25 mmol/L)4 μL,Taq DNA聚合酶(5 U/μL)0.5 μL,荧光染料(SYBR Green)1 μL,用灭菌水补足40 μL。反应条件:95 ℃ 3 min;92 ℃ 1 min,60 ℃ 45 s,72 ℃ 45 s,共35个循环。
1.4 蛋白质印迹法检测TRPC6蛋白的表达在粉碎的子宫内膜组织和培养的子宫内膜癌HEC-1A细胞中加入细胞裂解液,离心后取上清液,并检测蛋白浓度。用SDS-PAGE分离蛋白,在半干转膜仪中将蛋白转移到PVDF膜上。分别加入一抗(兔多克隆TRPC6抗体,美国Sigma公司)和二抗(HRP标记的山羊抗兔多克隆抗体,美国Santa Cruz公司)进行孵育,加入增强化学荧光发光试剂(英国Amersham公司)显影。洗膜重新标记内参照抗体GAPDH,过程同上。扫描放射自显影条带,用ImageJ软件分析各条带的灰度值,将TRPC6与GAPDH灰度值的比值作为TRPC6蛋白的相对表达水平。
1.5 细胞周期及细胞周期相关蛋白的检测充分消化细胞,用流式细胞术检测细胞周期。采用蛋白质印迹法检测细胞分裂周期蛋白2(cell division cycle 2,CDC2)和磷酸化细胞分裂周期蛋白2(phosphorylated cell division cycle 2,pCDC2)的表达(方法同TRPC6蛋白表达的检测)。
1.6 统计学处理采用SPSS 14.0软件进行统计学分析。符合正态分布的计量资料以-x± 表示,多组间比较采用单因素方差分析,两组间比较采用独立样本t检验;不符合正态分布的计量资料组间比较采用非参数检验。检验水准(α)为0.05。
2 结果 2.1 子宫内膜癌组织中TRPC6的表达子宫内膜癌组织中TRPC6 mRNA和蛋白的表达水平均高于不典型增生子宫内膜组织和正常子宫内膜组织,差异有统计学意义(P < 0.01,图 1)。

|
图 1 TRPC6 mRNA和蛋白在3种子宫内膜组织中的表达 |
2.2 SKF96365对子宫内膜癌细胞周期的影响
由表 1可见,不同浓度SKF96365作用24 h后,呈剂量依赖的方式干扰子宫内膜癌细胞周期,将细胞阻滞于G2/M期,表现为G2/M期细胞比例增加、G0/G1期细胞比例减少。
|
|
表 1 不同浓度SKF96365对子宫内膜癌细胞周期的影响 |
2.3 转染TRPC6 siRNA对子宫内膜癌细胞周期及细胞周期相关蛋白的影响
TRPC6 siRNA转染子宫内膜癌细胞48 h后,TRPC6蛋白表达量明显降低,为对照组的(36.74±7.45)%,说明干扰效果较好。与阴性对照siRNA转染组相比,TRPC6 siRNA转染组子宫内膜癌细胞G2/M期细胞比例增加[(29.33±2.75)% vs(14.82±1.98)%,P < 0.01],G0/G1期细胞比例减少[(48.15±3.24)% vs(53.14±4.44)%,P < 0.05]。TRPC6 siRNA转染HEC-1A细胞48 h后,细胞周期相关蛋白pCDC2表达增高,而CDC2蛋白的表达量不变(图 2)。
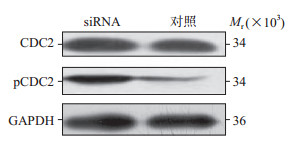
|
图 2 TRPC6 siRNA转染对子宫内膜癌细胞周期相关蛋白CDC2和pCDC2的影响 TRPC6:瞬时受体电位阳离子通道亚家族C成员6; siRNA:小干扰RNA; CDC2:细胞分裂周期蛋白2; pCDC2:磷酸化细胞分裂周期蛋白2; GAPDH:甘油醛-3-磷酸脱氢酶 |
3 讨论
TRP通道是一类非选择性阳离子通道,主要介导钙离子的转运,在不同的细胞中具有不同的表达和功能。近年来研究发现TRPC6在胃癌、前列腺癌、乳腺癌、食管鳞状细胞癌和肝癌等组织中高表达且参与这些肿瘤细胞增殖、周期调控和肝癌细胞转移机制的调控[5-11];并且发现TRPC6是通过相关的受体调控TRPC6通道电流的变化、进而引发细胞膜电位的去极化和钙离子相关的细胞生理活动来参与调控细胞的各种生理活动[12]。然而,目前尚不清楚TRPC6是否在子宫内膜癌组织中异常表达并参与调控子宫内膜癌细胞生理活动。本研究应用qRT-PCR技术和蛋白质印迹法检测了子宫内膜癌组织、不典型增生子宫内膜组织和正常子宫内膜组织中TRPC6 mRNA和蛋白的表达,结果显示子宫内膜癌组织中TRPC6 mRNA和蛋白表达明显高于正常子宫内膜组织和不典型增生子宫内膜组织,提示TRPC6可能参与子宫内膜癌的发生、发展。
细胞周期的调控异常与肿瘤的发生关系密切。研究发现TRPC6可改变细胞的膜电位,并参于细胞周期的调控[13]。本研究发现阻滞TRPC6通道或抑制TRPC6的表达可使子宫内膜癌细胞阻滞于G2/M期,使G0/G1期细胞比例减少,同时使pCDC2表达升高。说明TRPC6表达降低后pCDC2不能去磷酸化,细胞被阻滞于G2/M期;同时也提示TRPC6高表达可能通过某种机制导致pCDC2去磷酸化,使细胞周期紊乱而发生异常增殖,导致细胞癌变。
综上所述,本研究发现TRPC6在子宫内膜癌组织中高表达,且参与细胞周期的调控,抑制其表达可使子宫内膜癌细胞阻滞于G2/M期。处于G2/M期的细胞对放射治疗非常敏感,因此阻滞TRPC6通道或抑制TRPC6表达可能具有放射治疗增敏作用,今后仍需深入研究,为提高子宫内膜癌治疗的效果提供新的思路。
| [1] |
SIDERIS M, EMIN E I, ABDULLAH Z, HANRAHAN J, STEFATOU K M, SEVAS V, et al. The role of KRAS in endometrial cancer:a mini-review[J]. Anticancer Res, 2019, 39: 533-539. DOI:10.21873/anticanres.13145 |
| [2] |
MACKINTOSH M L, CROSBIE E J. Prevention strategies in endometrial carcinoma[J]. Curr Oncol Rep, 2018, 20: 101. DOI:10.1007/s11912-018-0747-1 |
| [3] |
TAOUSSI N, ALGHAMDI A, FUTYMA K, RECHBERGER T. Biological markers with potential clinical value in endometrial cancer-review of the literature[J]. Ginekol Pol, 2017, 88: 331-336. DOI:10.5603/GP.a2017.0062 |
| [4] |
ASGHAR M Y, MAGNUSSON M, KEMPPAINEN K, SUKUMARAN P, LÖF C, PULLI I, et al. Transient receptor potential canonical 1(TRPC1) channels as regulators of sphingolipid and VEGF receptor expression:implications for thyroid cancer cell migration and proliferation[J]. J Biol Chem, 2015, 290: 16116-16131. DOI:10.1074/jbc.M115.643668 |
| [5] |
DIEZ-BELLO R, JARDIN I, LOPEZ J J, EL HAOUARI M, ORTEGA-VIDAL J, ALTAREJOS J, et al. (-)-Oleocanthal inhibits proliferation and migration by modulating Ca2+ entry through TRPC6 in breast cancer cells[J]. Biochim Biophys Acta Mol Cell Res, 2019, 1866: 474-485. DOI:10.1016/j.bbamcr.2018.10.010 |
| [6] |
JARDIN I, DIEZ-BELLO R, LOPEZ J J, REDONDO P C, SALIDO G M, SMANI T, et al. TRPC6 channels are required for proliferation, migration and invasion of breast cancer cell lines by modulation of Orai1 and Orai3 surface exposure[J]. Cancers (Basel), 2018, 10: pii:E331. DOI:10.3390/cancers10090331 |
| [7] |
XU J, YANG Y, XIE R, LIU J, NIE X, AN J, et al. The NCX1/TRPC6 complex mediates TGFβ-driven migration and invasion of human hepatocellular carcinoma cells[J]. Cancer Res, 2018, 78: 2564-2576. DOI:10.1158/0008-5472.CAN-17-2061 |
| [8] |
BERNICHTEIN S, PIGAT N, BARRY DELONGCHAMPS N, BOUTILLON F, VERKARRE V, CAMPARO P, et al. Vitamin D3 prevents calcium-induced progression of early-stage prostate tumors by counteracting TRPC6 and calcium sensing receptor upregulation[J]. Cancer Res, 2017, 77: 355-365. DOI:10.1158/0008-5472.CAN-16-0687 |
| [9] |
SONG J, WANG Y, LI X, SHEN Y, YIN M, GUO Y, et al. Critical role of TRPC6 channels in the development of human renal cell carcinoma[J]. Mol Biol Rep, 2013, 40: 5115-5122. DOI:10.1007/s11033-013-2613-4 |
| [10] |
ZHANG Z, WANG J, HE J, ZENG X, CHEN X, XIONG M, et al. Identification of TRPCs genetic variants that modify risk for lung cancer based on the pathway and two-stage study[J]. Meta Gene, 2016, 9: 191-196. DOI:10.1016/j.mgene.2016.07.005 |
| [11] |
DING M, WANG H, QU C, XU F, ZHU Y, LV G, et al. Pyrazolo[1, 5-a]pyrimidine TRPC6 antagonists for the treatment of gastric cancer[J]. Cancer Lett, 2018, 432: 47-55. DOI:10.1016/j.canlet.2018.05.041 |
| [12] |
DRYER S E, KIM E Y. Permeation and rectification in canonical transient receptor potential-6(TRPC6) channels[J]. Front Physiol, 2018, 9: 1055. DOI:10.3389/fphys.2018.01055 |
| [13] |
ICHIKAWA J, INOUE R. TRPC6 regulates cell cycle progression by modulating membrane potential in bone marrow stromal cells[J]. Br J Pharmacol, 2014, 171: 5280-5294. DOI:10.1111/bph.12840 |
 2020, Vol. 41
2020, Vol. 41
