2. 广东药科大学附属第一医院中医科, 广州 510080;
3. 广东药科大学附属第一医院检验科, 广州 510080
2. Department of Traditional Chinese Medicine, The First Affiliated Hospital of Guangdong Pharmaceutical University, Guangzhou 510080, Guangdong, China;
3. Clinical Laboratory, The First Affiliated Hospital of Guangdong Pharmaceutical University, Guangzhou 510080, Guangdong, China
脾是一个涉及多系统的综合功能单位。临床观察和研究发现,脾虚证患者常表现为消化系统障碍和免疫力低下[1-3],但有关脾虚证的发病机制并未完全阐明。基于基因芯片技术的组学研究方法与中医的整体观有很多相似之处,已被广泛用于脾虚证的研究[2-5]。本课题组前期胃黏膜和白细胞基因表达谱数据研究显示,脾虚证患者体内存在大量物质能量代谢和免疫相关基因表达下调[1-5],从组学角度为脾虚证发病机制的认识提供了帮助。但受基因表达组织特异性的限制,单一组织的基因表达谱数据难以达到全面认识脾虚证的目的。血清miRNA为内源性小分子非编码RNA,具有含量丰富、性质稳定、来源广泛等特征,而且血清miRNA表达谱与其他组织miRNA表达谱具有非常高的相似性,能很好地反映机体不同的病理和生理状态[6-8]。因此,血清miRNA表达谱相对基因表达谱更能反映中医证型的整体病理状态,适合中医证型的研究,尤其是解剖部位不明确的脾虚证研究。高脂血症为一种常见的代谢性疾病,中医认为脾失健运是其主要病机。基于此,本研究以高脂血症为研究疾病,选择脾胃湿热证患者和健康志愿者为对照,使用血清miRNA定量PCR芯片筛选脾虚证患者的血清miRNA表达谱并进行生物信息学分析,旨在为脾虚证患者临床辨证分型提供血清标志物,并从miRNA水平探讨脾虚证患者的发病机制。
1 资料和方法 1.1 高脂血症临床诊断与中医辨证分型标准参考《中华心血管病杂志》编委会血脂异常防治对策专题组确定的高脂血症临床诊断标准[9],即禁食12~14 h的静脉血液检查,2次以上不同日期血脂符合下列1项或多项即可诊断为高脂血症:(1)血清总胆固醇(total cholesterol,TC)≥ 5.72 mmol/L(220 mg/dL);(2)血清总三酰甘油(triacylglycerol,TG)≥1.70 mmol/L(150 mg/dL);(3)血清低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)≥3.64 mmol/L(140 mg/dL);(4)血清高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C)≤0.91 mmol/L(35 mg/dL)。
参照《中药新药临床研究指导原则(试行)》[10]制定中医辨证分型标准。(1)脾虚证(本研究特指脾气虚证)的辨证。主症:①舌质淡、舌体胖或有齿印,苔薄白;②胃纳减少或食欲差;③腹胀;④大便溏或腹泻。次症:①消瘦;②体倦乏力;③脉细弱。判断:主症①必备,兼具主症② ③ ④之二,或兼具主症② ③ ④之一同时兼具2个以上次症,诊断可成立。(2)脾胃湿热证的辨证。主症:①舌苔黄腻;②胸闷;③胃脘痞满或胀痛;④食欲不振。次症:①口苦而黏;②口渴少饮,或喜热饮;③大便溏或有黏液;④恶心;⑤身困乏力;⑥脉濡缓或滑。判断:主症①必备,兼具主症② ③ ④之二,或兼具主症② ③ ④之一同时兼具2个以上次症,或兼具3个以上次症,诊断可成立。中医辨证分型由2位中医师单独进行,对中医证型有分歧时则与第3位中医师讨论确定。如有兼夹证候,脾虚证或脾胃湿热证必须占全部证候2/3以上。
1.2 纳入与排除标准高脂血症脾虚证和脾胃湿热证患者纳入标准:年龄为42~58岁,同时符合高脂血症诊断标准和中医脾虚证或脾胃湿热证的辨证分型标准,并签署知情同意书。排除标准:合并有除高脂血症外的其他内分泌或心血管疾病,合并有感染或炎性疾病,合并有严重器质性病变或精神病。健康志愿者通过健康体检和会诊确定。纳入标准:年龄为42~58岁,无明显西医疾病,无典型中医证候,并签署知情同意书;排除标准:有高脂血症或其他内分泌和心血管疾病,有感染或炎性疾病,有严重器质性疾病或精神病,表现典型的中医证候,肥胖或有家族糖尿病史,长期服药,拒绝签署知情同意书。本研究获得广东药科大学附属第一医院伦理委员会审批,伦理审批号为[2013]临审(15)号,所有受试者均签署知情同意书。
1.3 受试者一般资料8例高脂血症患者为广东药科大学附属第一医院中医科2015年4月至2016年4月就诊的患者,平均病程为(4.2±2.6)年(范围为3~6年),全部为高胆固醇血症或兼夹TG和脂蛋白异常,无药物服用史。其中4例脾虚证患者(女3例、男1例)全部表现为舌体有齿印、腹胀、大便溏3个主症和脉细弱次症,年龄为43~57(49.5±5.4)岁;4例脾胃湿热证患者(女3例、男1例)全部表现为舌苔黄腻、胸闷、食欲不振3个主症和口苦而黏、脉濡缓2个次症,年龄为45~58(52.3±8.3)岁。5名健康志愿者为该院同时间段体检中心的健康体检者,女3名、男2名,年龄为42~58(50.4±7.4)岁,均无典型中医证型。3组研究对象的年龄、性别等差异均无统计学意义(P均 > 0.05),具有可比性。
1.4 血清miRNA定量PCR芯片实验采集受试者晨7点至9点空腹静脉血3 mL,4 ℃凝血1 h后收集血清,-80 ℃保存备用。择日取1 mL血清,使用TRIzol试剂(美国Invitrogen公司)+酚氯仿法提取总RNA,经检测合格后用于miRNA芯片实验。选择含有372个成熟miRNA的血清定量PCR芯片(丹麦Exiqon公司)筛选脾虚证患者的血清miRNA。操作步骤如下:取20~25 ng总RNA反转录成cDNA,然后以cDNA为模板对芯片上372个miRNA同时行定量PCR扩增。PCR扩增在Prism®7900定量PCR仪(美国ABI公司)上进行。反应条件:95 ℃预变性10 min;95 ℃ 10 s,60 ℃ 60 s,共38个循环。所有仪器和试剂盒操作均按照使用说明书进行。
1.5 脾虚证患者血清miRNA表达谱筛选选择管家基因SNORD38B 和SNORD49A为内参基因,将Ct值≥38的数据默认为38个Ct值。使用2-ΔΔCt法分别计算脾虚证患者血清样品中每个miRNA相对脾胃湿热证患者和健康志愿者的表达值(表达倍数)。表达倍数 < 1.00时进行负倒数处理;表达倍数为负值表示该miRNA在脾虚证患者血清中表达下调,正值则表示表达上调。两组间miRNA表达倍数绝对值≥2.0、P < 0.05定义为差异表达miRNA;脾虚证患者与脾胃湿热证患者、脾虚证患者与健康志愿者之间共有的差异表达miRNA定义为脾虚证患者的候选血清miRNA。
1.6 脾虚证患者候选miRNA的生物信息学分析 1.6.1 层次聚类分析利用MeV 4.9软件(TM4 Microarray Software Suite,美国)[11]对13个临床样本的9个候选miRNA的表达倍数进行样本和miRNA聚类分析。先利用中位数中心法校正miRNA表达倍数,然后选择欧式距离测度和全连接聚类连接方式构建样本和miRNA的层次聚类图。
1.6.2 miRNA靶基因预测和功能注释利用综合数据库miRSystem(version 20150312)[12]对miRNA进行靶基因预测和功能注释。首先将脾虚证患者的候选miRNA及其表达倍数上传到数据库中;然后,将被TarBase和miRecords这2个实验验证数据库验证或被DIANA-microT、MIRANDA、miRBridge、PicTar、PITA、RNA22、TargetScan这7个预测数据库中的3个以上数据库同时预测的靶基因确定为目标miRNA的靶基因;最后,对预测的靶基因进行京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路分析,通路中的总基因数设定为25~500个基因,O/E比值设定为≥2.0,富集通路的显著性设定为理论和实验P值均≤0.05。
1.6.3 miRNA组织表达分析利用MIRANDA数据库[13]分析脾虚证患者的候选miRNA在不同组织中的表达谱。
1.7 统计学处理利用GenEx qPCR(丹麦Exiqon公司)和SPSS 18.0(美国IBM公司)软件进行数据分析。miRNA表达量先进行方差齐性分析,然后根据方差齐性分析结果再行方差齐性或非齐性t检验,筛选组间差异表达miRNA。检验水准(α)为0.05。
2 结果 2.1 脾虚证患者候选血清miRNA脾虚证患者与健康志愿者的血清miRNA表达谱中共有86个差异表达miRNA,脾虚证与脾胃湿热证患者有21个差异表达miRNA,其中9个miRNA为3组间共有的差异表达miRNA,即为脾虚证患者的候选血清miRNA,其中6个表达上调,3个表达下调。见表 1。
|
|
表 1 脾虚证患者的候选血清miRNA |
2.2 脾虚证患者候选miRNA聚类分析
筛选的9个候选miRNA的表达在脾虚证患者、脾胃湿热证患者及健康志愿者3组样本间存在显著差异,在聚类图中各自聚成1类。上调和下调miRNA也分别单独聚成1类(图 1)。
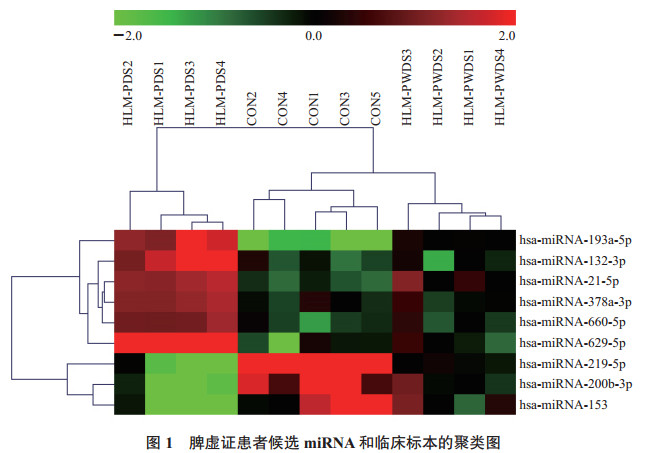
|
图 1 脾虚证患者候选miRNA和临床标本的聚类图 红色表示上调,绿色表示下调. miRNA:微RNA;HLM-PDS:高脂血症脾虚证患者;CON:健康志愿者;HLM-PWDS:高脂血症脾胃湿热证患者 |
2.3 脾虚证患者候选miRNA的靶基因预测和功能注释
使用miRSystem数据库对miRNA靶基因进行预测和功能注释,结果显示脾虚证患者血清中表达上调的6个miRNA调控83个靶基因。KEGG通路分析显示这些靶基因显著富集于7个通路,主要涉及细胞因子-细胞因子受体相互作用通路、病原虫感染性疾病、免疫/炎症相关的信号通路和胰腺癌4个方面;脾虚证患者血清中表达下调的3个miRNA调控365个靶基因,这些靶基因显著富集于5个通路,主要涉及神经营养因子信号通路、磷脂酰肌醇信号通路、RNA运输、磷酸肌醇代谢和氨基酸代谢5个方面。见表 2、图 2。
|
|
表 2 miRNA靶基因富集的KEGG通路 |
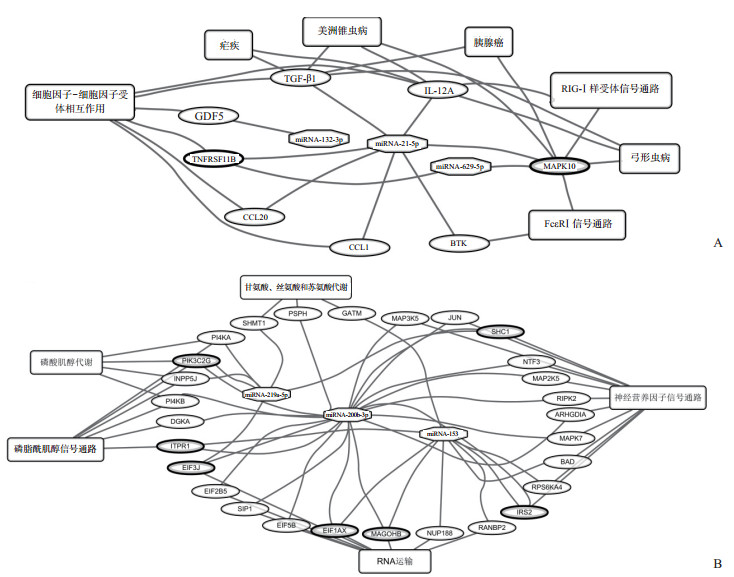
|
图 2 脾虚证患者候选miRNA、靶基因和富集KEGG通路之间的相互作用网络 A:上调miRNA;B:下调miRNA.粗线表示被2个miRNA调控的靶基因.miRNA:微RNA;KEGG:京都基因与基因组百科全书;TNFRSF11B:肿瘤坏死因子受体超家族成员11b;CCL:趋化因子(C-C基序)配体;GDF5:生长分化因子5;IL-12A:白细胞介素12A;TGF-β1:转化生长因子β1;MAPK:丝裂原活化蛋白激酶;BTK:Bruton酪氨酸激酶;RIG-Ⅰ:维甲酸诱导基因Ⅰ;FcεRⅠ:免疫球蛋白E-Fc受体Ⅰ;SHC1:Src同源2结构域衔接蛋白1;IRS2:胰岛素受体底物2;BAD:细胞死亡B淋巴细胞癌基因2相关激动剂;MAP3K5:丝裂原活化蛋白激酶激酶激酶5;MAP2K5:丝裂原活化蛋白激酶激酶5;JUN:原癌基因Jun;ARHGDIA:Rho GDP解离抑制因子α;NTF3:神经营养因子3;RIPK2:受体相互作用的丝氨酸-苏氨酸激酶2;RPS6KA4:核糖体蛋白S6激酶A4;ITPR1:肌醇3,4,5三磷酸受体1;PIK3C2G:磷脂酰肌醇-4-磷酸3-激酶催化亚单位2γ;DGKA:二酰甘油激酶α;INPP5J:肌醇多磷酸-5-磷酸酶J;PI4KA/PI4KB:磷脂酰肌醇4-激酶α/β;EIF1AX/EIF5B/EIF3J/EIF2B5:真核翻译起始因子1A X连锁/5B/3J/2B亚单位ε;MAGOHB:Mago同源物B外显子连接复合体亚单位;NUP188:核孔蛋白188;RANBP2:RAN结合蛋白2;GATM:甘氨酸脒基转移酶;PSPH:磷酸丝氨酸磷酸酶;SHMT1:丝氨酸羟甲基转移酶1 |
2.4 脾虚证患者候选miRNA组织表达分析
使用MIRANDA数据库对脾虚证患者候选血清miRNA进行组织表达分析,结果显示除miRNA-193a-5p和miRNA-378a-3p没有组织表达信息外,其余7个miRNA在多个组织中均有表达。miRNA-21-5p在肝、淋巴、肾上腺、子宫组织中表达;miRNA-132-3p在脑(垂体、海马、皮质)、胰岛、脾、肾、前列腺、乳腺组织中表达;miRNA-660-5p在肾组织表达;miRNA-629-5p在肝、淋巴、肺、子宫组织中表达;miRNA-219-5p在淋巴、海马、子宫组织中表达;miRNA-200b-3p在胰岛、肝、脾、淋巴、乳腺、垂体、甲状腺、附睾组织中表达;miRNA-153在淋巴、胰岛、肾、海马、精原组织中表达。
3 讨论本研究利用定量PCR芯片对高脂血症脾虚证患者、高脂血症脾胃湿热证患者和健康志愿者的血清miRNA表达谱进行分析,筛选出9个高脂血症脾虚证患者的候选血清miRNA,这些miRNA能很好地将高脂血症脾虚证患者、高脂血症脾胃湿热证患者和健康对照者区分开。进一步功能注释和KEGG分析显示,这些miRNA的靶基因在病原虫感染、免疫/炎症反应、胰腺癌、信号通路、RNA运输、磷酸肌醇和氨基酸代谢等多个通路显著富集,为脾虚证患者的辨证分型和发病机制研究提供了依据。
“脾胃不足百病丛生”提示脾胃功能不足时机体免疫力低下,易患各种疾病。本研究发现脾虚证患者上调miRNA的靶基因在细胞因子-细胞因子受体相互作用通路、病原虫感染性疾病、免疫/炎症相关的信号通路中显著富集,提示脾虚证患者机体免疫力下降,病原虫等外邪更容易入侵。本课题组前期对2型糖尿病患者白细胞基因表达谱的研究发现,脾虚证患者存在大量免疫相关基因表达异常[2-3]。罗云坚等[14]对脾气虚证慢性胃炎与溃疡性结肠炎患者白细胞基因表达谱的研究也发现,脾虚证患者机体免疫功能紊乱。多项非组学研究结果也证实,脾虚证患者或动物体内存在IL-12、TNF-α、转化生长因子β1(transforming growth factor β1,TGF-β1)、趋化因子配体20[chemokine (C-C motif) ligand 20,CCL20]表达异常[15-18]。此外,免疫力低下与肿瘤的发生和发展密切相关。研究显示,大部分消化道肿瘤患者在确诊前1年内都会表现出不同程度的脾虚证候,而且脾虚证候的出现与患者预后和生存时间密切相关[19-21]。本研究发现脾虚证患者上调miRNA的靶基因在胰腺癌通路中显著富集,提示脾虚证与胰腺癌的发生有关。有研究显示,脾虚证是胰腺癌的重要证型,且TGF-β1(本研究预测的miRNA靶基因之一)在胰腺癌不同分期中都存在表达异常[22-23]。
“脾主运化”理论提示脾负责食物的消化吸收及在体内的代谢转化和输送过程。本研究发现脾虚证患者下调miRNA的靶基因在神经营养因子信号通路、磷脂酰肌醇信号通路、磷酸肌醇代谢和氨基酸代谢通路中显著富集。这些通路直接参与营养物质代谢和信号转导。其中磷脂酰肌醇信号通路和磷酸肌醇代谢通路是机体产生三磷酸肌醇和二酰甘油这2个第二信使的重要通路。第二信使是细胞内大多数信号转导通路的基础,因此这些通路的异常会影响机体多个通路的信号转导。此外,脾虚证患者下调miRNA的靶基因在RNA运输通路富集,该通路中的大部分基因为翻译起始因子,直接参与蛋白质生物合成过程。本课题组前期胃黏膜基因表达谱的研究也发现,慢性胃炎脾虚证患者体内存在多个与氨基酸代谢和蛋白质合成相关基因表达异常[4-5],提示脾虚证患者体内存在氨基酸代谢和蛋白质合成异常。
血清miRNA来自不同的组织器官,分析miRNA在不同组织中的表达有助于了解血清miRNA的组织来源。中医脾与代谢和免疫密切相关,而代谢的调控不仅受神经内分泌和细胞或酶水平的双重调控,而且具有组织特异性(尤其是肝脏在代谢中具有重要作用)。本研究发现,miRNA-132-3p、miRNA-219-5p、miRNA-153、miRNA-200b-3p及miRNA-21-5p在中枢神经、胰岛、甲状腺或肾上腺组织中表达,其中后2个miRNA和miRNA-629-5p在肝脏组织中表达,而这6个miRNA也均在淋巴或脾脏组织中表达。此外,中医认为“脾主水”,即负责水盐代谢。本研究发现miRNA-132-3p、miRNA-660-5p和miRNA-153在肾脏组织表达。这些结果为脾虚证患者候选血清miRNA的组织来源提供了依据。
综上所述,本研究筛选出9个脾虚证患者候选miRNA,可作为脾虚证临床辨证的潜在血清标志物,为脾生理功能和脾虚证发病机制的研究提供依据。此外,本研究为初步研究,样本量有限,miRNA靶基因还未能验证,可作为下一步研究重点。
| [1] |
杨泽民, 陈蔚文. 脾虚证与物质能量代谢紊乱相关性研究进展[J]. 广州中医药大学学报, 2012, 29: 332-336. |
| [2] |
陈龙辉, 杨泽民, 陈蔚文, 李茹柳, 林传权, 朱章志, 等. 2型糖尿病脾气虚证免疫与物质代谢相关基因差异表达的研究[J]. 中华中医药杂志, 2015, 30: 3634-3638. |
| [3] |
CHEN L, YANG Z, CHEN W, LI R, LIN C, GUAN L, et al. Differential expression of immune-related genes between healthy volunteers and type 2 diabetic patients with spleen-deficiency pattern[J]. J Tradit Chin Med, 2015, 35: 646-652. DOI:10.1016/S0254-6272(15)30154-0 |
| [4] |
杨泽民, 陈蔚文, 王颖芳. 慢性浅表性胃炎脾虚证患者与健康人物质能量代谢基因差异表达研究[J]. 中国中西医结合杂志, 2013, 33: 159-163. |
| [5] |
杨泽民, 陈蔚文, 王颖芳. 慢性浅表性胃炎脾虚与脾胃湿热证患者物质能量代谢基因差异表达研究[J]. 中国中西医结合杂志, 2012, 32: 1180-1187. |
| [6] |
BARTEL D P. MicroRNAs:genomics, biogenesis, mechanism, and function[J]. Cell, 2004, 116: 281-297. DOI:10.1016/S0092-8674(04)00045-5 |
| [7] |
KAROLINA D S, ARMUGAM A, TAVINTHARAN S, WONG M T, LIM S C, SUM C F, et al. MicroRNA 144 impairs insulin signaling by inhibiting the expression of insulin receptor substrate 1 in type 2 diabetes mellitus[J]. PLoS One, 2011, 6: e22839. DOI:10.1371/journal.pone.0022839 |
| [8] |
CHEN X, BA Y, MA L, CAI X, YIN Y, WANG K, et al. Characterization of microRNAs in serum:a novel class of biomarkers for diagnosis of cancer and other diseases[J]. Cell Res, 2008, 18: 997-1006. DOI:10.1038/cr.2008.282 |
| [9] |
方圻, 王钟林, 宁田海, 邵耕, 陈在嘉, 陆宗良, 等. 血脂异常防治建议[J]. 中华心血管病杂志, 1997, 25: 169-173. DOI:10.3760/j:issn:0253-3758.1997.03.003 |
| [10] |
中华人民共和国卫生部. 中药新药临床研究指导原则(试行)[M]. 北京: 中国医药科技出版社, 1995: 114-117.
|
| [11] |
SAEED A I, SHAROV V, WHITE J, LI J, LIANG W, BHAGABATI N, et al. TM4:a free, open-source system for microarray data management and analysis[J]. Biotechniques, 2003, 34: 374-348. DOI:10.2144/03342mt01 |
| [12] |
LU T P, LEE C Y, TSAI M H, CHIU Y C, HSIAO C K, LAI L C, et al. miRSystem:an integrated system for characterizing enriched functions and pathways of microRNA targets[J]. PLoS One, 2012, 7: e42390. DOI:10.1371/journal.pone.0042390 |
| [13] |
BETEL D, WILSON M, GABOW A, MARKS D S, SANDER C. The microRNA.org resource:targets and expression[J]. Nucleic Acids Res, 2008, 36: D149-D153. DOI:10.1093/nar/gkm995 |
| [14] |
罗云坚, 修宗昌, 黄穗平, 周丹, 林莉. 脾气虚证免疫相关基因组学机制初探[J]. 中国中西医结合杂志, 2005, 25: 311-314. DOI:10.3321/j.issn:1003-5370.2005.04.006 |
| [15] |
马贤德, 孙杨, 孙宏伟, 关洪全. 白色念珠菌肠道感染对脾虚模型小鼠小肠组织中IL-10和IL-12影响的实验研究[J]. 辽宁中医杂志, 2015, 42: 2226-2229. |
| [16] |
闾艳, 丑天舒, 陈孟溪. 扶正抑瘤膏对结直肠癌辅助化疗后脾虚证的疗效观察[J]. 中医药导报, 2014, 20: 26-29. |
| [17] |
高建苑, 黄晨, 夏天, 徐先橘, 陈金凤, 房海英. 脾虚患者血浆细胞因子变化及与脾虚证关系的研究[J]. 中国中西医结合消化杂志, 2004, 12: 131-133. DOI:10.3969/j.issn.1671-038X.2004.03.001 |
| [18] |
韩晓春, 季旭明, 王彦芳, 张亚楠, 陈倩, 庞张祥, 等. 薏苡仁不同组分干预脾虚水湿不化大鼠细胞间隙基因变化[J]. 中华中医药杂志, 2016, 31: 1955-1958. |
| [19] |
蒋民主. 脾虚与消化道肿瘤的早期临床意义——附消化道肿瘤114例临床分析[J]. 兰后卫生, 1986, 7: 61-62. |
| [20] |
赵仙铭, 李伟林. 162例晚期肿瘤患者脾虚证临床分析[J]. 实用中医药杂志, 1998, 14: 26-27. |
| [21] |
罗安明, 戎志斌. 肿瘤以脾虚为本探析[J]. 中国中医基础医学杂志, 2014, 20: 164-165. |
| [22] |
高嵩, 陈震. 96例不同中医证型的胰腺癌患者生存分析[J]. 中国保健营养, 2013, 3: 1515-1516. |
| [23] |
潘新亭, 王新生, 王正滨, 朱青云, 韩燕. Smad2与TGF-β1基因在胰腺癌中的表达及临床意义(英文)[J]. 现代生物医学进展, 2012, 12: 1122-1125. |
 2020, Vol. 41
2020, Vol. 41


