2. 海军军医大学(第二军医大学)长海医院眼科, 上海 200433
2. Department of Ophthalmology, Changhai Hospital, Naval Medical University(Second Military Medical University), Shanghai 200433, China
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病最常见的微血管病变之一,同时也是导致糖尿病患者失明的主要原因[1-2]。研究表明DR在1型糖尿病和2型糖尿病都有发生[3]。随着糖尿病患者数量的增加,DR已成为糖尿病患者视力损害的主要原因[4]。DR的整个病理过程包括视网膜毛细血管周细胞丢失、基底膜增厚、内皮屏障功能丧失、血-视网膜屏障破坏等重要病理改变,并导致视网膜缺血,而视网膜缺血则会使血管内皮生长因子(vascular endothelial growth factor,VEGF)水平升高[1-2]。研究表明,VEGF过量表达与视网膜新生血管形成有关,而视网膜新生血管形成则可引起视网膜出血、黄斑水肿、视网膜脱离及新生血管性青光眼等,造成严重的视力损害,最终导致失明[5]。DR的发展过程可以分为2个阶段:早期非增生性糖尿病视网膜病变(non-proliferative diabetic retinopathy,NPDR)和晚期增生性糖尿病视网膜病变(proliferative diabetic retinopathy,PDR),前者主要以视网膜通透性增加和视网膜内出血为特征,后者主要表现为视网膜新生血管形成[1]。在NPDR,高糖诱导的视网膜病变主要包括毛细血管周细胞缺失、血管层变薄及血-视网膜屏障破坏,进一步导致视网膜缺血、缺氧。当病情发展到PDR时,则会出现新生血管形成,并最终导致严重的视力损害[1]。
为了更好地探究DR在分子和细胞水平上的发展,研究者们对糖尿病动物模型进行了广泛的研究[6-7]。其中,啮齿类动物模型(主要是大鼠、小鼠)与人类的遗传背景相似。DR的啮齿类动物模型因品种、品系、诱导糖尿病的方法和糖尿病持续时间而异。相比大鼠,小鼠模型操作简单、成本相对低廉、繁殖周期短,先进的基因操作技术如组织特异性转基因表达和靶向基因敲除等,已经提高了小鼠模型在特别需要基因工程模型的实验中的相对重要性。目前,选择代谢和病理生理机制的遗传改变已经成为可能,小鼠模型在研究早期DR的发病机制中有重要价值[7]。
目前常用链脲佐菌素(streptozotocin,STZ)诱导糖尿病动物模型,表现为快速的高血糖(注射后3 d)和早期糖尿病的一些病理变化,如视网膜周细胞和毛细血管丢失、血管基底膜增厚、血管闭塞和血管通透性增加[8]。
研究表明,VEGF在视网膜新生血管形成中发挥着关键作用,而NPDR出现的视网膜缺血、缺氧是导致VEGF水平升高的重要原因[1]。在DR发生、发展过程中,VEGF家族、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、胰岛素样生长因子1(insulin-like growth factor 1,IGF-1)、细胞外基质成分、基质金属蛋白酶(matrix metalloproteinase,MMP)等促血管生成因子都参与了视网膜新生血管的调节[9-10]。其中,VEGF被认为是在病理和病理生理条件下调控血管生成过程的中心调控因子[11]。VEGF通过激活其2个酪氨酸激酶受体血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)1和VEGFR2,刺激血管内皮细胞增殖、促进新生血管形成,并进一步促进DR的发展[12]。既往报道更多关注于对VEGF的研究,对其受体VEGFR1和VEGFR2的变化在DR中的作用报道不多。
建立糖尿病小鼠视网膜病变模型是研究DR的重要方法。本研究采用小剂量多次注射STZ的方法建立糖尿病小鼠模型,观察糖尿病小鼠模型视网膜组织学形态及微血管结构的改变,检测视网膜中VEGF、VEGFR1和VEGFR2的表达水平,为研究视网膜病变的发病机制及治疗方法提供理论依据。
1 材料和方法 1.1 实验动物6~8周龄C57BL/6J小鼠36只,体质量18~22 g,由海军军医大学(第二军医大学)实验动物中心提供(动物合格证号:20180006000296)。使用标准颗粒饲料喂养,不限食水,饲养室内通风状况良好,温度控制在(23±2)℃,相对湿度为50%。
1.2 糖尿病小鼠模型的构建将小鼠随机分为对照组(12只)和模型组(24只)。模型组小鼠按照55 mg/kg连续5 d腹腔注射STZ(美国Sigma公司,S0130-1G),注射前禁食6 h,STZ溶于柠檬酸钠缓冲液中(0.1 mol/L,pH 4.2);对照组小鼠腹腔注射等量的柠檬酸钠缓冲液。末次注射7 d后尾静脉取血测量血糖,若>16.5 mmol/L可确定糖尿病小鼠模型构建成功。血糖监测使用长沙三诺生物传感股份有限公司易准血糖仪(GA-3型)及血糖试条。糖尿病模型构建成功后将模型组小鼠和对照组小鼠继续饲养,正常饮食,此后每隔30 d监测血糖1次。
1.3 组织学方法检测小鼠视网膜组织形态变化 1.3.1 H-E染色糖尿病小鼠模型建立成功5个月后,采用过量CO2吸入法处死小鼠。取双侧眼球,置于FAS眼球固定液(美国Merck公司)中,4℃固定24 h。梯度乙醇脱水、二甲苯透明后石蜡包埋,沿平行于角膜到视盘矢状位的平面连续切片,切片厚度为4 μm。H-E染色后显微镜下观察。
1.3.2 伊文思蓝灌注造影将1 g伊文思蓝(上海Maclin公司)溶于50 mL生理盐水中,4℃低温避光保存,使用前预热至37℃。腹腔注射40 mg/kg戊巴比妥钠(上海隆盛化工有限公司,CAS:57-33-0)麻醉后,将小鼠仰卧位固定,并将头部偏向一侧,沿锁骨中线至下颌角连线做皮肤切口,分离皮下组织和脂肪,暴露一侧上腔静脉,压迫心前区使其充盈,使用胰岛素针穿刺上腔静脉,缓慢注射伊文思蓝溶液0.2 mL。注射后观察到小鼠口唇及四肢变蓝后再循环5~10 min后处死小鼠,摘取眼球,置于4%多聚甲醛溶液中固定2 h,在手术显微镜下剥离视网膜。将视网膜以视盘为中心做放射性切开,呈四叶草样,平铺于载玻片上,中性树胶封片,于共聚焦显微镜下观察。
1.3.3 视网膜血管网铺片采用过量CO2吸入法处死小鼠,取双侧眼球,将眼球置于4%多聚甲醛溶液中,4℃固定2 h。在手术显微镜下分离视网膜,用磷酸盐缓冲液清洗干净后继续置于4%多聚甲醛溶液中,4℃固定24 h,双蒸水清洗视网膜12 h。然后使用3%胰酶在37℃水浴下消化视网膜1.5 h。将视网膜置于双蒸水中,在显微镜下祛除内界膜及神经纤维组织,重复水洗至视网膜血管网透明。将透明的血管网转移至载玻片上,展平,自然晾干后进行血管网H-E染色,显微镜下观察。
1.4 分子生物学方法检测VEGF、VEGFR1、VEGFR2蛋白质与mRNA表达 1.4.1 蛋白质印迹法将显微镜下分离的1个小鼠视网膜放入1.5 mL EP管中,加入80 μL RIPA细胞裂解液(上海碧云天生物技术研究所)和3颗研磨粒,立即放入组织研磨器中60 Hz研磨90 s,4℃ 17 468.75×g离心5 min;取上清置于新的1.5 mL EP管中,4℃摇床裂解30 min,每个样品加入30 μL上样缓冲液,沸水煮15 min,样品制作完成。加入15 μL蛋白质样品于凝胶上样孔内进行电泳,然后将凝胶中的蛋白质转印至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,280 mA恒流90 min,用5%脱脂牛奶室温封闭2.5 h后,剪切目标条带分别加入VEGF一抗(美国Affinity Biosciences公司)、VEGFR1一抗和VEGFR2一抗(武汉三鹰生物技术有限公司)和内参照GAPDH一抗(美国Abclonal公司)孵育,4℃摇床过夜(14~16 h)。用1×Tris盐酸盐缓冲液+Tween洗涤3次后,加入抗兔二抗(美国Invitrogen公司),室温孵育2 h,用1×Tris盐酸盐缓冲液+Tween洗涤3次后,置于凝胶成像仪(美国Syngene公司)曝光显影。
1.4.2 实时定量PCR将显微镜下分离的2个小鼠视网膜放入1.5 mL EP管中,加入TRIzol试剂(美国Invitrogen公司),同1.4.1项下方法研磨组织;将上清液转移至新的EP管中,4℃裂解30 min,采用TRIzol一步法提取视网膜总RNA。使用酶标仪检测总RNA浓度,采用反转录试剂盒(日本TaKaRa公司)将等量的RNA反转录合成cDNA。使用SYBR定量PCR试剂盒(日本TaKaRa公司)对相同量的cDNA进行PCR。反应条件:50℃ 2 min,95℃ 10 min,95℃ 5 s、60℃ 30 s 40个循环。检测对照组和模型组小鼠视网膜VEGF、VEGFR1、VEGFR2 的mRNA表达水平,以GAPDH 为内参照。引物序列如下:VEGF正义引物5′-GCT ACT GCC GTC CGA TTG AG-3′,反义引物5′-ACT CCA GGG CTT CAT CGT TAC AG-3′;VEGFR1 正义引物5′-CCT GAT GGG CAA AGA ATA ACA T-3′,反义引物5′-ATT TGG ACA TCT AGG ATT GTA TTG G-3′;VEGFR2 正义引物5′-GTG GTA AGT TGC GAT TGT TGT G -3′,反义引物5′-TGA ACA TTG GCC TTC TTT GAT A-3′;GAPDH 正义引物5′-CAA TGA ATA GGG CTA CAG CA-3′,反义引物5′-AGG GAG ATG CTC AGT GTT GG-3′。使用ΔΔCt方法分析数据。
1.5 统计学处理采用GraphPad Prism 6.0软件进行统计学分析。数据以x±s表示,比较采用独立样本t检验。检验水准(α)为0.05。
2 结果 2.1 糖尿病小鼠模型血糖变化对照组与模型组小鼠在注射前血糖水平差异无统计学意义[(6.81±0.61)mmol/L vs(6.82±0.36)mmol/L,P>0.05]。对照组注射前后血糖水平差异无统计学意义(P>0.05)。模型组小鼠注射STZ 1周后出现多饮、多食、多尿等症状;检测结果表明,与对照组相比,模型组小鼠血糖水平升高,差异有统计学意义(P<0.01),表明模型组小鼠成功构建糖尿病模型。继续饲养至1~5个月时模型组小鼠血糖水平均高于对照组,差异均有统计学意义(P均<0.01)。见表 1。
|
|
表 1 对照组小鼠与链脲佐菌素诱导糖尿病小鼠模型在注射后不同时间点血糖水平 Tab 1 Blood glucose levels in control mice and streptozotocin-induced diabetic mice at different time points after injection |
2.2 糖尿病小鼠视网膜病变模型视网膜组织学变化 2.2.1 H-E染色结果
对照组小鼠视网膜全层细胞排列整齐,各细胞层细胞核染色清晰,组织形态未见异常(图 1A、1B)。造模5个月时,模型组小鼠视网膜明显变薄,神经节细胞数量减少,但感光细胞层厚度增加(图 1C、1D)。与对照组小鼠视网膜(图 1B)比较,模型组小鼠视网膜内核层和外核层的细胞分布紊乱,数量明显减少(图 1D)。
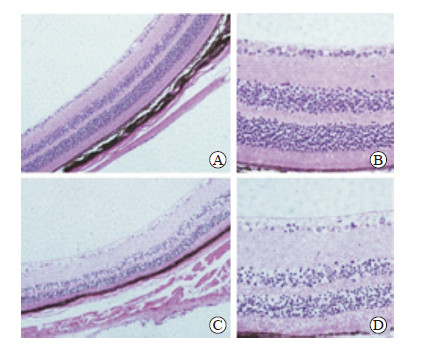
|
图 1 H-E染色观察链脲佐菌素诱导糖尿病小鼠模型视网膜病变情况 Fig 1 H-E staining of diseased retina in streptozotocin-induced diabetic mice A, B: Normal retina; C: The thinned retina 5 months after diabetic mouse model establishment; D: Five months after diabetic mouse model establishment, the cells in the inner nuclear layer and outer nuclear layer of the retina were in disorder and the number was decreased obviously. Original magnification: ×100 (A, C), ×200 (B, D) |
2.2.2 伊文思蓝灌注造影结果
共聚焦显微镜下可见对照组小鼠视网膜血管层次清晰,走行正常,无迂曲、渗漏等(图 2A)。模型组小鼠的视网膜血管走行迂曲,结构紊乱,层次模糊,出现渗漏及渗漏斑(图 2B)。
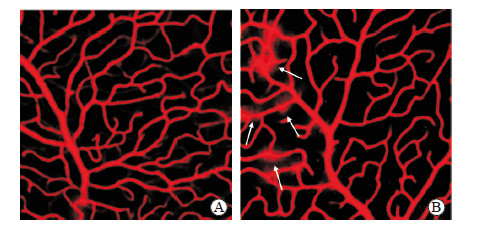
|
图 2 共聚焦显微镜下观察链脲佐菌素诱导糖尿病小鼠模型视网膜伊文思蓝灌注造影结果 Fig 2 Retinal vascular Evans blue perfusion angiography in streptozotocin-induced diabetic mice under confocal microscopy A: Normal retinal vessels; B: Five months after diabetic mouse model establishment, the retinal vessels of mice in model group were distorted, structurally disordered, and the layers were blurred (the white arrows indicate leakage and leakage spots). Original magnification: ×200 |
2.2.3 视网膜血管网铺片
光学显微镜下正常组小鼠视网膜血管网铺片结果如图 3A所示,视网膜血管走行流畅,管径大小均匀一致,管壁的内皮细胞核呈椭圆形、淡染,在血管周边可见圆形的周细胞核、深染,分布均匀。图 3B所示的模型组小鼠视网膜血管扭曲,走行不规则,周细胞数量明显减少,内皮细胞增殖,呈椭圆形、梭形或多边形,核深染,可见无细胞毛细血管形成,并出现管腔闭塞。
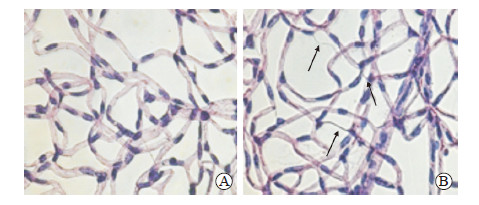
|
图 3 链脲佐菌素诱导糖尿病小鼠模型视网膜血管网铺片结果 Fig 3 Retinal vascular network digestion of streptozotocin-induced diabetic mice A: Normal retinal vessels; B: Five months after diabetic mouse model establishment, the mice in model group had twisted retinal vessels with irregular walking, significantly decreased number of pericytes, and proliferated endothelial cells with oval, fusiform or polygonal nuclear, deeply dyed (black arrows indicate the cell-free capillaries and lumen occlusion). H-E staining. Original magnification: ×200 |
2.3 VEGF、VEGFR1、VEGFR2蛋白质与mRNA的表达情况
图 4A显示,与对照组小鼠相比,造模5个月时模型组小鼠视网膜中VEGF、VEGFR1和VEGFR2的蛋白质表达量增高。图 4B显示,模型组小鼠VEGF、VEGFR1 和VEGFR2 的mRNA表达水平升高,与对照组相比差异均有统计学意义(P均<0.01),与蛋白质表达一致。上述结果表明模型组小鼠视网膜出现病理性新生血管的可能性较高。
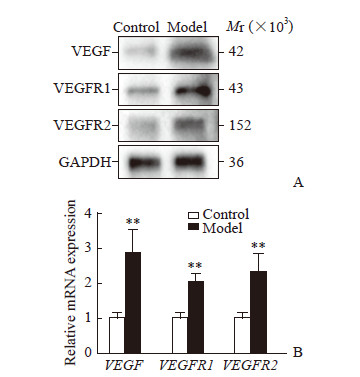
|
图 4 链脲佐菌素诱导糖尿病小鼠模型视网膜中VEGF、VEGFR1、VEGFR2蛋白质和mRNA表达 Fig 4 Protein and mRNA expression of VEGF, VEGFR1 and VEGFR2 in retina of streptozotocin-induced diabetic mice A: Protein expression by Western blotting; B: mRNA expression by quantitative real-time PCR. VEGF: Vascular endothelial growth factor; VEGFR: Vascular endothelial growth factor receptor; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase. **P < 0.01 vs control group. n=3, x±s |
3 讨论
到2035年,全世界糖尿病患者人数预计将增加至近6亿人,这种疾病会导致许多长期的微血管和大血管并发症,并对身体、情感和经济造成毁灭性的损害[13]。DR的发病机制复杂,对其发展过程的研究一直是热点。
STZ会破坏胰腺β细胞,使胰岛素合成和分泌减少,引起糖代谢紊乱,导致血糖升高,诱发糖尿病,因此被广泛用于糖尿病动物模型的构建[14-16]。啮齿类小动物生命周期短、易于繁殖饲养、成本小、易操作且短期可诱导大批模型,是理想的实验对象。其中,小鼠的基因和表型与人类相似,小鼠模型能很好地模拟人类疾病,且便于构建基因敲除动物模型,因而被广泛使用。
既往采用单次大剂量注射STZ诱导的DR模型一般需要在6个月以上才出现典型的视网膜病理和形态学改变。相比之下,本研究采用小剂量多次注射STZ的方法建立的DR模型,不仅能够满足DR动物模型的实验需求,而且具有成模率高、死亡率低、糖尿病病理改变明显和出现时间早等优点[17]。目前糖尿病动物模型发生DR的具体时间仍未明确,有研究表明DR在糖尿病动物模型构建成功4个月后出现,但也有研究表明DR在糖尿病动物模型构建成功6个月后才出现。即使是建立相同的动物模型,不同实验室之间对DR的具体发生时间也不能达成一致[14, 18]。余增洋等[19]研究表明,与正常小鼠相比,糖尿病小鼠模型构建成功后5个月时小鼠视网膜毛细血管出现增生并排列紊乱,神经节细胞层和内核层可出现增生的血管群,说明在糖尿病小鼠模型构建成功5个月后可观察到DR的典型特征性病理学改变。因此,本研究在糖尿病小鼠模型构建成功5个月时,通过H-E染色、伊文思蓝灌注造影、血管网铺片方法,以及检测视网膜中VEGF及其受体VEGFR1和VEGFR2的表达,研究糖尿病小鼠模型视网膜的病理学改变和分子水平的变化,判断本实验是否成功构建糖尿病小鼠DR模型,并进一步对糖尿病小鼠DR模型的构建和视网膜病理学改变的检测方法进行创新。
与传统的显微镜相比,本研究采用共聚焦显微镜观察血管的走行与分布更加清晰,并可观察到视网膜早期渗漏及渗漏斑的形成。本研究结果显示,在糖尿病小鼠模型构建成功5个月后,伊文思蓝灌注造影结果中即出现视网膜渗漏,视网膜血管网铺片结果中出现血管闭塞、内皮细胞增殖、周细胞凋亡减少及血管网结构紊乱等DR的典型表现,这表明本研究成功构建糖尿病小鼠DR模型。
VEGF表达水平的升高与视网膜功能障碍密切相关[20]。研究表明,VEGF/VEGFR信号通路在血管生成中起着重要作用,抗VEGF治疗对于恶性肿瘤等血管生成相关性疾病的治疗非常重要[21]。以前已有药物通过抗VEGF来治疗血管生成相关性疾病,贝伐珠单克隆抗体、兰尼单克隆抗体均是针对VEGF的全长抗体,临床上通常用于治疗恶性肿瘤,也被用于治疗DR和其他绒毛膜视网膜血管疾病[22]。此外,玻璃体腔注射抗血管生成药物(尤其是VEGF抑制剂)也被认为是一种可行的临床治疗DR的方法[22-23]。
已有多项研究报道VEGF在糖尿病动物模型中表达水平升高[24-25],但目前对VEGFR的研究报道并不多。本研究结果显示,VEGF、VEGFR1、VEGFR2的mRNA及蛋白质表达水平在糖尿病动物模型构建成功5个月后升高。这进一步表明VEGF及其受体在DR发生、发展过程中发挥着至关重要的作用。有文献表明,建模成功后3、4个月的小鼠并未出现新生血管形成,且视网膜中VEGFR1和VEGFR2表达水平并不升高,反而在糖尿病发展5个月后出现新生血管时VEGF、VEGFR1和VEGFR2的表达均明显升高[25-26]。这与本研究结果一致,这些与血管生成有关的重要分子表达水平的升高也为PDR糖尿病小鼠出现视网膜新生血管形成提供依据。我们猜想,实验小鼠个体之间的差异、生存环境、饮食和健康状况等都会影响糖尿病小鼠出现新生血管的具体时间,这些因素实际往往难以达到完全一致,因此会出现差异。
综上所述,本研究成功构建了糖尿病小鼠模型,模型组小鼠在喂养5个月时出现视网膜内皮细胞增殖、渗漏、血管闭塞、周细胞凋亡减少及血管网结构紊乱。同时检测到DR小鼠视网膜中VEGF及其受体VEGFR1、VEGFR2的mRNA和蛋白质表达水平均升高,证明它们在DR小鼠新生血管生成过程中有重要作用,为进一步揭示DR的发生机制及研究临床治疗药物提供了参考。
| [1] |
CHEUNG N, MITCHELL P, WONG T Y. Diabetic retinopathy[J]. Lancet, 2010, 376: 124-136. DOI:10.1016/S0140-6736(09)62124-3 |
| [2] |
INFELD D A, O'SHEA J G. Diabetic retinopathy[J]. Postgrad Med J, 1998, 74: 129-133. DOI:10.1136/pgmj.74.869.129 |
| [3] |
PELIKÁNOVÁ T. [Diabetic retinopathy: pathogenesis and therapeutic implications][J]. Vnitr Lek, 2016, 62(7/8): 620-628. |
| [4] |
SOLOMON S D, CHEW E, DUH E J, SOBRIN L, SUN J K, VANDERBEEK B L, et al. Diabetic retinopathy: a position statement by the American Diabetes Association[J]. Diabetes Care, 2017, 40: 412-418. DOI:10.2337/dc16-2641 |
| [5] |
YOSHIDA S, NAKAMA T, ISHIKAWA K, ARIMA M, TACHIBANA T, NAKAO S, et al. Antiangiogenic shift in vitreous after vitrectomy in patients with proliferative diabetic retinopathy[J]. Invest Ophthalmol Vis Sci, 2012, 53: 6997-7003. DOI:10.1167/iovs.12-9671 |
| [6] |
LAI A K, LO A C. Animal models of diabetic retinopathy: summary and comparison[J/OL]. J Diabetes Res, 2013, 2013: 106594. doi: 10.1155/2013/106594.
|
| [7] |
ROBINSON R, BARATHI V A, CHAURASIA S S, WONG T Y, KERN T S. Update on animal models of diabetic retinopathy: from molecular approaches to mice and higher mammals[J]. Dis Model Mech, 2012, 5: 444-456. DOI:10.1242/dmm.009597 |
| [8] |
CAI X, MCGINNIS J F. Diabetic retinopathy: animal models, therapies, and perspectives[J/OL]. J Diabetes Res, 2016, 2016: 3789217. doi: 10.1155/2016/3789217.
|
| [9] |
CAMPOCHIARO P A. Molecular targets for retinal vascular diseases[J]. J Cell Physiol, 2007, 210: 575-581. DOI:10.1002/jcp.20893 |
| [10] |
YU Y, ZHANG J, ZHU R, ZHAO R, CHEN J, JIN J, et al. The profile of angiogenic factors in vitreous humor of the patients with proliferative diabetic retinopathy[J]. Curr Mol Med, 2017, 17: 280-286. |
| [11] |
FERRARA N, DAVIS-SMYTH T. The biology of vascular endothelial growth factor[J]. Endocr Rev, 1997, 18: 4-25. DOI:10.1210/edrv.18.1.0287 |
| [12] |
SIMONS M, GORDON E, CLAESSON-WELSH L. Mechanisms and regulation of endothelial VEGF receptor signalling[J]. Nat Rev Mol Cell Biol, 2016, 17: 611-625. |
| [13] |
KOWLURU R A, MISHRA M. Regulation of matrix metalloproteinase in the pathogenesis of diabetic retinopathy[J]. Prog Mol Biol Transl Sci, 2017, 148: 67-85. DOI:10.1016/bs.pmbts.2017.02.004 |
| [14] |
ZHANG W, YAN H. Dysfunction of circulating endothelial progenitor cells in type 1 diabetic rats with diabetic retinopathy[J]. Graefes Arch Clin Exp Ophthalmol, 2013, 251: 1123-1131. DOI:10.1007/s00417-013-2267-x |
| [15] |
DAVIDSON E P, COPPEY L J, YOREK M A. Early loss of innervation of cornea epithelium in streptozotocin-induced type 1 diabetic rats: improvement with ilepatril treatment[J]. Invest Ophthalmol Vis Sci, 2012, 53: 8067-8074. DOI:10.1167/iovs.12-10826 |
| [16] |
OLIVARES A M, ALTHOFF K, CHEN G F, WU S, MORRISSON M A, DEANGELIS M M, et al. Animal models of diabetic retinopathy[J]. Curr Diab Rep, 2017, 17: 93. DOI:10.1007/s11892-017-0913-0 |
| [17] |
朱华, 李彦红, 徐艳峰, 徐玉环, 许庆刚, 尹红霞, 等. 小剂量多次注射链脲佐菌素建立糖尿病早期视网膜病变动物模型[J]. 中国实验动物学报, 2016, 24: 487-493. DOI:10.3969/j.issn.1005-4847.2016.05.009 |
| [18] |
GONG C Y, LU B, HU Q W, JI L L. Streptozotocin induced diabetic retinopathy in rat and the expression of vascular endothelial growth factor and its receptor[J]. Int J Ophthalmol, 2013, 6: 573-577. |
| [19] |
余增洋, 陆宾, 龚陈媛, 季莉莉. 链脲佐菌素诱导的小鼠糖尿病视网膜病模型及促血管新生分子的表达[J]. 国际眼科杂志, 2016, 16: 1-6. DOI:10.3980/j.issn.1672-5123.2016.1.01 |
| [20] |
ALDEBASI Y H, RAHMANI A H, KHAN A A, ALY S M. The effect of vascular endothelial growth factor in the progression of bladder cancer and diabetic retinopathy[J]. Int J Clin Exp Med, 2013, 6: 239-251. |
| [21] |
HOEBEN A, LANDUYT B, HIGHLEY M S, WILDIERS H, VAN OOSTEROM A T, DE BRUIJN E A. Vascular endothelial growth factor and angiogenesis[J]. Pharmacol Rev, 2004, 56: 549-580. DOI:10.1124/pr.56.4.3 |
| [22] |
CAI S, BRESSLER N M. Aflibercept, bevacizumab or ranibizumab for diabetic macular oedema: recent clinically relevant findings from DRCR.net Protocol T[J]. Curr Opin Ophthalmol, 2017, 28: 636-643. DOI:10.1097/ICU.0000000000000424 |
| [23] |
URIAS E A, URIAS G A, MONICKARAJ F, MCGUIRE P, DAS A. Novel therapeutic targets in diabetic macular edema: beyond VEGF[J]. Vision Res, 2017, 139: 221-227. DOI:10.1016/j.visres.2017.06.015 |
| [24] |
MOHAN N, MONICKARAJ F, BALASUBRAMANYAM M, REMA M, MOHAN V. Imbalanced levels of angiogenic and angiostatic factors in vitreous, plasma and postmortem retinal tissue of patients with proliferative diabetic retinopathy[J]. J Diabetes Complications, 2012, 26: 435-441. DOI:10.1016/j.jdiacomp.2012.05.005 |
| [25] |
MIMA A, QI W, HIRAOKA-YAMOMOTO J, PARK K, MATSUMOTO M, KITADA M, et al. Retinal not systemic oxidative and inflammatory stress correlated with VEGF expression in rodent models of insulin resistance and diabetes[J]. Invest Ophthalmol Vis Sci, 2012, 53: 8424-8432. DOI:10.1167/iovs.12-10207 |
| [26] |
ZHANG X, BAO S, LAI D, RAPKINS R W, GILLIES M C. Intravitreal triamcinolone acetonide inhibits breakdown of the blood-retinal barrier through differential regulation of VEGF-A and its receptors in early diabetic rat retinas[J]. Diabetes, 2008, 57: 1026-1033. DOI:10.2337/db07-0982 |
 2019, Vol. 40
2019, Vol. 40


