2. 宁夏医科大学研究生院, 银川 750000
2. Graduate School, Ningxia Medical University, Yinchuan 750000, Ningxia Hui Autonomous Region, China
多发性骨髓瘤(multiple myeloma)是一种难治性、恶性浆细胞病。骨髓瘤细胞含有丰富的内质网,能产生和分泌大量免疫球蛋白,这些免疫球蛋白在经内质网折叠时极易发生错误,从而诱发内质网应激,发生未折叠蛋白反应(unfolded protein response,UPR)。一定程度UPR对维持骨髓瘤细胞内质网稳态和肿瘤细胞存活有重要作用[1]。但过度的UPR将导致肿瘤细胞死亡。因此,靶向激活UPR的药物成为多发性骨髓瘤治疗领域的研究热点。UPR主要通过3条信号通路发挥作用,分别为肌醇需求酶1(inositol-requiring enzyme 1,IRE1)、蛋白激酶样内质网激酶(PRKR-like endoplasmic reticulum kinase,PERK)和活化转录因子6(activating transcription factor 6,ATF6)通路。
雷公藤红素(celastrol)是从中药雷公藤植物中提取出的一种三萜类化合物,具有多种药理作用,包括抑制炎症[2-3]、抗肿瘤[4-5]、神经元保护[6]等。本研究旨在考察雷公藤红素抑制多发性骨髓瘤细胞增殖是否与UPR信号通路有关,并明确相关分子机制。
1 材料和方法 1.1 实验材料多发性骨髓瘤细胞株RPMI 8226购自中国科学院上海细胞库,多发性骨髓瘤细胞株U266、SKO、KMS-11由海军军医大学(第二军医大学)长征医院侯健实验室馈赠。雷公藤红素购自美国Sigma公司(纯度≥98%)。
细胞培养于含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的RPMI 1640培养液中。每2~3 d更换1次新鲜培养液,取对数生长期的细胞用于实验。细胞培养在37 ℃、含5% CO2培养箱中,并保持培养箱相对湿度维持在95%左右。
取一定量雷公藤红素溶于二甲基亚砜(dimethyl sulfoxide,DMSO)中,配制成50 mmol/L的溶液,-20 ℃贮存。处理细胞前,用不含血清和酚红的RPMI 1640培养液将50 mmol/L雷公藤红素稀释至所需浓度。同时将等量DMSO用同样的培养液稀释,作为溶剂对照。
1.2 细胞增殖检测用本实验室开发的羧基荧光素二醋酸盐琥珀酰亚胺酯(5, 6-carboxyfluorescein diacetate succinimidyl ester,CFSE)标记技术检测细胞增殖情况[7]。简言之,先用CFSE标记细胞制成带荧光的细胞微球,收集药物处理后的细胞,加入1×104荧光细胞微球及碘化丙啶(propidium iodide,PI)染料后,上流式细胞仪进行检测。
1.3 细胞凋亡检测收集药物处理后的细胞,用预冷的磷酸盐缓冲液充分洗涤细胞2次,用结合缓冲液(江苏碧云天生物技术研究所)重悬细胞,取细胞悬液加入Annexin Ⅴ-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)和7-氨基放线菌素(7-amino-actinomycin D,7-AAD)溶液。混匀后室温避光孵育10 min,加入300 μL结合缓冲液,上流式细胞仪进行检测。
1.4 细胞周期检测药物处理后,收集细胞至流式管中,用70%乙醇固定1 h以上,磷酸盐缓冲液洗3次,加入含RNA酶、PI、Triton的磷酸盐缓冲液中,37℃孵育10 min后,立刻上流式细胞仪进行检测。
1.5 蛋白质印迹法检测收集处理后的细胞,提取总蛋白。取一定量蛋白上样至十二烷基硫酸钠-聚丙烯酰胺凝胶进行电泳,转膜,膜与一抗孵育之后,与相应的辣根过氧化物酶标记的二抗孵育,用ECL进行显色,用化学发光成像系统采集图像。
1.6 短发夹RNA(short hairpin RNA,shRNA)载体构建合成所需引物,sh-eIF2α正义引物5'-CCG GGC ACC TTC ATT TGT TAG ATT AGG ATC CTA ATC TAA CAA ATG AAG GTG CTT TTT G-3',反义引物5'-AAT TCA AAA AGC ACC TTC ATT TGT TAG ATT AGG ATC CTA ATC TAA CAA ATG AAG GTG C-3'。引物溶解退火后,将片段连入用EcoRⅠ和AgeⅠ双酶切过的pHMGV2-U6-Puro载体中,并将连接产物转入XL10感受态细胞(美国Addgene公司)中,提取质粒,然后测序验证相关位点。
1.7 慢病毒包被shRNA载体及稳转株获得将验证正确的载体用慢病毒包被后转染至HEK293T细胞(购自中国科学院上海细胞库),经压力筛选后,获得稳定转染shRNA的细胞。
1.8 统计学处理用SPSS 17.0软件进行数据处理。计量资料以x±s表示,两组间比较采用独立样本t检验,多组间比较采用方差分析。检验水准(α)为0.05。
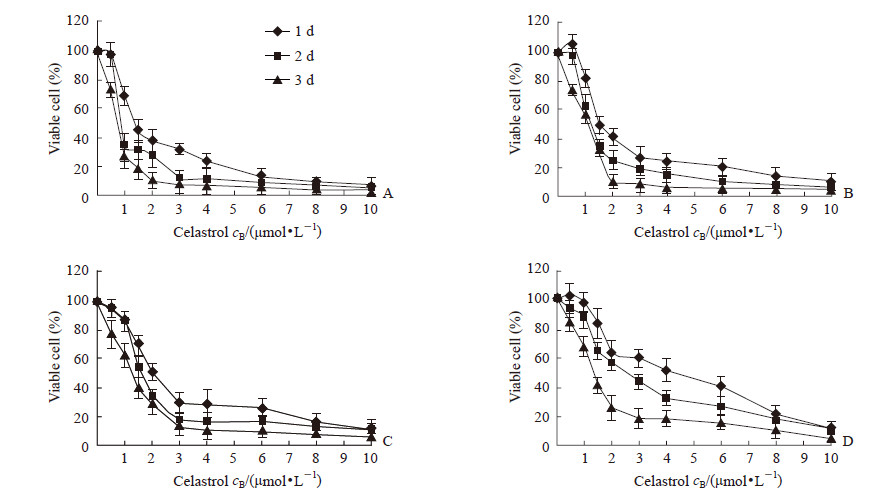
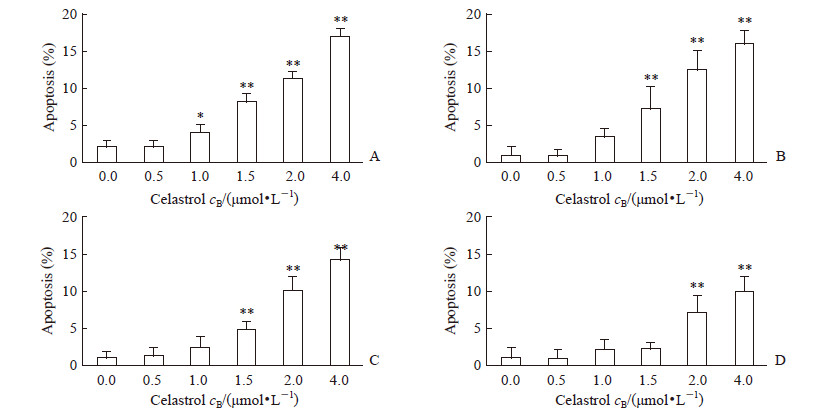
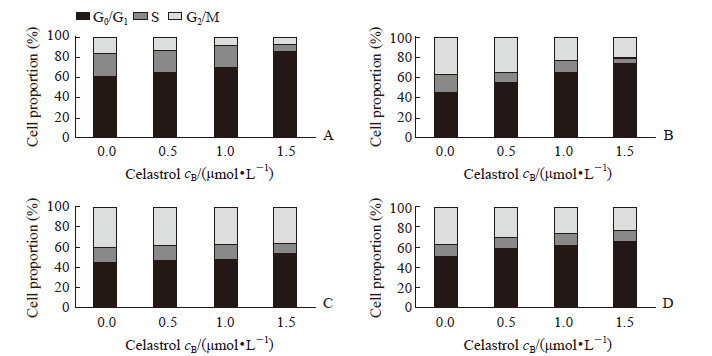
2 结果 2.1 雷公藤红素抑制多发性骨髓瘤细胞增殖、诱导凋亡并导致细胞周期阻滞在G0/G1期用雷公藤红素分别处理人多发性骨髓瘤细胞株RPMI 8226、U266、KMS-11、SKO后,发现雷公藤红素能抑制这4种细胞增殖,且随药物浓度增加和处理时间延长抑制效果增强。其中RPMI 8226对雷公藤红素最敏感,1、2、3 d的半抑制浓度(half-inhibitory concentration,IC50)值分别为2.55、1.47、0.67 μmol/L;对雷公藤红素最不敏感的是SKO,1、2、3 d的IC50值分别为4.81、3.83、2.00 μmol/L;U266在1、2、3 d的IC50值分别为2.61、1.98、1.21 μmol/L,KMS-11在1、2、3 d的IC50值分别为3.54、2.73、1.69 μmol/L(图 1)。雷公藤红素浓度为2.0~4.0 μmol/L时,对4种多发性骨髓瘤细胞均能诱导发生凋亡(P<0.01);在1 μmol/L时即能诱导RPMI 8226细胞发生凋亡(P<0.05)。见图 2。雷公藤红素在1.5 μmol/L时导致RPMI 8226和U266细胞周期阻滞在G0/G1期,但对KMS-11和SKO的细胞周期没有明显影响(图 3)。
|
图 1 雷公藤红素以时间和剂量依赖方式抑制4种多发性骨髓瘤细胞株增殖 Fig 1 Celastrol inhibiting multiple myeloma cell proliferation in time- and dose-dependent ways A: RPMI 8226; B: U266; C: KMS-11; D: SKO. n=3, x±s |
|
图 2 雷公藤红素以剂量依赖方式诱导4种多发性骨髓瘤细胞株发生凋亡 Fig 2 Celastrol inducing multiple myeloma cell apoptosis in time- and dose-dependent ways After 1 d treated with different concentrations of celastrol, the apoptosis levels of RPMI 8226 (A), U266 (B), KMS-11 (C) and SKO (D) cells were detected by flow cytometry. *P < 0.05, **P < 0.01 vs 0.0 μmol/L celastrol group. n=3, x±s |
|
图 3 雷公藤红素对4种多发性骨髓瘤细胞株细胞周期的影响 Fig 3 Effect of celastrol on cell cycle of multiple myeloma cells After 1 d treated with different concentrations of celastrol, the cell cycle of RPMI 8226 (A), U266 (B), KMS-11 (C) and SKO (D) cells was detected by flow cytometry |
2.2 雷公藤红素对RPMI 8226 UPR信号通路分子表达的影响
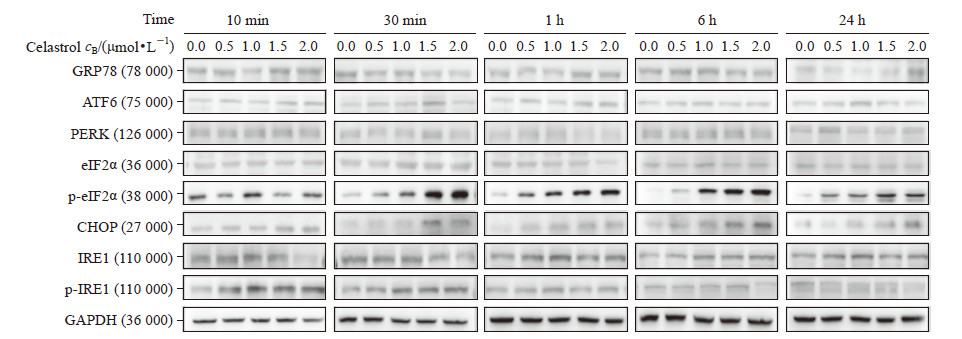
RPMI 8226经0.5、1.0、1.5、2.0 μmol/L雷公藤红素分别处理10 min、30 min、1 h、6 h、24 h后,检测葡萄糖调节蛋白78(glucose-regulated protein 78,GRP78)、ATF6、PERK、真核细胞翻译起始因子2α(eukaryotic initiation factor 2α,eIF2α)、磷酸化eIF2α(p-eIF2α)、C/EBP同源蛋白(C/EBP homologous protein,CHOP)、IRE1、磷酸化IRE1(p-IRE1)的表达。结果显示,雷公藤红素主要影响PERK通路,并通过激活p-eIF2α进一步促进下游的CHOP表达,而且这种作用具有剂量和时间依赖性;而对ATF6和IRE1通路没有明显影响(图 4、表 1)。
|
图 4 雷公藤红素对多发性骨髓瘤细胞株RPMI 8226 UPR信号通路分子表达的影响 |
|
|
表 1 雷公藤红素处理后多发性骨髓瘤细胞株RPMI 8226 UPR信号通路分子相对表达量 Tab 1 Relative expression of UPR signal pathway molecules in multiple myeloma cell RPMI 8226 after celastrol treatment |
2.3 雷公藤红素通过激活eIF2α抑制多发性骨髓瘤细胞生长
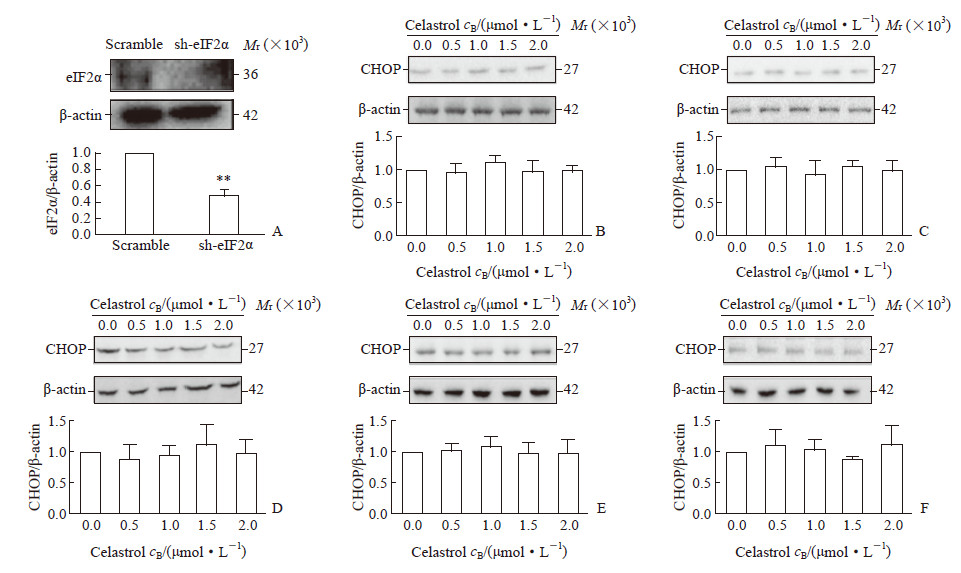
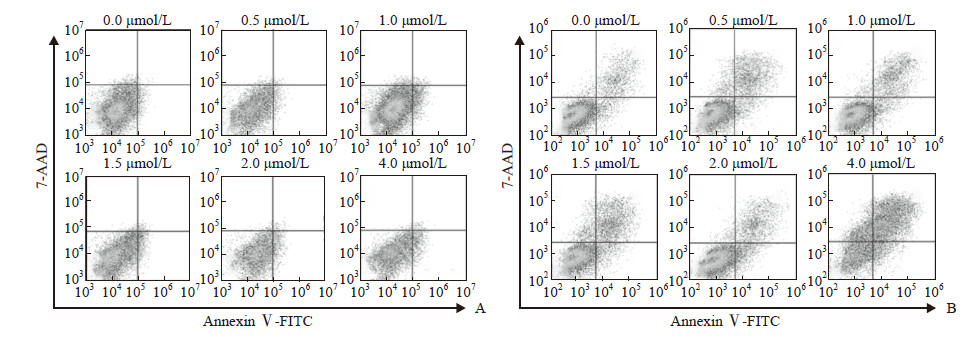
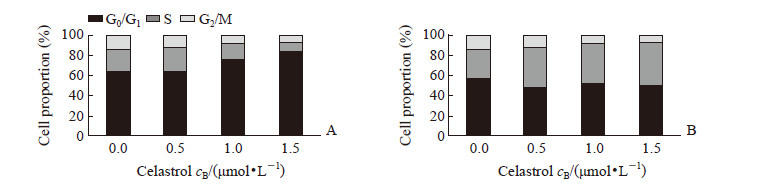
为进一步验证eIF2α 活化在雷公藤红素抑制多发性骨髓瘤细胞生长中的作用,本研究通过构建针对eIF2α 的shRNA慢病毒载体,筛选出低表达eIF2α的RPMI 8226稳转株(图 5A)。将低表达eIF2α的RPMI 8226细胞经0.5、1.0、1.5、2.0 μmol/L雷公藤红素分别处理10 min、30 min、1 h、6 h、24 h后检测eIF2α下游CHOP表达,结果显示雷公藤红素上调CHOP表达的作用消失(图 5B~5F)。此外,eIF2α低表达后,雷公藤红素诱导多发性骨髓瘤细胞发生凋亡的能力减弱(图 6),而且不再能使多发性骨髓瘤细胞发生周期阻滞(图 7)。
|
图 5 干扰eIF2α后雷公藤红素对其下游CHOP分子表达的影响 Fig 5 Effect of celastrol on CHOP expression following interfering eIF2α A: Expression of eIF2α protein in RPMI 8226 cells treated by short hairpin RNA; B-F: Expression of CHOP protein in RPMI 8226 cells interfered with sh-eIF2α and followed by celastrol treatment for 10 min (B), 30 min (C), 1 h (D), 6 h (E) and 24 h (F). eIF2α: Eukaryotic initiation factor 2α; CHOP: C/EBP homologous protein. **P < 0.01 vs scramble group. n=3, x±s |
|
图 6 干扰eIF2α后不同浓度雷公藤红素对多发性骨髓瘤细胞株RPMI 8226凋亡的影响 Fig 6 Effect of different concentrations of celastrol on apoptosis of multiple myeloma cell RPMI 8226 following interfering eIF2α A: Scramble; B: sh-eIF2α. eIF2α: Eukaryotic initiation factor 2α; FITC: Fluorescein isothiocyanate; 7-AAD: 7-amino-actinomycin D |
|
图 7 干扰eIF2α后雷公藤红素对多发性骨髓瘤细胞株RPMI 8226细胞周期的影响 Fig 7 Effect of celastrol on cell cycle of multiple myloma cell RPMI 8226 following interfering eIF2α A: Scramble; B: sh-eIF2α. eIF2α: Eukaryotic initiation factor 2α |
3 讨论
研究表明,雷公藤红素能抑制多发性骨髓瘤细胞增殖,诱导凋亡[8-9]。本研究同时对多种多发性骨髓瘤细胞株进行研究,也发现雷公藤红素能抑制多发性骨髓瘤细胞增殖,此外还发现雷公藤红素能使RPMI 8226和U266细胞阻滞在G0/G1期,并与诱导UPR有关。
骨髓瘤细胞内单克隆免疫球蛋白或轻链(M蛋白)过度生成,为维持生存会发生内质网应激,导致UPR,如果内质网应激未能得到缓解,UPR将诱导细胞凋亡[10]。在哺乳动物中,内质网膜上存在3种应激感受蛋白:IRE1、PERK、ATF6。这些跨膜蛋白位于内质网内面的结构域和内质网伴侣分子GRP78相互作用。其中PERK可通过ATF4/ATF3介导的CHOP表达增加诱导凋亡[10-12]。研究发现,雷公藤红素能致头颈癌细胞死亡,这一作用依赖于诱导UPR,其主要通过活化PERK/eIF2α/ATF4/CHOP或IRE1/XBP1通路激活UPR[13]。
本研究对UPR 3条信号通路中的主要分子进行检测,发现雷公藤红素能激活eIF2α并使下游的CHOP表达升高,提示雷公藤红素抑制多发性骨髓瘤细胞增殖可能与该通路有关。本研究还发现通过shRNA干扰技术降低多发性骨髓瘤细胞eIF2α表达后,雷公藤红素上调CHOP表达、诱导凋亡和导致周期阻滞的作用均减弱或消失。证明雷公藤红素主要是通过激活UPR信号通路中PERK途径的eIF2α发挥抗多发性骨髓瘤作用。
本研究为雷公藤红素治疗多发性骨髓瘤提供了新的基础理论依据,提示eIF2α可能是雷公藤红素发挥治疗作用的重要靶点。
| [1] |
NAKAMURA M, GOTOH T, OKUNO Y, TATETSU H, SONOKI T, UNEDA S, et al. Activation of the endoplasmic reticulum stress pathway is associated with survival of myeloma cells[J]. Leuk Lymphoma, 2006, 47: 531-539. DOI:10.1080/10428190500312196 |
| [2] |
YOUN G S, KWON D J, JU S M, RHIM H, BAE Y S, CHOI S Y, et al. Celastrol ameliorates HIV-1 Tat-induced inflammatory responses via NF-kappaB and AP-1 inhibition and heme oxygenase-1 induction in astrocytes[J]. Toxicol Appl Pharmacol, 2014, 280: 42-52. DOI:10.1016/j.taap.2014.07.010 |
| [3] |
ALLEN S D, LIU Y G, KIM T, BOBBALA S, YI S, ZHANG X, et al. Celastrol-loaded PEG-b-PPS nanocarriers as an anti-inflammatory treatment for atherosclerosis[J]. Biomater Sci, 2019, 7: 657-668. DOI:10.1039/C8BM01224E |
| [4] |
PENG B, ZHANG X, CAO F, WANG Y, XU L, CAO L, et al. Peptide deformylase inhibitor actinonin reduces celastrol's HSP70 induction while synergizing proliferation inhibition in tumor cells[J/OL]. BMC Cancer, 2014, 14: 146. doi: 10.1186/1471-2407-14-146.
|
| [5] |
KASHYAP D, SHARMA A, TULI H S, SAK K, MUKHERJEE T, BISHAYEE A. Molecular targets of celastrol in cancer: recent trends and advancements[J]. Crit Rev Oncol Hematol, 2018, 128: 70-81. DOI:10.1016/j.critrevonc.2018.05.019 |
| [6] |
ZHANG R, ZHU Y, DONG X, LIU B, ZHANG N, WANG X, et al. Celastrol attenuates cadmium-induced neuronal apoptosis via inhibiting Ca2+-CaMKⅡ-dependent Akt/mTOR pathway[J]. J Cell Physiol, 2017, 232: 2145-2157. DOI:10.1002/jcp.25703 |
| [7] |
CAO F F, XU L M, ZHANG X, WANG Y, LI M Q, UZAN G, et al. IP-FCM platform detects the existence and regulator-caused dissociation of components in naturally assembled HSP90 complex[J]. Cytometry A, 2014, 85: 359-367. DOI:10.1002/cyto.a.22421 |
| [8] |
KANNAIYAN R, HAY H S, RAJENDRAN P, LI F, SHANMUGAM M K, VALI S, et al. Celastrol inhibits proliferation and induces chemosensitization through down-regulation of NF-κB and STAT3 regulated gene products in multiple myeloma cells[J]. Br J Pharmacol, 2011, 164: 1506-1521. DOI:10.1111/j.1476-5381.2011.01449.x |
| [9] |
TOZAWA K, SAGAWA M, KIZAKI M. Quinone methide tripterine, celastrol, induces apoptosis in human myeloma cells via NF-κB pathway[J]. Int J Oncol, 2011, 39: 1117-1122. |
| [10] |
SZEGEZDI E, LOGUE S E, GORMAN A M, SAMALI A. Mediators of endoplasmic reticulum stress-induced apoptosis[J]. EMBO Rep, 2006, 7: 880-885. DOI:10.1038/sj.embor.7400779 |
| [11] |
HARDING H P, NOVOA I, ZHANG Y, ZENG H, WEK R, SCHAPIRA M, et al. Regulated translation initiation controls stress-induced gene expression in mammalian cells[J]. Mol Cell, 2000, 6: 1099-1108. DOI:10.1016/S1097-2765(00)00108-8 |
| [12] |
MCCULLOUGH K D, MARTINDALE J L, KLOTZ L O, AW T Y, HOLBROOK N J. Gadd153 sensitizes cells to endoplasmic reticulum stress by down-regulating Bcl2 and perturbing the cellular redox state[J]. Mol Cell Biol, 2001, 21: 1249-1259. DOI:10.1128/MCB.21.4.1249-1259.2001 |
| [13] |
FRIBLEY A M, MILLER J R, BROWNELL A L, GARSHOTT D M, ZENG Q, REIST T E, et al. Celastrol induces unfolded protein response-dependent cell death in head and neck cancer[J]. Exp Cell Res, 2015, 330: 412-422. DOI:10.1016/j.yexcr.2014.08.014 |
 2019, Vol. 40
2019, Vol. 40


