2. 海军军医大学(第二军医大学)长海医院超声科, 上海 200433;
3. 海军军医大学(第二军医大学)长征医院影像科, 上海 200003
2. Department of Ultrasound, Changhai Hospital, Naval Medical University(Second Military Medical University), Shanghai 200433, China;
3. Department of Imaging, Changzheng Hospital, Naval Medical University(Second Military Medical University), Shanghai 200003, China
相对于计算机断层扫描(computed tomography,CT)和磁共振成像检查,超声检查具有无创、无辐射、可重复的特点,能够清晰显示肌肉组织纹理特征和血流分布信息,已逐渐成为临床诊断和评估肌肉损伤值得信赖的影像学手段[1-2]。我们在前期的系列研究中发现,在微波热辐射作用下,离体猪肌肉组织中的氨基酸、蛋白质、细胞等发生变性、凝固、碳化和脱水,致使消融区域的肌肉组织紧缩、变硬,弹性降低或丧失,为此我们在超声定性诊断基础上开展了离体猪横纹肌纹理特征计算机定量分析[3-4]。作为该系列研究的动物实验部分,本研究应用实时超声弹性成像技术观察了不同消融功率下兔骨骼肌损伤修复不同时期肌肉组织的超声弹性变化,并探讨其组织病理学意义,借助超声弹性成像优势,在肌肉组织损伤修复诊断评估方面增加了组织质地弹性变化的超声影像信息,以期进一步奠定动物实验基础,为骨骼肌损伤修复的常规超声影像诊断提供有益补充。
1 材料和方法 1.1 动物模型制备健康新西兰大白兔44只,6~8周龄,体质量2~2.5 kg,雌雄不限,购于浙江省农业科学院,实验动物生产许可证号:SCXK(浙)2010-0047。于无特定病原体级环境中分笼饲养动物,标准饮食喂养。实验过程中对动物的处置符合国家科学技术委员会发布的《实验动物管理条例》。
设备采用南京康友微波能应用研究所生产的KY-2100型微波消融仪,频率为2 450 MHz,天线外径16 G,全长100 mm,微波发射端长3 mm,循环水冷却,微波天线杆温控制在28~32 ℃。根据不同消融功率,将40只新西兰大白兔随机分成2组:30 W组和50 W组,每组20只。全身麻醉下暴露兔右侧股内侧肌,在高频超声引导下用微波针插入肌肉深约5 mm,两组分别启动30 W或50 W微波功率热凝右侧肌肉3 min,左侧不启动微波热凝。另取4只兔作为正常对照,对照组兔不做任何处理。
1.2 超声弹性成像检查超声设备为日本日立公司生产的Preirus型超声诊断仪,具备外压式超声弹性成像功能,探头型号L74M,频率为5~13 MHz。系统参数恒定:增益70 dB,压缩55%,时间增益补偿为中间位(零补偿),图像聚焦区深度为1.0~2.5 cm,组织热指数为0.1,机械指数为0.8。二维超声将清晰显示的兔股动脉主干和股内侧肌纹理长轴作为研究平面,观察感兴趣区回声特点后启动超声弹性成像,用探头在靶区进行加压、解压操作,以获得稳定图像。存储未损伤的正常兔肌肉图像作为对照。微波消融实验兔用30 W或50 W功率各消融3 min后,分别于消融后1 h、1 d、2 d、7 d、28 d时进行二维超声观察后启动超声弹性成像检查,即分别在感兴趣区(消融区)、参照区(正常区)勾画相同大小、相同形状的区域,然后由超声系统自动计算出相应位点的弹性应变率(strain ratio,SR),每只兔每个位点的SR重复测量3次(即各组取样区域数为12个),取其平均值作为1次实验的SR结果。弹性声像图的获取及SR计算由同一位具有熟练操作超声弹性成像经验的医师完成。SR的计算公式为:SR=感兴趣区的应变值/参照区的应变值。
1.3 组织病理学检查实验仪器主要包括德国Leica公司生产的RM2135型轮转式切片机、HI1210型摊片机、HI1220型烘片机,日本OLYMPUS公司生产的BH2型生物摄影显微镜等。实验试剂主要包括成都市科龙化工试剂厂生产的二甲苯与无水乙醇、美国Sigma公司生产的苏木精、上海迈坤化工有限公司生产的伊红,南京森贝伽生物科技有限公司提供的Masson染色试剂盒和天狼星红染色试剂盒等。30 W和50 W组微波消融实验兔分别于消融后1 h、1 d、2 d、7 d、28 d时随机各处死4只,然后切取实验组兔右侧股内侧热凝后固化肌肉组织和正常兔相同区域肌肉组织(范围为消融区中心与边缘交界处大小10 mm×10 mm的区域),经10%甲醛溶液固定、石蜡包埋、切片后进行H-E染色、Masson染色和天狼星红染色,光镜下观察组织病理学改变。H-E染色用于对肌纤维进行观察,按结构完整、浊肿、变性或坏死等表现进行描述。Masson染色和天狼星红染色用于判断肌纤维损伤程度及再生纤维化差异。
1.4 统计学处理应用SPSS 17.0软件进行统计学分析。实验数据以x±s表示,3组间比较采用单因素方差分析,两两比较采用LSD-t检验。检验水准(α)为0.05。
2 结果 2.1 兔骨骼肌微波热损伤前后二维超声及超声弹性成像特征兔骨骼肌二维超声检查显示:在肌肉长轴切面上,正常组兔骨骼肌纹理表现为低回声肌束与强回声肌束膜相间的线状或轻度网络样排列,沿肌束长轴走行(图 1A)。实验组微波消融后即刻消融区回声呈一过性增高,后方回声衰减,骨骼肌纹理消失(图 1B);消融后1 h消融区回声减低,骨骼肌纹理连续性中断,网络样结构消失,呈磨玻璃样改变(图 1C);消融后1~2 d时消融区回声进一步减低,1 d时最低(图 1D);消融后7 d、28 d时消融区骨骼肌纹理逐渐恢复,但回声仍低于周围正常肌肉(图 1E、1F)。

|
图 1 兔骨骼肌微波消融前后二维超声特征 Fig 1 Two-dimensional ultrasonogram features of rabbit skeletal muscle before and after microwave ablation A: Before microwave ablation (normal group), normal muscle showed a linear and network-like arrangement of hypoechoic muscle bundle and hyperechoic myofascial membrane; B: Immediately after microwave ablation, the echo level in ablation area increased transiently with posterior attenuation, and muscle texture disappeared; C: One hour after microwave ablation, ablation area showed hypoechoic and blurred muscle texture with ground glass-like changes; D: One day after microwave ablation, the echo level in ablation area became lower; E: Seven days after microwave ablation, the echo level in ablation area became slightly higher than before, but still lower than that of surrounding muscles, and muscle texture could be partially detected; F: Twenty-eight days after microwave ablation, the ablation area became smaller, the echo level of ablation area showed isoechoic and slightly hypoechoic with clearer texture |
兔骨骼肌超声弹性成像结果显示:正常组兔骨骼肌纹理清晰,呈均匀绿色,夹杂红色(图 2A);30 W和50 W组兔骨骼肌微波消融后消融区域以蓝色为主(图 2B),提示质地变硬。与30 W组相比,50 W组骨骼肌纹理模糊不清的程度更加明显。随着肌纤维的修复,30 W组消融后7 d骨骼肌纹理逐渐清晰,原消融区逐渐缩小,超声弹性成像可见以蓝色为主的消融区域呈蓝绿相间、以绿色为主的马赛克状(图 2C),提示质地逐渐变软;但50 W组修复晚于30 W组,至消融后28 d时组存留的蓝色范围仍较大(图 2D)。

|
图 2 兔骨骼肌微波消融前后超声弹性成像特征 Fig 2 Ultrasound elastography features of rabbit skeletal muscle before and after microwave ablation A: In normal group, the rabbit muscle showed homogenous green and mixed with red (SR=1.01); B: Ablation area of 30 W group was mainly blue (SR=36.50); C: Ablation area of 30 W group showed blue mixed with green 7 d after microwave ablation (SR=3.45); D: Ablation area of 50 W group mainly showed blue 28 d after microwave ablation (SR=14.62). Yellow circle indicates SR sampling in ablation area; Red circle indicates SR sampling in normal area. SR: Strain ratio |
如表 1所示,消融后1 h,30 W和50 W组SR较正常组均增加(P<0.05、P<0.01),且50 W组SR高于30 W组(P<0.01);消融后1 d时,30 W和50 W组SR均进一步增高,仍高于正常组(P<0.05、P<0.01),50 W组SR仍高于30 W组(P<0.01);消融后2 d时,30 W和50 W组SR仍较正常组增高(P<0.05、P<0.01),30 W组SR低于50 W组(P<0.01);消融后7 d时,30 W和50 W组SR均降低,但仍高于正常组(P=0.024、P<0.01),50 W组仍然高于30 W组(P<0.01);消融后28 d时,30 W和50 W组SR进一步降低,30 W组SR接近正常组(P=0.945),但50 W组仍高于正常组(P<0.01)和30 W组(P<0.01)。
|
|
表 1 兔骨骼肌微波消融后不同时间点消融区SR变化 Tab 1 SR changes in ablation area of rabbit skeletal muscle at different time points after microwave ablation |
2.2 兔骨骼肌微波消融区组织病理学改变
H-E染色结果显示,光镜下30 W组和50 W组兔骨骼肌消融区均有不同程度的组织损伤碳化,周边肌纤维凝固性坏死。消融后1 h时,50 W组兔骨骼肌消融区组织损伤碳化明显,周边肌纤维凝固性坏死面积较30 W组大(图 3A、3B)。随着肌纤维的修复,消融后1~2 d消融区中心与边缘交界处可见炎症细胞浸润,50 W组巨噬细胞较30 W组增加更多;消融后7~28 d 30 W和50 W组交界处炎症、浊肿等减轻,可见大量新生血管和成纤维细胞及瘢痕形成,但50 W组范围较30 W组大(图 3C、3D)。
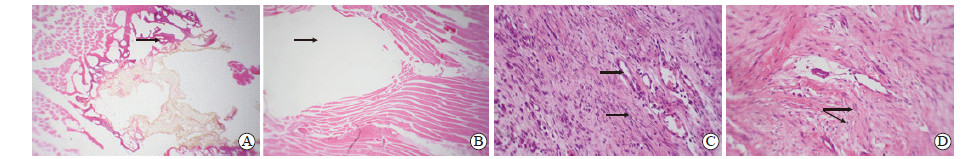
|
图 3 兔骨骼肌微波消融区H-E染色结果 Fig 3 H-E staining of microwave ablation area of rabbit skeletal muscle A, B: One hour after microwave ablation; C, D: Twenty-eight days after microwave ablation. A: 50 W group. Muscle tissue showed coagulative necrosis (arrow) and large carbonization areas without normal cell morphology; B: 30 W group. Muscle fibers showed a smaller necrotic and carbonized area (arrow); C: 30 W group. Neovascularization and fibroblasts (arrows) were increased at the junction; D: 50 W group. A large number of new collagen and scars (arrows) were observed at the junction. Original magnification: ×40 (A, B), ×250 (C, D) |
Masson染色结果显示,消融后1 h时,30 W组和50 W组兔骨骼肌纤维含量较少,无明显纤维增生,主要在血管周边和肌间质;消融后1~2 d,两组消融区中心与边缘正常组织交界处均可见新生胶原纤维,血管壁周边纤维增厚,肌间质纤维增生(图 4A);消融后7~28 d,两组交界处可见明显大量的新生胶原纤维,并伴随血管壁周边纤维明显增多,但消融后7 d时30 W组新生胶原纤维多于50 W组,28 d时50 W组新生胶原纤维(图 4B)多于30 W组。
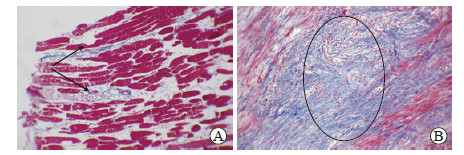
|
图 4 兔骨骼肌微波消融区Masson染色结果 Fig 4 Masson staining of microwave ablation area of rabbit skeletal muscle A: 30 W group. One day after microwave ablation, a small amount of new collagen fibers and muscle interstitial fiber hyperplasia (arrows) were observed at the junction; B: 50 W group. Twenty-eight days after microwave ablation, a large number of new collagen (circle) were observed at the junction. Original magnification: ×200 |
天狼星红染色结果显示,消融后1 h时,30 W组和50 W组兔骨骼肌纤维含量较少,在消融区中心与边缘正常组织交界处未见明显纤维形成;消融后1~2 d,两组交界处可见新生胶原纤维,并伴随血管周边胶原纤维增厚;消融后7 d,两组交界处可见明显新生胶原纤维,30 W组较50 W组多;消融后28 d,两组交界处可见大量新生胶原纤维,但50 W组多于30 W组。其中,消融后1 h和1 d时主要为Ⅰ型胶原纤维(图 5A);消融后2 d时不仅有Ⅰ型胶原纤维,还开始出现Ⅱ型胶原纤维;消融后7 d和28 d时,可见较多Ⅱ型胶原纤维呈网状分布,以50 W组明显(图 5B)。
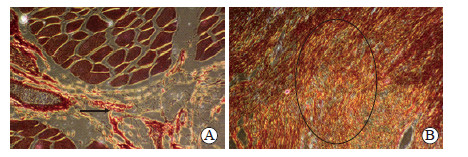
|
图 5 兔骨骼肌微波消融区天狼星红染色结果 Fig 5 Sirius red staining of microwave ablation area of rabbit skeletal muscle A: 30 W group. One day after microwave ablation there were a small amount of yellow or red striped typeⅠcollagen fibers (arrow); B: 50 W group. Twenty-eight days after microwave ablation there were a large number of typeⅡ collagen fibers (circle) in various colors. Original magnification: ×200 |
3 讨论 3.1 实时超声弹性成像技术对骨骼肌损伤修复的诊断价值
骨骼肌损伤后肌肉组织内部结构会发生变性、炎症、坏死、再生、纤维化瘢痕形成等一系列病理变化,这种变化遵循一定的规律,主要包括损伤、修复和改造3个阶段。在此过程中,肌肉组织的弹性或硬度也会发生相应改变[5],因此组织的弹性信息对于肌肉损伤的诊断过程具有重要的参考价值。Levinson等[6]首次尝试应用超声弹性成像获得人类骨骼肌收缩状态下的弹性信息。国内学者也开始尝试对肌肉组织的超声弹性成像特征进行研究,发现实时组织超声弹性成像能较常规二维超声更早地发现病变,也可较客观地评价病灶的相对硬度,为肌肉炎症的诊断提供了一种新的方法[7]。
临床常规依靠病理活组织检查作为金标准检测肌肉损伤情况,而实时超声弹性成像技术从另一全新的角度反映组织的弹性信息,能动态观察组织的弹性变化情况,目前已在许多领域展现了应用前景[8-10]。该技术有别于根据组织声阻抗差异来显示组织解剖学信息,利用探头压缩组织采集组织压缩前后各片段的信号,通过主机互相关方法处理后得到组织内部位移变化信息,获得应变分布与相对弹性系数分布。在相同外力作用下,弹性系数越大应变越小;反之,弹性系数越小应变越大[11]。超声弹性图像能提供关于组织弹性的组织力学信息及组织硬度SR,半定量评价组织软硬程度。
3.2 兔骨骼肌微波消融损伤修复过程中的肌肉组织弹性变化及病理意义骨骼肌损伤修复是一系列连续的病理过程,包括骨骼肌细胞的变性和坏死、肌纤维结构的破坏、炎症细胞浸润、钙盐沉积,纤维细胞增殖及卫星细胞激活、增殖分化为新的肌管细胞进而形成肌纤维等,最终可导致肌肉僵硬、弹性下降[12]。大多数骨骼肌损伤后的修复再生过程基本一致。本实验制备微波消融致兔骨骼肌急性损伤模型后,应用实时超声弹性成像技术对消融区骨骼肌组织进行弹性检测,发现正常组兔肌肉组织弹性良好,质地较软,消融后反映肌组织弹性信息的半定量指标SR均较正常组增高(P<0.05),说明在微波热辐射作用下肌肉组织中的氨基酸、蛋白质、细胞等发生变性、凝固、碳化和脱水,致使热凝区域的肌肉组织紧缩、变硬,弹性降低。消融后1 d、2 d、7 d、28 d时SR仍有明显的动态变化,这与肌肉组织热凝损伤后组织弹性明显下降有关,其中消融后1~2 d硬度最高,50 W组SR升高较快,消融后1 d时两组均可达峰值。之后两组SR均逐渐下降,28 d时30 W组SR下降至正常水平,但50 W组SR仍高于正常组。
结合病理组织研究发现,急性微波热损伤肌肉水肿、部分坏死,消融后1 d、2 d逐渐加重,呈进行性坏死倾向,50 W组损伤程度及范围均大于30 W组,故肌肉组织弹性进行性下降幅度较大;消融后7~28 d逐渐修复,在消融组织和边缘正常组织交界处可见明显新生胶原纤维并伴随血管壁周边纤维明显增多。理论上由于纤维组织增生肌肉组织弹性应继续下降,SR应较消融后1 d、2 d继续增高而非逐渐下降。可能是由于感兴趣区新生血管明显增多,且胶原纤维修复后的组织硬度仍不及肌肉组织热凝碳化、脱水、紧缩导致的硬度变化,从而导致SR未增高反而逐渐下降,但相关病理学机制还需要进一步深入研究。
天狼星红是一种强酸性染料,可以和胶原分子的碱性氨基酸发生稳定且特异的吸附反应,染色后有较明显的双折光性,是目前对胶原显示最好的染色方法[13]。微波消融致兔骨骼肌损伤后,在偏振光显微镜下不仅可观察到与Masson染色较一致的胶原纤维增生变化趋势,而且可以识别胶原纤维的类型。在消融后1 d时观察结果主要为点条状分布的Ⅰ型胶原纤维(强双折光性,呈黄色或红色);消融后2 d时观察结果不仅有Ⅰ型胶原纤维,还开始出现Ⅱ型胶原纤维(为弱双折光性,呈多种色彩的网状分布);消融后7~28 d时观察结果主要为Ⅰ型胶原纤维伴有大量的Ⅱ型胶原纤维网状分布,50 W组则以大量纤维细胞增殖为主,仅有少许肌细胞坏死。因此,从本研究结果可以看出,随着肌肉损伤后肌纤维的修复再生,SR变化总体呈先升后降的趋势,与观察到的组织病理学变化也较为一致。
通过超声弹性成像进行SR半定量分析,目前多用于甲状腺、乳腺等浅表肿瘤的特征分析、肿瘤消融部位随访,以及动态评估病变组织弹性变化。本研究借鉴该方法在临床应用及研究中取得的经验,利用其对微波消融损伤肌肉组织的弹性硬度进行分析,较为客观地对肌肉损伤后恢复情况做出评估。该方法减少了通过病理活组织检查判断肌肉损伤修复情况的有创风险,可作为判断肌肉损伤程度及修复情况的无创影像学指标。
本研究存在以下不足:(1)观察时间较短;(2)测量SR的取样框易受超声操作者的经验和主观影响;(3)受目前超声设备工程技术水平的限制,半定量的SR检测仍存在一定局限性。未来研究中应首先注重对超声弹性成像仪进行技术和参数改进,开展观察时间长并对肌肉损伤类型和程度进行分类、分级再进行定量指标检测的研究,进一步深入探讨肌肉损伤类型和程度对SR的影响及肌肉组织修复过程中病理改变与弹性变化的相关性,从而使实时超声弹性成像技术对肌肉损伤修复的判定更具临床价值。
| [1] |
GUERMAZI A, ROEMER F W, ROBINSON P, TOL J L, REGATTE R R, CREMA M D. Imaging of muscle injuries in sports medicine: sports imaging series[J/OL]. Radiology, 2017, 285: 1063. doi: 10.1148/radiol.2017174038.
|
| [2] |
PICCOLO C L, GALLUZZO M, IANNIELLO S, TRINCI M, RUSSO A, ROSSI E, et al. Pediatric musculoskeletal injuries: role of ultrasound and magnetic resonance imaging[J]. Musculoskeletal Surg, 2017, 101(Suppl 1): 85-102. |
| [3] |
赵佳琦, 章建全, 徐琪, 陈雁秋, 盛建国, 卢峰, 等.超声图像纹理分析技术对离体猪横纹肌理化损伤模型的定量研究[J/CD].中华医学超声杂志(电子版), 2013, 10: 674-680.
|
| [4] |
赵佳琦, 章建全, 盛建国, 赵璐璐, 潘倩.不同技术级别超声医师对离体猪横纹肌理化损伤模型超声定性诊断的局限性分析[J/CD].中华医学超声杂志(电子版), 2014, 11: 763-769.
|
| [5] |
JÄRVINEN T A, JÄRVINEN T L, KÄÄRIÄINEN M, KALIMO H, JÄRVINEN M. Muscle injuries: biology and treatment[J]. Am J Sports Med, 2005, 33: 745-764. DOI:10.1177/0363546505274714 |
| [6] |
LEVINSON S F, SHINAGAWA M, SATO T. Sonoelastic determination of human skeletal muscle elasticity[J]. J Biomech, 1995, 28: 1145-1154. DOI:10.1016/0021-9290(94)00173-2 |
| [7] |
刑春燕, 朱家安, 蒋业清, 胡一宙, 李殿城, 李佳, 等. 实时组织弹性成像在PGE2诱导的兔骨骼肌炎症中的应用价值[J]. 中国超声医学杂志, 2010, 26: 107-109. DOI:10.3969/j.issn.1002-0101.2010.02.004 |
| [8] |
RYU J, JEONG W K. Current status of musculoskeletal application of shear wave elastography[J]. Ultrasonography, 2017, 36: 185-197. DOI:10.14366/usg.16053 |
| [9] |
MUTALA T M, NDAIGA P, AYWAK A. Comparison of qualitative and semiquantitative strain elastography in breast lesions for diagnostic accuracy[J/OL]. Cancer Imaging, 2016, 16: 12. doi: 10.1186/s40644-016-0070-8.
|
| [10] |
范春芝, 安力春, 徐建红, 王真, 孙静, 唐杰, 等.实时定量超声弹性成像技术检测肱二头肌横切面与纵切面弹性差异的研究[J/CD].中华医学超声杂志(电子版), 2011, 8: 1039-1047.
|
| [11] |
王怡, 王涌, 张希敏, 秦茜淼, 王意达, 徐智章. 实时组织弹性成像技术在鉴别诊断乳腺良恶性肿块中的价值评估[J]. 中华超声影像学杂志, 2005, 14: 911-913. DOI:10.3760/j.issn:1004-4477.2005.12.008 |
| [12] |
胡艳, 董磊, 刘晓红, 张彦, 孙媛媛, 王英娈, 等. 声脉冲辐射力成像技术评价家兔肌肉损伤后组织修复的动态变化[J]. 中华超声影像学杂志, 2012, 21: 533-536. DOI:10.3760/cma.j.issn.1004-4477.2012.06.024 |
| [13] |
张艳, 陈银成. 苦味酸天狼星红对胶原纤维染色的方法[J]. 医药论坛杂志, 2003, 24: 61. |
 2019, Vol. 40
2019, Vol. 40


