2. 上海交通大学医学院附属瑞金医院上海市伤骨科研究所, 上海市中西医结合防治骨与关节病损重点实验室, 上海 200025
2. Shanghai Key Laboratory for Prevention and Treatment of Bone and Joint Diseases, Shanghai Institute of Traumatology and Orthopaedics, Ruijin Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai 200025, China
成骨不全症(osteogenesis imperfecta,OI)是一组以骨脆性增加、胶原代谢紊乱为特征的全身性遗传性结缔组织疾病,其发病率为1/20 000~1/15 000[1]。绝大多数OI由Ⅰ型胶原蛋白α1链(collagen typeⅠ α1 chain,Col1a1)或Ⅰ型胶原蛋白α2链(collagen typeⅠ α2 chain,Col1a2)基因显性遗传突变使Ⅰ型胶原合成减少或结构异常导致[2]。OI根据表型主要分为5个亚型(Ⅰ~Ⅴ型),其临床特征主要包括骨量降低、反复骨折、长骨或脊柱畸形、牙本质发育不全、关节松弛、身材矮小、巩膜蓝色,甚至死亡等[3]。OI症状多于儿童时期开始出现[4],严重影响患者的生活质量,也给家庭和社会带来沉重的负担。
目前,OI尚缺乏有效的治疗手段,临床治疗方案主要包括手术矫形、药物治疗、分子与细胞治疗[5]。药物治疗是OI的主要治疗方式,其中双膦酸盐的临床应用最为广泛。双膦酸盐的治疗作用主要包括增加骨量、减少骨痛、增强肌力及改善生活质量,然而,其是否能降低OI患者的骨折发生率目前尚无定论[6-7],然而研究也发现双膦酸盐具有破坏骨愈合和骨重建、损坏骨细胞、减少骨矿化及抑制骨生长等不良反应[8-10]。此外,双膦酸盐半衰期长,在体内存留时间可达数年,其治疗OI的最佳剂量和疗程仍不清楚。因此,有必要探索更有效的OI治疗药物。
雷奈酸锶(strontium ranelate,SrR)是一种新型的治疗骨质疏松药物[11],临床试验结果表明SrR可增加绝经后妇女脊柱及髋部骨密度、降低脊柱及非脊柱部位的骨折发生率,而且其疗效可长达10年[12-13]。oim小鼠(B6C3Fe-α/α-Col1a2oim/+)是Col1a2 上一处自发突变导致的骨结构异常模型,与人类OI有相同的临床表现和生物学特性,是目前研究OI的主要动物模型[14]。SrR可降低OI模型oim 小鼠的骨折发生率、增强骨骼力学强度、改善骨微结构[15]。为进一步揭示SrR治疗OI的机制,本研究以oim小鼠为研究对象,通过体外细胞学研究探讨SrR对oim小鼠成骨细胞及破骨细胞的影响,为SrR应用于临床治疗OI奠定实验基础。
1 材料和方法 1.1 实验动物所有动物操作经海军军医大学(第二军医大学)实验动物伦理委员会审核批准,B6C3Fe-α/α-Col1a2oim/+杂合子购自美国Jackson实验室,委托南京大学-南京生物医药研究院繁育、保种。该品系小鼠后代经基因鉴定、筛选,获得足够数量的纯合子(oim/oim)小鼠及野生型(wt/wt)小鼠。
1.2 成骨细胞的获取与分组取1周龄的oim/oim 或wt/wt小鼠颅骨,剪碎后采用Ⅰ型胶原酶(美国Sigma公司)通过连续消化法(具体方法参考文献[16])获取成骨细胞,用含10%胎牛血清(美国Gibco公司)及1%青/链霉素(美国Gibco公司)的α-MEM培养液(美国Gibco公司)培养,培养条件为37 ℃、5% CO2、饱和湿度,待细胞生长至80%融合度时进行传代。取第3代细胞铺于6孔板(1×105/孔),培养24 h后在培养液中添加成骨分化诱导剂:50 μg/mL L-抗坏血酸(美国Sigma公司)、10 mmol/L β-甘油磷脂(美国Sigma公司)及100 nmol/L地塞米松(加拿大BBI Life Sciences公司)。成骨细胞诱导分化时间为7 d,每2 d更换1次培养液。oim/oim干预组成骨细胞在诱导液中加入不同浓度(1、10 mmol/L)的SrR(法国施维雅药厂)进行干预,以oim/oim非干预组及wt/wt组成骨细胞作为对照。
1.3 破骨细胞的获取与分组分离5~7周龄oim/oim小鼠和wt/wt小鼠的股骨及胫骨,获取骨髓,在含10%胎牛血清及1%青/链霉素的α-MEM培养液中培养,24 h后收集未贴壁细胞,采用Ficoll梯度离心法获取骨髓单核细胞(bone marrow mononuclear cell,BMMC),用完全培养液重悬后铺于24孔板(2.5×104/孔),并添加50 ng/mL的巨噬细胞集落刺激因子(macrophage-colony stimulating factor,M-CSF;美国PeproTech公司);培养3 d后将培养液更换为含20 ng/mL M-CSF及60 ng/mL核因子κB受体活化因子配体(receptor activator of nuclear factor κB ligand,RANKL;美国PeproTech公司)的α-MEM培养液,其中oim/oim干预组破骨细胞予以不同浓度(1、10 mmol/L)的SrR进行干预,以oim/oim非干预组及wt/wt组破骨细胞作为对照。
1.4 反转录及实时定量PCR(quantitative real-time PCR,qRT-PCR)检测mRNA表达水平成骨细胞及破骨细胞干预7 d后均依次采用TRIzol(美国Invitrogen公司)、氯仿、异丙醇、70%乙醇进行RNA提取(具体方法参考文献[16])。RNA浓度测定后进一步采用反转录试剂盒(日本TaKaRa公司)反转录为cDNA;使用SYBR®Premix Ex TaqTM Ⅱ试剂盒(日本TaKaRa公司),应用7500型荧光定量PCR仪(美国ABI公司)检测成骨细胞分化相关基因Runt相关转录因子2(Runt-related transcription factor 2,Runx2)、碱性磷酸酶(alkaline phosphatase,ALP)、骨钙蛋白(osteocalcin,OCN),破骨细胞分化相关基因降钙素受体(calcitonin receptor,Calcr)、抗酒石酸磷酸酶(tartrate-resistant acid phosphatase,Trap)、组织蛋白酶K(cathepsin K,CTSK),以及破骨细胞分化相关转录因子c-fos、活化T细胞核因子c1(nuclear factor of activated T-cell c1,NFATc1)的mRNA表达,以GAPDH作为内参照,各基因扩增引物见表 1。
|
|
表 1 实时定量PCR分析的目标引物序列 Tab 1 Primer sequences for quantitative real-time PCR |
1.5 蛋白质印迹法检测蛋白表达水平
成骨细胞及破骨细胞干预7 d后采用RIPA裂解,BCA法测定蛋白浓度,高温变性,依次进行电泳、转膜、封闭(5%脱脂奶粉溶液封闭2 h);4℃条件下一抗孵育过夜,相关一抗为Runx2(英国Abcam公司,稀释比例为1︰500)、ALP(英国Abcam公司,1︰400)、OCN(英国Abcam公司,1︰200)、Calcr(英国Abcam公司,1︰500)、Trap(英国Abcam公司,1︰200)、CTSK(英国Abcam公司,1︰400)、c-fos(英国Abcam公司,1︰1 000)、NFATc1(英国Abcam公司,1︰500)和β-肌动蛋白(β-actin;美国Santa Cruz公司,1︰1 000)。次日,用Tris盐酸盐缓冲液+Tween(TBST)清洗后,二抗室温下孵育1 h。用电化学发光法显影成像,采用BandScan软件分析相对蛋白表达水平。
1.6 成骨细胞ALP染色及其活性测定成骨细胞在干预7 d后采用4%多聚甲醛溶液[E672002,生工生物工程(上海)股份有限公司]固定15 min,用ALP染色试剂盒[D720338,生工生物工程(上海)股份有限公司] 37℃条件下染色30 min,磷酸盐缓冲液清洗后,分别用Canon相机(650D)和倒置光学显微镜(日本Olympus公司,40×)观察并拍照,分化的成骨细胞被染成蓝色,ALP染色强度用于评估成骨分化的程度。
同样条件培养及干预成骨细胞7 d后收集各组细胞,20 000×g离心5 min,对细胞沉淀采用BCA法检测蛋白浓度,同时对等量的细胞沉淀采用ALP活性检测试剂盒(美国Sigma公司)进行检测,37 ℃条件下孵育30 min,用分光光度计(美国Molecular Devices公司)测量450 nm波长处的光密度(D)值,各组ALP活性值采用蛋白浓度值进行标准化处理。
1.7 成骨细胞茜素红S染色及定量分析成骨细胞在干预14 d后,采用4%多聚甲醛溶液固定15 min,用0.2%茜素红S溶剂(美国Sigma公司)在37℃条件下染色30 min,磷酸盐缓冲液清洗后,分别用Canon相机和倒置光学显微镜观察并拍照,被染成红色的部分为钙结节。茜素红S染色后加入5%的高氯酸,37℃避光孵育30 min,用分光光度计测量420 nm波长处的D值,并进行定量分析。
1.8 Trap染色检测破骨细胞形成数量破骨细胞诱导分化成熟(7 d)后,采用4%多聚甲醛溶液固定15 min,用Trap染色试剂盒(美国Sigma公司)于室温下染色30 min,镜下多核且呈红色的细胞即为破骨细胞,倒置光学显微镜下拍摄后进行细胞计数,每孔随机选择6个视野,取平均值,实验重复3次。
1.9 骨片陷窝实验评估破骨细胞骨吸收活性具体方法参考文献[16],将脱水消毒后的牛皮质骨片修剪至5 mm×5 mm×1 mm大小,预先铺至24孔板中,然后将分离后的单核细胞铺至骨片上进行培养及干预,诱导7 d后取出骨片,放置于1 mol/L的氨水中超声处理10 min,去除骨片上的残余细胞;然后用1%甲苯胺蓝和硼酸钠染色1 min,光学显微镜下观察陷窝被染成深蓝色,随机选择6个视野,计算陷窝面积,取平均值,实验重复3次。
1.10 3-(4, 5-二甲基噻唑-2)-2, 5-二苯基四氮唑溴盐[3-(4, 5-dimethylthiazol-2-yl)-2, 5-diphenyltetrazolium bromide,MTT]比色法检测SrR对成骨细胞与破骨细胞活性的影响将成骨细胞(5×104/mL)接种于96孔板,200 μL/孔,用成骨细胞诱导液培养,细胞贴壁后,弃上清,然后用含不同浓度(0、1、10 mmol/L)SrR的培养液培养。对于破骨细胞,将BMMC(5×105/mL)接种于96孔板,用含50 ng/mL M-CSF的培养液培养,并给予不同浓度(0、1、10 mmol/L)SrR干预。2种细胞均在SrR干预3 d后,于每孔细胞中添加MTT混合液(5 mg/mL)继续孵育2 h。孵育结束时小心吸去孔内上清液,每孔加入二甲基亚砜,震荡10 min,用瑞士TECAN infinite 200型酶标仪测定450 nm波长处各孔D值,取平均值。
1.11 统计学处理应用SPSS 20.0软件进行数据处理。计量资料以x±s表示,组间比较采用单因素方差分析。检验水准(α)为0.05。
2 结果 2.1 SrR诱导oim小鼠成骨细胞分化相关基因的表达与wt/wt小鼠成骨细胞相比,oim/oim小鼠成骨细胞分化相关基因Runx2、ALP、OCN的mRNA和蛋白表达水平均降低(P均<0.05)。oim/oim小鼠的成骨细胞在给予不同浓度(1、10 mmol/L)SrR干预7 d后,无论mRNA水平还是蛋白水平SrR均呈剂量依赖方式促进成骨细胞分化相关基因Runx2、ALP、OCN的表达(P均<0.05)。见图 1。

|
图 1 qRT-PCR和蛋白质印迹法检测SrR促进成骨细胞分化 Fig 1 SrR stimulating differentiation of osteoblasts in vitro measured by qRT-PCR and Western blotting A-C: qRT-PCR; D-F: Western blotting. qRT-PCR: Quantitative real-time polymerase chain reaction; SrR: Strontium ranelate; Runx2: Runt-related transcription factor 2; ALP: Alkaline phosphatase; OCN: Osteocalcin; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase; wt/wt: Wild type. *P < 0.05 vs oim/oim group; △P < 0.05 vs oim/oim+SrR (1 mmol/L) group. n=3, x±s |
2.2 SrR促进oim小鼠成骨细胞分化及矿化
ALP染色结果显示oim/oim小鼠成骨细胞中的ALP活性低于wt/wt小鼠(P<0.05),SrR干预可增强oim/oim小鼠成骨细胞中的ALP活性并呈剂量依赖性(P<0.05,图 2A)。同样,茜素红S染色结果也显示,oim/oim小鼠成骨细胞中的钙结节形成数量少于wt/wt小鼠(P<0.05),而给予SrR干预后oim/oim小鼠成骨细胞中的钙结节形成数量随着SrR浓度增加而增多(P<0.05,图 2B)。

|
图 2 ALP染色和茜素红S染色检测SrR促进成骨细胞分化及矿化 Fig 2 SrR promoting osteoblast differentiation and mineralization in vitro measured by ALP and alizarin red S staining A: Representative pictures of ALP staining (original magnification: ×40) and ALP activity outcomes; B: Representative pictures of alizarin red S staining (original magnification: ×40) and quantitative analysis outcomes. SrR: Strontium ranelate; ALP: Alkaline phosphatase; wt/wt: Wild type. *P < 0.05 vs oim/oim group; △P < 0.05 vs oim/oim+SrR (1 mmol/L) group. n=3, x±s |
2.3 SrR抑制 oim 小鼠破骨细胞分化相关基因的表达
与wt/wt小鼠破骨细胞对比,oim/oim小鼠破骨细胞分化相关基因Calcr、Trap、CTSK的mRNA和蛋白表达水平均升高(P均<0.05),oim/oim小鼠的破骨细胞在给予不同浓度(1、10 mmol/L)SrR干预7 d后,无论mRNA水平还是蛋白水平SrR均呈剂量依赖方式抑制破骨细胞分化相关基因Calcr、Trap、CTSK的表达(P 均<0.05,图 3A~3F)。SrR干预条件下,c-fos和NFATc1蛋白表达水平均降低(P均<0.05,图 3G~3I)。
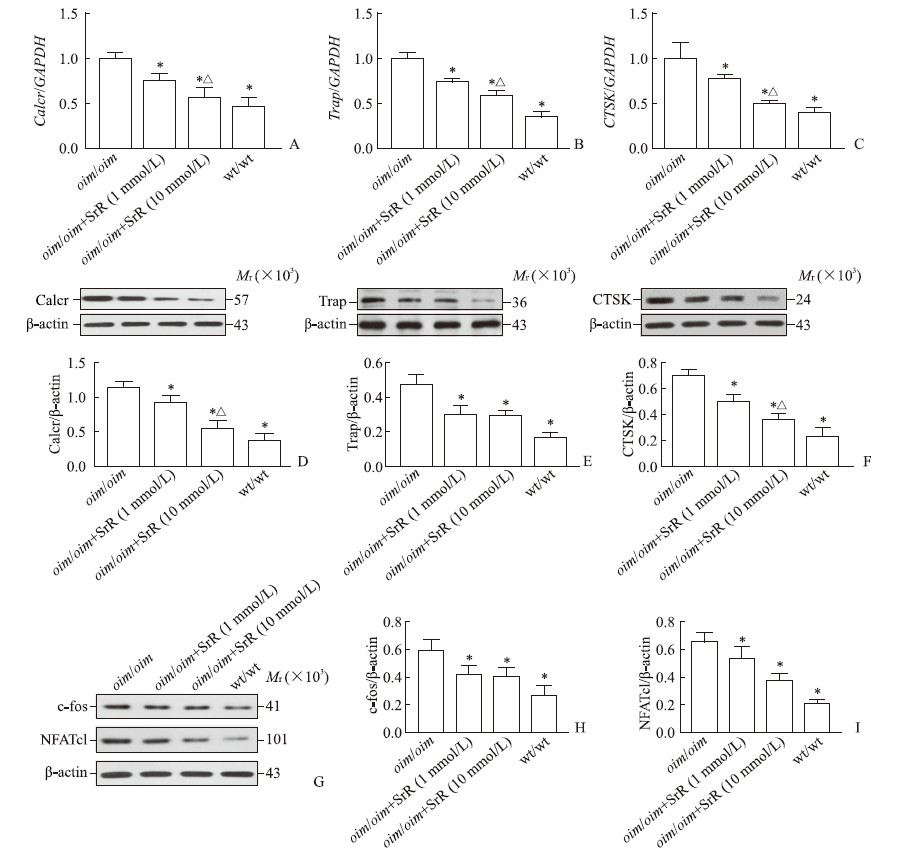
|
图 3 qRT-PCR和蛋白质印迹法检测SrR抑制破骨细胞分化 Fig 3 SrR inhibiting differentiation of osteoclasts in vitro measured by qRT-PCR and Western blotting A-C: qRT-PCR outcomes of Calcr, Trap and CTSK; D-F: Western blotting outcomes of Calcr, Trap, and CTSK; G-I: Western blotting outcomes of c-fos and NFATc1. qRT-PCR: Quantitative real-time polymerase chain reaction; SrR: Strontium ranelate; Calcr: Calcitonin receptor; Trap: Tartrate-resistant acid phosphatase; CTSK: Cathepsin K; c-fos: Cellular oncogene fos; NFATc1: Nuclear factor of activated T-cell c1; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase; wt/wt: Wild type. *P < 0.05 vs oim/oim group; △P < 0.05 vs oim/oim+SrR (1 mmol/L) group. n=3, x±s |
2.4 SrR抑制oim小鼠破骨细胞形成数量并降低其骨吸收能力
Trap染色结果显示,oim/oim小鼠的破骨细胞形成数量多于wt/wt小鼠,差异有统计学意义(P<0.05),SrR干预可抑制oim/oim小鼠破骨细胞形成数量并呈剂量依赖性(P<0.05,图 4)。骨片陷窝实验结果显示,oim/oim小鼠的破骨细胞骨吸收活性高于wt/wt小鼠(P<0.05),而给予SrR干预后oim/oim小鼠的破骨细胞骨吸收活性随着SrR浓度增加而下降(P<0.05,图 5)。

|
图 4 SrR抑制oim小鼠破骨细胞形成 Fig 4 SrR inhibiting osteoclastogenesis of oim mice in vitro A: Trap staining pictures of osteoclasts (original magnification: ×40); B: Numbers of osteoclasts based on Trap staining. SrR: Strontium ranelate; wt/wt: Wild type. *P < 0.05 vs oim/oim group; △P < 0.05 vs oim/oim+SrR (1 mmol/L) group. n=3, x±s |

|
图 5 SrR抑制oim小鼠破骨细胞骨吸收能力 Fig 5 SrR inhibiting osteoclast bone resorption of oim mice in vitro A: Pit formations of osteoclast resorption (original magnification: ×40); B: Resorption rate of osteoclasts detected by pit formation assay. SrR: Strontium ranelate; wt/wt: Wild type. *P < 0.05 vs oim/oim group; △P < 0.05 vs oim/oim+SrR (1 mmol/L) group. n=3, x±s |
2.5 SrR对oim小鼠的成骨细胞和破骨细胞均无毒性
oim/oim小鼠成骨细胞给予不同浓度(0、1、10 mmol/L)SrR干预3 d后,MTT孵育2 h后的D450值分别为1.91±0.17、1.89±0.21、2.04±0.19,10 mmol/L SrR与0 mmol/L SrR之间差异无统计学意义(P>0.05)。提示SrR对oim小鼠的成骨细胞无明显毒性,SrR可能促进oim小鼠成骨细胞增殖。oim/oim小鼠BMMC给予不同浓度(0、1、10 mmol/L)SrR干预3 d后,MTT孵育2 h后的D450值分别为1.85±0.17、1.83±0.14、1.86±0.16,差异无统计学意义(P>0.05)。提示SrR对oim小鼠的破骨细胞活性无明显影响。
3 讨论SrR对骨代谢具有双重作用,既能促进骨形成又能抑制骨吸收,从而有效改善骨的几何特性及微观结构、增加骨量及骨矿化[17-18]。本研究在前期动物实验[15]基础上,通过体外细胞学实验发现SrR可促进oim小鼠的成骨细胞分化及矿化,同时抑制oim小鼠的破骨细胞形成及骨吸收活性。
Ⅰ型胶原是骨细胞外基质的主要成分,约占骨有机质的90%,对于维持骨架完整性和骨骼功能至关重要[19-20]。成骨过程中,Ⅰ型胶原不仅能够引导钙盐沉积、矿化及羟基磷灰石晶体的形成[21],还能作为细胞外信号分子结合特异性受体整合素α2β1、激活黏附斑激酶(focal adhesion kinase,FAK)、介导细胞内信号转导、诱导成骨细胞分化及黏附等过程[22-23]。OI患者由于Col1a1 和Col1a2 基因突变,导致Ⅰ型胶原结构异常或含量缺乏,进而造成成骨细胞分化及矿化障碍。Li等[24]研究发现,oim小鼠的成骨细胞处于不断增殖状态,但仅有一小部分分化至成熟阶段,大部分成骨细胞仍处于未分化阶段。成骨细胞与破骨细胞共同参与调节骨代谢,OI中不仅存在成骨细胞分化及矿化障碍,同时还存在破骨细胞活跃。Li等[24]将oim小鼠未分化成熟的成骨细胞、wt/wt小鼠的正常成骨细胞分别与破骨细胞共培养,发现oim小鼠的破骨细胞形成能力及骨吸收活性增强,其机制可能与未分化的成骨细胞高表达RANKL和肿瘤坏死因子α(tumor necrosis factor α,TNF-α)有关。由此可见,成骨细胞-破骨细胞的平衡障碍是OI的重要致病机制。
根据OI的发病机制,治疗OI的理想药物应具备促进成骨细胞成熟、抑制破骨细胞活性的双重作用。目前研究发现SrR对骨代谢具有双重作用,几项针对骨质疏松的大规模多中心随机对照研究(SOTI[25]、TROPOS[12, 25]、STRATOS[26])均表明,SrR可降低髋骨骨折和外周骨折的发生风险,增加腰椎骨密度、降低脊柱骨折发生率33%~41%,且长期使用安全、有效。本课题组前期考察了SrR治疗OI的疗效,结果发现SrR可降低OI模型小鼠的骨折发生率[15],但具体机制尚不明确。
ALP能调节局部钙、磷水平,促进骨间质矿化,ALP活性的高低是反映早期成骨细胞分化的关键生物学指标之一[27];Runx2是成骨分化的标志性基因,而OCN反映成骨细胞矿化及成熟情况。既往研究发现,SrR改善去卵巢骨质疏松大鼠的骨结构,同时伴随血清中ALP和OCN含量的增加[28],提示SrR可能通过促进成骨细胞分化及矿化发挥作用。进一步体外实验表明,SrR可诱导成骨细胞系MC3T3-E1中ALP的表达增加,但不影响MC3T3-E1的矿化[29]。Bonnelye等[30]体外培养小鼠颅骨来源成骨细胞,发现SrR可诱导成骨前体细胞向成熟成骨细胞分化、增加成骨结节形成,不仅如此,成骨早期分化基因和晚期分化基因ALP、OCN、骨唾液酸蛋白(bone sialoprotein,BSP)的表达在SrR作用下也上调。SrR对正常小鼠及去卵巢大鼠的成骨细胞的促进作用与其对OI小鼠成骨细胞的作用类似,本研究以oim小鼠的成骨细胞为研究对象,发现SrR同样可促进oim小鼠成骨细胞的早期及晚期分化基因表达,并诱导钙结节形成。结合前期体内实验研究结果[15],提示SrR降低oim小鼠骨折发生率的机制可能是通过诱导小鼠体内尚未分化的成骨细胞向成熟阶段分化及矿化而实现。
破骨细胞是机体内唯一具有溶骨作用的细胞,异常激活破骨细胞可导致骨密度降低,进而导致骨代谢疾病的发生[31]。破骨细胞由单核细胞聚集而成,NFATc1和Trap是破骨细胞分化及形成的标志性基因,而CTSK反映破骨细胞吸收活性。既往研究发现,SrR可导致绝经后骨质疏松模型大鼠的破骨细胞数量和表面积降低,同时伴随血清中Trap含量及Ⅰ型胶原N末端肽水平下降[28],提示SrR可能通过抑制破骨活性达到减少骨量丢失的效果。进一步体外分离BMMC进行培养,SrR干预后多核破骨细胞形成受到抑制,象牙骨皮质吸收实验结果也显示SrR可抑制破骨细胞骨吸收活性,其机制可能是通过破坏破骨细胞中的微丝肌动蛋白骨架结构从而干扰破骨细胞与骨质之间的贴附过程[30]。本实验采用不同浓度SrR作用于OI的破骨细胞,破骨细胞分化相关基因Calcr、Trap、CTSK及相关信号通路分子c-fos和NFATc1的表达水平均降低,且Trap染色及骨片陷窝实验显示,SrR干预后oim 小鼠的破骨细胞形成数量及破骨吸收面积均减少,细胞活性检测发现SrR干预条件下BMMC的活性并未降低,提示SrR可能通过抑制破骨细胞的形成及骨吸收活性而减少OI中骨质的破坏。
本研究通过体外实验验证了SrR对OI异常骨代谢的双重作用。本研究结果提示,SrR降低OI骨折发生率的机制可能是通过促进成骨分化相关基因Runx2、ALP及OCN的表达,从而诱导OI未分化的成骨细胞向成熟阶段分化;同时SrR还抑制破骨细胞形成及其骨吸收活性,从而减少OI中骨质的破坏。本研究结果为SrR临床治疗OI奠定了一定的理论基础。
| [1] |
KANG H, ARYAL A C S, MARINI J C. Osteogenesis imperfecta: new genes reveal novel mechanisms in bone dysplasia[J]. Transl Res, 2017, 181: 27-48. DOI:10.1016/j.trsl.2016.11.005 |
| [2] |
MARINI J C, FORLINO A, BÄCHINGER H P, BISHOP N J, BYERS P H, PAEPE A, et al. Osteogenesis imperfecta[J/OL]. Nat Rev Dis Primers, 2017, 3: 17053. doi: 10.1038/nrdp.2017.52.
|
| [3] |
PALOMO T, VILAÇA T, LAZARETTI-CASTRO M. Osteogenesis imperfecta: diagnosis and treatment[J]. Curr Opin Endocrinol Diabetes Obes, 2017, 24: 381-388. DOI:10.1097/MED.0000000000000367 |
| [4] |
GIL J A, DEFRODA S F, SINDHU K, GRUZ A I Jr, DANIELS A H. Challenges of fracture management for adults with osteogenesis imperfecta[J/OL]. Orthopedics, 2017, 40: e17-e22. doi: 10.3928/01477447-20161006-04.
|
| [5] |
MORELLO R. Osteogenesis imperfecta and therapeutics[J]. Matrix Biol, 2018, 71/72: 294-312. DOI:10.1016/j.matbio.2018.03.010 |
| [6] |
HALD J D, EVANGELOU E, LANGDAHL B L, RALSTON S H. Bisphosphonates for the prevention of fractures in osteogenesis imperfecta: meta-analysis of placebo-controlled trials[J]. J Bone Miner Res, 2015, 30: 929-933. DOI:10.1002/jbmr.2410 |
| [7] |
TREJO P, FASSIER F, GLORIEUX F H, RAUCH F. Diaphyseal femur fractures in osteogenesis imperfecta: characteristics and relationship with bisphosphonate treatment[J]. J Bone Miner Res, 2017, 32: 1034-1039. DOI:10.1002/jbmr.3071 |
| [8] |
UVEGES T E, KOZLOFF K M, TY J M, LEDGARD F, RAGGIO C L, GRONOWICZ G, et al. Alendronate treatment of the Brtl osteogenesis imperfecta mouse improves femoral geometry and load response before fracture but decreases predicted material properties and has detrimental effects on osteoblasts and bone formation[J]. J Bone Miner Res, 2009, 24: 849-859. DOI:10.1359/jbmr.081238 |
| [9] |
BIGGIN A, MUNNS C F. Long-term bisphosphonate therapy in osteogenesis imperfecta[J]. Curr Osteoporos Rep, 2017, 15: 412-418. DOI:10.1007/s11914-017-0401-0 |
| [10] |
LLOYD A A, GLUDOVATZ B, RIEDEL C, LUENGO E A, SAIYED R, MARTY E, et al. Atypical fracture with long-term bisphosphonate therapy is associated with altered cortical composition and reduced fracture resistance[J]. Proc Natl Acad Sci USA, 2017, 114: 8722-8727. DOI:10.1073/pnas.1704460114 |
| [11] |
REGINSTER J Y, DEROISY R, JUPSIN I. Strontium ranelate: a new paradigm in the treatment of osteoporosis[J]. Drugs Today (Barc), 2003, 39: 89-101. DOI:10.1358/dot.2003.39.2.799416 |
| [12] |
REGINSTER J Y, SEEMAN E, DE VERNEJOUL M C, ADAMI S, COMPSTON J, PHENEKOS C, et al. Strontium ranelate reduces the risk of nonvertebral fractures in postmenopausal women with osteoporosis: Treatment of Peripheral Osteoporosis (TROPOS) study[J]. J Clin Endocrinol Metab, 2005, 90: 2816-2822. DOI:10.1210/jc.2004-1774 |
| [13] |
MEUNIER P J, ROUX C, SEEMAN E, ORTOLANI S, BADURSKI J E, SPECTOR T D, et al. The effects of strontium ranelate on the risk of vertebral fracture in women with postmenopausal osteoporosis[J]. N Engl J Med, 2004, 350: 459-468. DOI:10.1056/NEJMoa022436 |
| [14] |
CHIPMAN S D, SWEET H O, MCBRIDE D J Jr, DAVISSON M T, MARKS S C Jr, SHULDINER A R, et al. Defective proα2(Ⅰ) collagen synthesis in a recessive mutation in mice: a model of human osteogenesis imperfecta[J]. Proc Natl Acad Sci USA, 1993, 90: 1701-1705. DOI:10.1073/pnas.90.5.1701 |
| [15] |
SHI C, HU B, GUO L, CAO P, TIAN Y, MA J, et al. Strontium ranelate reduces the fracture incidence in a growing mouse model of osteogenesis imperfecta[J]. J Bone Miner Res, 2016, 31: 1003-1014. DOI:10.1002/jbmr.2770 |
| [16] |
SHI C, QI J, HUANG P, JIANG M, ZHOU Q, ZHOU H, et al. MicroRNA-17/20a inhibits glucocorticoid-induced osteoclast differentiation and function through targeting RANKL expression in osteoblast cells[J]. Bone, 2014, 68: 67-75. DOI:10.1016/j.bone.2014.08.004 |
| [17] |
PEI Y, ZHENG K, SHANG G, WANG Y, WANG W, QIU E, et al. Therapeutic effect of strontium ranelate on bone in chemotherapy-induced osteopenic rats via increased bone volume and reduced bone loss[J]. Biol Trace Elem Res, 2019, 187: 472-481. DOI:10.1007/s12011-018-1401-3 |
| [18] |
QUADE M, VATER C, SCHLOOTZ S, BOLTE J, LANGANKE R, BRETSCHNEIDER H, et al. Strontium enhances BMP-2 mediated bone regeneration in a femoral murine bone defect model[J/OL]. J Biomed Mater Res B Appl Biomater, 2019. doi: 10.1002/jbm.b.34376.
|
| [19] |
GARNERO P. The role of collagen organization on the properties of bone[J]. Calcif Tissue Int, 2015, 97: 229-240. DOI:10.1007/s00223-015-9996-2 |
| [20] |
BARBER L A, ABBOTT C, NAKHATE V, DO A N D, BLISSETT A R, MARINI J C. Longitudinal growth curves for children with classical osteogenesis imperfecta (types Ⅲ and Ⅳ) caused by structural pathogenic variants in type Ⅰ collagen[J]. Genet Med, 2019, 21: 1233-1239. DOI:10.1038/s41436-018-0307-y |
| [21] |
WANG Y, AZAÏS T, ROBIN M, VALLÉE A, CATANIA C, LEGRIEL P, et al. The predominant role of collagen in the nucleation, growth, structure and orientation of bone apatite[J]. Nat Mater, 2012, 11: 724-733. DOI:10.1038/nmat3362 |
| [22] |
STANGE R, KRONENBERG D, TIMMEN M, EVERDING J, HIDDING H, ECKES B, et al. Age-related bone deterioration is diminished by disrupted collagen sensing in integrin α2β1 deficient mice[J]. Bone, 2013, 56: 48-54. DOI:10.1016/j.bone.2013.05.003 |
| [23] |
TAKEUCHI Y, SUZAWA M, KIKUCHI T, NISHIDA E, FUJITA T, MATSUMOTO T. Differentiation and transforming growth factor-β receptor down-regulation by collagen-α2β1 integrin interaction is mediated by focal adhesion kinase and its downstream signals in murine osteoblastic cells[J]. J Biol Chem, 1997, 272: 29309-29316. DOI:10.1074/jbc.272.46.29309 |
| [24] |
LI H, JIANG X, DELANEY J, FRANCESCHETTI T, BILIC-CURCIC I, KALINOVSKY J, et al. Immature osteoblast lineage cells increase osteoclastogenesis in osteogenesis imperfecta murine[J]. Am J Pathol, 2010, 176: 2405-2413. DOI:10.2353/ajpath.2010.090704 |
| [25] |
REGINSTER J Y, BRUYÈRE O, SAWICKI A, ROCES-VARELA A, FARDELLONE P, ROBERTS A, et al. Long-term treatment of postmenopausal osteoporosis with strontium ranelate: results at 8 years[J]. Bone, 2009, 45: 1059-1064. DOI:10.1016/j.bone.2009.08.004 |
| [26] |
MEUNIER P J, SLOSMAN D O, DELMAS P D, SEBERT J L, BRANDI M L, ALBANESE C, et al. Strontium ranelate: dose-dependent effects in established postmenopausal vertebral osteoporosis—a 2-year randomized placebo controlled trial[J]. J Clin Endocrinol Metab, 2002, 87: 2060-2066. |
| [27] |
PARK C S, HA T H, KIM M, RAJA N, YUN H S, SUNG M J, et al. Fast and sensitive near-infra red fluorescent probes for ALP detection and 3D printed calcium phosphate scaffold imaging in vivo[J]. Biosens Bioelectron, 2018, 105: 151-158. DOI:10.1016/j.bios.2018.01.018 |
| [28] |
MARIE P J, HOTT M, MODROWSKI D, DE POLLAK C, GUILLEMAIN J, DELOFFRE P, et al. An uncoupling agent containing strontium prevents bone loss by depressing bone resorption and maintaining bone formation in estrogen-deficient rats[J]. J Bone Miner Res, 1993, 8: 607-615. |
| [29] |
BARBARA A, DELANNOY P, DENIS B G, MARIE P J. Normal matrix mineralization induced by strontium ranelate in MC3T3-E1 osteogenic cells[J]. Metabolism, 2004, 53: 532-537. DOI:10.1016/j.metabol.2003.10.022 |
| [30] |
BONNELYE E, CHABADEL A, SALTEL F, JURDIC P. Dual effect of strontium ranelate: stimulation of osteoblast differentiation and inhibition of osteoclast formation and resorption in vitro[J]. Bone, 2008, 42: 129-138. DOI:10.1016/j.bone.2007.08.043 |
| [31] |
NG P Y, BRIGITTE PATRICIA RIBET A, PAVLOS N J. Membrane trafficking in osteoclasts and implications for osteoporosis[J]. Biochem Soc Trans, 2019, 47: 639-650. DOI:10.1042/BST20180445 |
 2019, Vol. 40
2019, Vol. 40


