2. 海军军医大学(第二军医大学)药学院药物分析学教研室, 上海 200433
2. Department of Pharmaceutical Analysis, School of Pharmacy, Naval Medical University(Second Military Medical University), Shanghai 200433, China
药物原辅料混合是固体口服制剂生产过程中的重要步骤,其混合均匀度是药物生产的关键质量控制指标。目前混合均匀度判定的常用方法有紫外可见分光光度法、高效液相色谱法(high-performance liquid chromatography,HPLC)等[1-3],这些传统分析方法具有分析时间长、破坏样品、多次取样药品污染风险增加、分析结果滞后生产过程、影响生产进度、操作人员暴露于高浓度原料药环境等弊端[4-6]。
近红外光谱(near-infrared spectroscopy,NIRS)分析技术具有分析速度快、效率高、无损、安全、环保等优势,因此已成为目前医药领域最具有发展前景的分析技术之一[7]。将NIRS分析技术应用于药物的原辅料混合过程与美国食品药品管理局(Food and Drug Administration,FDA)提出的过程分析技术(process analytical technology,PAT)[8]的宗旨一致[9]。
硫酸羟氯喹临床上用于治疗类风湿关节炎和系统性红斑狼疮[10-12],其原辅料混合过程是保证硫酸羟氯喹终产品质量的重要生产阶段。本研究以硫酸羟氯喹为研究对象,应用相关计算软件及化学计量学中的偏最小二乘回归(partial least squares regression,PLS)算法,建立监测其原辅料混合过程中硫酸羟氯喹标示百分含量的定量分析模型,以达到准确、快速判断混合终点的目的。
1 材料和方法 1.1 仪器与试剂Sartorius BT224S分析天平(德国Sartorius公司);HA-202M精密分析天平(日本A & D公司);UltiMate3000高效液相色谱仪、AntrisⅡ近红外光谱仪(美国ThermoFisher公司);硫酸羟氯喹、硬脂酸镁、滑石粉、玉米淀粉(上海上药中西制药有限公司);甲醇、乙腈(色谱纯,美国ThermoFisher公司);纯净水(杭州娃哈哈集团有限公司);磷酸(分析纯)、磷酸氯喹(质量分数98%以上)、戊烷磺酸钠(质量分数98%)均购自上海泰坦科技股份有限公司;硫酸羟氯喹对照品(质量分数98.9%,批号R052K0,美国药典委员会)。
1.2 建模样品的制备硫酸羟氯喹作为原料药,共6个批次(批号为180502、180503、180504、180405、180406、180407),辅料为硬脂酸镁、滑石粉、玉米淀粉。硫酸羟氯喹的标示百分含量为100%,硫酸羟氯喹与总辅料的比例为2.15:1,硬脂酸镁、滑石粉、玉米淀粉3种辅料的比例为1:1:1。精密称取一定量的硫酸羟氯喹和辅料,总质量为1.465 1 g,硫酸羟氯喹标示百分含量为100%时,硫酸羟氯喹原料药质量为1.000 0 g,硬脂酸镁、滑石粉、玉米淀粉的质量均为0.155 0 g。分别制备硫酸羟氯喹标示百分含量为70%、75%、80%、85%、90%、95%、100%、105%、110%、115%、120%、125%、130%的样品,在小烧杯中混合均匀。对于70%、75%、80%、120%、125%、130%的标示百分含量,每个标示百分含量下制备3份样品;对于85%、90%、95%、100%、105%、110%、115%的标示百分含量,每个标示百分含量下制备6份样品。共制得60份样品,每份样品所用原料药的批次随机。
1.3 样品光谱的采集用AntrisⅡ近红外反射光谱仪采集样品的漫反射光谱,采样波段为4 000~12 000 cm-1,分辨率为8 cm-1,增益值为2×,扫描次数为64次,每隔1 h进行1次背景光谱的采集,每个样品进行5次光谱采集,下次光谱采集前将样品杯反复倒置1次。以每个样品的平均光谱作为建模所用光谱(图 1)。

|
图 1 建模用样品近红外光谱的采集 Fig 1 Sample near-infrared spectrums |
1.4 在线混合光谱的采集
向石英培养皿中加入14.650 0 g标示百分含量为100%的正常样品和标示百分含量为80%和120%的异常样品,然后手动搅拌混合,搅拌的同时采集NIRS,大约每隔10 s采集1张光谱。每个标示百分含量下制备3份混合样品,每份样品所用硫酸羟氯喹的批次随机。光谱采集条件:采集波段为4 000~12 000 cm-1,分辨率为8 cm-1,增益值为2×,扫描次数为4次。每份样品的混合时间约20 min,采集121张光谱。标示百分含量为100%样品的混合过程中采集的前10条光谱如图 2所示。
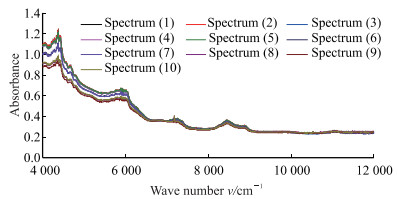
|
图 2 标示百分含量为100%样品原辅料混合过程中采集的近红外光谱 Fig 2 Near-infrared spectrums collected during the mixing process of raw materials with a labeling percentage of 100% |
1.5 硫酸羟氯喹含量的测定
用HPLC测定样品中硫酸羟氯喹的含量[13]。色谱柱为Thermo C18(4.6 mm×250 mm,5 μm)柱,流动相为甲醇:乙腈:0.25%磷酸水溶液(90:120:790),并向800 mL 0.25%磷酸水溶液中加入96 mg戊烷磺酸钠。流速为1 mL/min,进样量为20 μL,检测波长为343 nm,柱温为25 ℃。
采集121条混合物光谱后,取表面皿的中心点及对角线上4个点的样品按照1.3项下方法采集NIRS,导入建立的近红外定量分析模型,预测所取样品中原料药的标示百分含量。取表面皿的中心点及对角线上4个点的样品按照上述色谱条件测定所取样品中原料药的标示百分含量。
1.6 样本集的划分采用含量梯度法将样本集划分为校正集和验证集[14]。硫酸羟氯喹不同标示百分含量下含有的样品数不同,对于含有3份样品的百分梯度从中抽取1份划入验证集,含有6份样品的百分梯度从中抽取2份划入验证集,其余划入校正集。这种划分方式既保证了校正集和验证集分布的均匀性,又保证了验证集能够均匀地分布在校正集中,有利于近红外模型的建立。
1.7 建模波段的选择图 3为硫酸羟氯喹、硬脂酸镁、滑石粉、玉米淀粉及原辅料混合物的NIRS,从图中可以看出3种辅料均有很强的近红外吸收。用建立的近红外定量分析模型对混合过程中硫酸羟氯喹的标示百分含量进行监测,辅料的近红外吸收会干扰模型对硫酸羟氯喹含量的测定。因此,建模所用波段应尽可能排除辅料光谱对硫酸羟氯喹光谱的影响。由图 3可知,在波段8 372~9 045 cm-1、5 616~6 058 cm-1内主要是硫酸羟氯喹的吸收,分别用这2个波段建模,考察所建模型的校正误差均方根(root mean square error of calibration,RMSEC)、预测误差均方根(root mean square error of prediction,RMSEP)、交互验证的校正误差均方根(root mean square error of cross-validation,RMSECV),以及其校正集相关系数(Rc)、验证集相关系数(Rp)、交互验证相关系数(Rcv)。

|
图 3 硫酸羟氯喹原料、辅料和原辅料混合物的近红外光谱 Fig 3 Near-infrared spectrums of hydroxychloroquine sulfate raw materials, excipients and mixture of both |
1.8 光谱预处理
NIRS不仅包含化学信号,而且含有物理信号和噪声,模型建立之前对NIRS进行预处理可以增加所建模型的稳健性。对光谱进行多元散射校正(multiplicative scatter correction,MSC)或者标准正则变换(standard normal variate transformation,SNV)处理可以降低物理因素对NIRS的影响。运用一阶求导(1st derivative)或者二阶求导(2nd derivative)结合Savitzky-Golay(S-G)平滑滤波或者Norris平滑滤波对光谱进行处理可以增强光谱信号,滤除光谱噪声。以模型的RMSEC、RMSECV及其相关系数Rc、Rcv作为评价指标,选择较好的光谱预处理方式[15]。建模所用主因子数采用交互验证法选取,以预测残差平方和(prediction residual error sum of square,PRESS)为判定依据[15]。
2 结果 2.1 近红外定量分析模型的建立运用TQ Analyst 9.5软件结合PLS算法建立近红外定量分析模型。建模波段为8 372~9 045 cm-1、5 616~6 058 cm-1(表 1)。根据模型的RMSEC、RMSECV及其相关系数Rc、Rcv选择光谱的预处理方式(表 2)。模型的RMSEP越小说明模型的预测结果越准确[15]。本研究建立的近红外定量分析模型选择SNV、一阶导数及Norris平滑的光谱预处理方式。在主因子的选择中,PRESS越小说明模型的预测能力越好,根据PRESS图(图 4)建立模型选择主因子数为5。所建模型的RMSEC为0.96,Rc为0.998;RMSEP为0.97,Rp为0.998;RMSECV为1.56,Rcv为0.995。见图 5。
|
|
表 1 建模波段的选择 Tab 1 Selection of modeling spectral band |
|
|
表 2 光谱预处理方式的选择 Tab 2 Selection of spectral pretreatment methods |
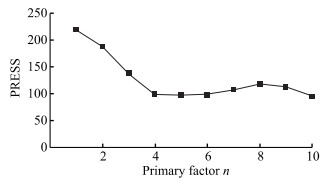
|
图 4 模型的预测残差平方和(PRESS)图 Fig 4 Prediction residual error sum of square (PRESS) diagram of the model |
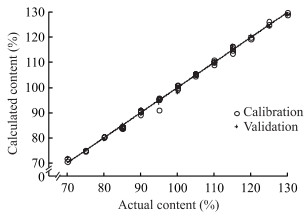
|
图 5 硫酸羟氯喹含量近红外定量分析模型 Fig 5 Near-infrared quantitative analysis model of hydroxychloroquine sulfate content |
2.2 在线混合过程中硫酸羟氯喹含量变化
运用所建立的近红外定量分析模型预测1.4项中硫酸羟氯喹的含量。硫酸羟氯喹的含量变化如图 6所示。在混合初期硫酸羟氯喹的含量变化比较明显,经过一定时间混合后硫酸羟氯喹的含量在一定范围内有小的波动。标示百分含量为100%的3份样品预测结果分别为98.70%~106.05%、97.44%~106.02%、102.83%~108.87%,相对标准偏差(relative standard deviation,RSD)分别为1.81%、2.13%、1.95%;标示百分含量为80%的3份样品的预测结果分别为75.09%~86.90%、81.32%~88.42%、79.75%~87.91%,RSD分别为3.47%、2.81%、2.91%;标示百分含量为120%的3份样品的预测结果分别为118.18%~124.79%、115.94%~123.44%、117.46~123.31%,RSD分别为1.60%、1.56%、1.73%,以上均是混合过程中采集的最后21条光谱的预测结果。根据美国注射药物协会(Parenteral Drug Association,PDA)第25号技术报告《混合均匀度分析:验证和流程测试》,如果测得原料药的百分含量为理论百分含量的90%~110%,RSD小于5%,则认为混合物已经混合均匀[16],因此9份样品均已混合均匀。

|
图 6 不同标示百分含量样品在混合过程中硫酸羟氯喹含量的预测结果 Fig 6 Predicted results of hydroxychloroquine sulfate content in different labeling percentage samples during blending process of raw and auxiliary matrials API: Active pharmaceutical ingredient |
2.3 混合均匀度的验证
分别计算1.5项下每次混合完成后预测平均值与参考平均值的偏差的绝对值、预测值的RSD及参考值的RSD。从表 3~5中的分析结果可知,每份混合物中所取样品的预测值的RSD和参考值的RSD均小于5%,因此各批次的样品均混合均匀[17]。结果说明所建立的近红外定量分析模型能比较准确地预测硫酸羟氯喹原辅料混合过程中原料药的标示百分含量,正确指示混合终点。
|
|
表 3 标示百分含量为80%的样品的验证结果 Tab 3 Verification results for the labeling percentage 80% sample |
|
|
表 4 标示百分含量为100%的样品的验证结果 Tab 4 Verification results for the labeling percentage 100% sample |
|
|
表 5 标示百分含量为120%的样品的验证结果 Tab 5 Verification results for the labeling percentage 120% sample |
3 讨论
本研究采用NIRS分析技术监测硫酸羟氯喹原辅料的混合过程,建立近红外定量分析模型。使用近红外定量分析模型预测混合过程中硫酸羟氯喹的标示百分含量,HPLC的验证结果表明所建立的近红外模型能够比较准确地测定原辅料混合过程硫酸羟氯喹的标示百分含量、监测硫酸羟氯喹原辅料的混合过程,准确指示混合终点。
本研究在样品制备过程中选择6个批次的硫酸羟氯喹原料药进行建模,因为不同批次的原料药之间会存在批间差异,使用单一批次的原料药进行建模不能涵盖原料药之前存在的批间差异,使用多个批次的原料药建模可以增加模型的稳健性。
本研究建立模型所用硫酸羟氯喹的标示百分含量为70%~130%,并选择硫酸羟氯喹标示百分含量为80%、100%、120%的原辅料混合物验证模型的预测准确性[18]。选择的80%、100%、120%标示百分含量分别处于建模所用样品含量范围的低、中、高3部分,可使验证样品的浓度范围能在建模样品浓度范围内尽量扩大。预测结果及验证结果说明所建近红外定量分析模型对于建模范围内的样品有较好的预测准确性。
本研究是在实验室开展的模拟生产过程的实验,实验结果说明所建立的近红外定量分析模型应用于实际生产过程中监测硫酸羟氯喹原辅料混合均匀度是可行的。但是实际生产过程与实验室的模拟实验还有一定差别,若用于制药工业生产还需要根据生产设备和生产环境开展进一步研究。
| [1] |
MOMOSE W, IMAI K, YOKOTA S, YONEMOCHI E, TERADA K. Process analytical technology applied for end-point detection of pharmaceutical blending by combining two calibration-free methods:simultaneously monitoring specific near-infrared peak intensity and moving block standard deviation[J]. Powder Technol, 2011, 210: 122-131. DOI:10.1016/j.powtec.2011.03.005 |
| [2] |
国家食品药品监督管理局药品认证管理中心. GMP实施指南:口服固体制剂[M]. 北京: 中国医药科技出版社, 2011: 255.
|
| [3] |
SULUB Y, KONIGSBERGER M, CHENEY J. Blend uniformity end-point determination using near-infrared spectroscopy and multivariate calibration[J]. J Pharm Biomed Anal, 2011, 55: 429-434. DOI:10.1016/j.jpba.2011.02.017 |
| [4] |
PRESCOTT J K, GARCIA T P. A solid dosage and blend content uniformity troubleshooting diagram[J]. Pharm Technol, 2001, 25: 68-88. |
| [5] |
EL-HAGRASY A S, DELGADO-LOPEZ M, DRENNEN J K Ⅲ. A process analytical technology approach to near-infrared process control of pharmaceutical powder blending. Part Ⅱ:qualitative near-infrared models for prediction of blend homogeneity[J]. J Pharm Sci, 2006, 95: 407-421. DOI:10.1002/jps.20466 |
| [6] |
SEKULIC S S, WARD H W, BRANNEGAN D R, STANLEY E D, EVANS C L, SCIAVOLINO S T, et al. On-line monitoring of powder blend homogeneity by near-infrared spectroscopy[J]. Anal Chem, 1996, 68: 509-513. DOI:10.1021/ac950964m |
| [7] |
徐广通, 袁洪福. 现代近红外光谱技术及应用进展[J]. 光谱学与光谱分析, 2000, 20: 134-142. DOI:10.3321/j.issn:1000-0593.2000.02.003 |
| [8] |
FDA. Guidance for industry PAT-a framework for innovative pharmaceutical development, manufacturing and quality assurance[EB/OL].[2018-12-15]. https: //www.fda.gov/media/71012/download.
|
| [9] |
SULUB Y, WABUYELE B, GARGIULO P, PAZDAN J, CHENEY J, BERRY J, et al. Real-time on-line blend uniformity monitoring using near-infrared reflectance spectrometry:a noninvasive off-line calibration approach[J]. J Pharm Biomed Anal, 2009, 49: 48-54. DOI:10.1016/j.jpba.2008.10.001 |
| [10] |
魏薇, 何金昌, 余素君. 羟氯喹治疗系统性红斑狼疮的效果评析[J]. 当代医药论丛, 2017, 15: 138-139. |
| [11] |
王文灵. 硫酸羟氯喹治疗风湿病的临床效果研究[J]. 中国现代药物应用, 2016, 10: 138-139. |
| [12] |
年秀玲. 类风湿性关节炎应用硫酸羟氯喹治疗的安全性和疗效探析[J]. 北方药学, 2016, 13: 145. |
| [13] |
The United States Pharmacopeial Convention. United States Pharmacopoeia[S/OL]. (2017-05)[2018-12-15]. https://www.drugfuture.com/standard/index.html.
|
| [14] |
韩海帆, 张路, 张淹, 李文龙, 瞿海斌. 阿胶化皮过程总氮含量的快速测定以及化皮过程终点判断方法[J]. 中国中药杂志, 2014, 39: 1043-1047. |
| [15] |
储小立. 近红外光谱分析技术实用手册[M]. 北京: 机械工业出版社, 2016: 122-129.
|
| [16] |
BERMAN J, ELINSKI D E, GONZALES C R, HOFER J D, JIMENEZ P J, PLANCHARD J A, et al. Blend uniformity analysis:validation and in-process testing. Technical Report No. 25. PDA (Parenteral Drug association)[J]. PDA J Pharm Sci Technol, 1997, 51(Suppl): 3i-iii, s1-s99. |
| [17] |
王斐, 姜玮, 张惠, 聂磊, 臧恒昌. 注射用美洛西林钠舒巴坦钠药物混合过程在线混合均匀度的近红外光谱监测[J]. 中国医药工业杂志, 2015, 46: 1100-1104. |
| [18] |
VARGAS J M, ROMAN-OSPINO A D, SANCHEZ E, ROMAÑACH R J. Evaluation of analytical and sampling errors in the prediction of the active pharmaceutical ingredient concentration in blends from a continuous manufacturing process[J]. J Pharm Innov, 2017, 12: 155-167. DOI:10.1007/s12247-017-9273-1 |
 2019, Vol. 40
2019, Vol. 40


