2. 海军军医大学(第二军医大学)国家肝癌科学中心, 上海 200438;
3. 海军军医大学(第二军医大学)东方肝胆外科医院肝外二科, 上海 200438
2. National Center for Liver Cancer, Naval Medical University(Second Military Medical University), Shanghai 200438, China;
3. Department of Hepatic Surgery(Ⅱ), Eastern Hepatobiliary Surgery Hospital, Naval Medical University(Second Military Medical University), Shanghai 200438, China
肝细胞癌(hepatocellular carcinoma,HCC)是最常见的恶性肿瘤之一,位列世界肿瘤死因的第3位[1]。目前抗HCC药物研究多集中于晚期HCC的化学治疗药物,包括索拉非尼、乐伐替尼、瑞戈非尼、卡博替尼等多激酶抑制剂。这些药物先后被批准用于HCC的临床靶向治疗,但治疗效果仍有待提高。HCC的发生往往是从肝炎、肝硬化到HCC的多步骤、多阶段逐级演变的复杂过程,利用药物阻断该过程,有望成为有效的HCC防治手段。然而,目前HCC预防性药物研究少有报道。
药物重定位即发现药物的新适应证,是新药研发的一种重要策略[2]。利用该策略发现二甲双胍可激活HCC细胞中的蛋白激酶,从而抑制细胞增殖,降低其体内成瘤能力[3];维生素C也被证明具有较好的抗HCC效果,并能特异性杀伤HCC干细胞[4]。表达谱比较分析已被广泛用于药物重定位研究,并取得较大成功,例如将抗溃疡药西咪替丁重定位于HCC治疗,肿瘤缩小程度几乎与化学治疗药物多柔比星相当[5]。该方法也被用于筛选抗HCC药物,研究发现杀螺胺乙醇胺盐通过抑制细胞分裂周期蛋白37(cell division cycle 37,CDC37)信号通路杀伤肿瘤细胞[6]。目前尚无应用药物重定位策略筛选HCC预防性药物的研究。
网络集成式细胞内特征公共数据库(Library of Integrated Network-based Cellular Signatures,LINCS;http://www.lincsproject.org/LINCS/)计划[7]是在细胞水平上开发药物特征生物学标签,通过细胞表型的动态变化反映药物作用机制,目前已在多种细胞系上完成超过万种小分子化合物作用的基因表达谱。本研究通过比较肝硬化到早期HCC的不同进展阶段和药物作用的表达谱,从化合物库中筛选具有预防HCC活性的药物,并对其作用机制进行探索。
1 材料和方法 1.1 癌前不同疾病阶段肝组织基因表达谱收集与分析分别用“cirrhosis”和“hepatocellular carcinoma”作为关键词,从GEO数据库(https://www.ncbi.nlm.nih.gov/geo/)中搜索HCC相关表达谱数据,并在结果中选取包含肝硬化到早期HCC不同进展阶段的表达谱(accession number:GSE6764)。该数据集包含正常肝、肝硬化、低度不典型结节(low-grade dysplastic nodule,LGDN)、高度不典型结节(high-grade dysplastic nodule,HGDN)、早期HCC和晚期HCC等不同进展阶段的75例肝组织样本。下载其原始数据(cel文件),并用R语言affy软件包的Robust Multi-Array Average(RMA)算法进行预处理。本研究重点关注肝硬化、LGDN、HGDN和早期HCC阶段,用贝叶斯算法计算这4个相邻阶段的差异表达基因,并按计算出的P值各选取上调和下调的前300个基因作为疾病阶段的特征基因。
1.2 作用于人肝癌细胞系HepG2的药物与小分子作用基因表达谱分析下载LINCS计划中level4数据,用R语言cmapR-master软件包解析gctx文件,提取其中作用于HepG2细胞的表达谱18 239个,涉及3 927种药物和小分子化合物,将同种化合物表达谱合并,计算药物作用后基因的表达变化。
1.3 利用基因集富集分析(gene set enrichment analysis,GSEA)算法筛选预防HCC候选药物用GSEA算法加权模式计算3组特征基因与药物作用表达谱的富集分数(enrichment score,ES)。首先计算上调特征基因的富集分数(ESup),然后计算下调特征基因的富集分数(ESdn),最终ES计算公式为ES=(ESup-ESdn)/2。为了计算ES显著性,随机打乱药物作用表达谱顺序并计算特征基因与随机顺序的ES’,该过程重复1 000次,统计随机过程中ES’高于ES的次数(记为N),则ES对应的P值为N/1 000,选择其中与疾病进展阶段表达谱呈负相关的药物(ES<-0.15,P<0.05)。
1.4 预防HCC候选药物作用基因相互作用网络与通路富集分析以1.5倍变化作为阈值筛选HCC候选预防药物影响基因,并取其交集,整合KEGG(Kyoto Encyclopedia of Genes and Genomes)基因调控网络和蛋白相互作用网络[8],以计算出的候选药物显著影响基因作为“种子”基因构建候选药物的作用网络,确定其中的关键节点。使用R语言clusterProfiler软件包[9]进行通路富集分析。
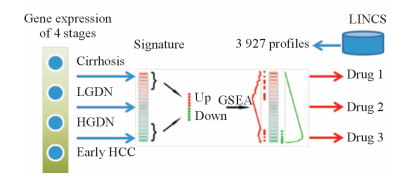
2 结果 2.1 数据预处理首先确定肝硬化到早期HCC不同进展阶段的特征基因,分析过程如图 1所示。C-L、L-H和H-E分别代表肝硬化到LGDN、LGDN到HGDN、HGDN到早期HCC进展阶段,各提取显著上调和下调的前300个基因作为特征基因。提取LINCS中3 927种药物的表达谱,用GSEA算法计算其与疾病进展特征的相似性。
|
图 1 数据分析过程示意图 Fig 1 Scheme of data analysis LGDN: Low-grade dysplastic nodule; HGDN: High-grade dysplastic nodule; HCC: Hepatocellular carcinoma; GSEA: Gene set enrichment analysis; LINCS: Library of Integrated Network-based Cellular Signatures. Drug 1, drug 2 and drug 3 represent the predicted drugs |
2.2 预防HCC候选药物筛选
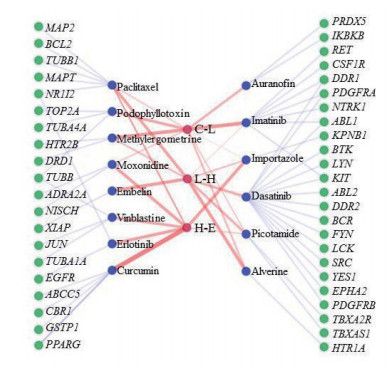
我们发现有4种、5种和7种药物可分别用于C-L、L-H和H-E阶段的治疗(表 1),进一步从DrugBank数据库(http://www.drugbank.ca/)中确定这些药物作用的靶标有44个,包括表皮生长因子受体(epidermal growth factor receptor,EGFR)、Jun原癌基因(Jun proto-oncogene,JUN;AP-1 transcription factor subunit)和SRC原癌基因(SRC proto-oncogene,SRC;non-receptor tyrosine kinase)等重要癌基因。3个进展阶段、预测药物和作用靶标关联网络如图 2所示。其中部分药物已被报道具有抗HCC和其他肿瘤活性作用,如姜黄素可以通过抗HCC病毒、抗氧自由基和其他有毒物质,在HCC癌前阶段发挥肝脏保护作用[10],同时姜黄素还可调节细胞自噬,在HCC的发展过程中达到抗HCC效果[11],美国国立肿瘤研究所已将其列为第3代癌症化学预防药。蒽贝素是一种X连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis,XIAP)的小分子抑制剂,研究发现蒽贝素可通过阻断核因子κB(nuclear factor κB,NF-κB)信号通路抑制HCC细胞增殖[12]。这些结果表明本研究所用方法的有效性。本研究发现入核受体抑制剂importazole、吡考他胺和紫杉醇这3种药物除了阻断本阶段疾病外(ES<-0.15),对另外2个阶段也有一定的阻断作用(ES<-0.1)。
|
|
表 1 HCC不同进展阶段的预测药物 Tab 1 Drugs predicted for HCC with different stages |
|
图 2 疾病阶段(红色节点)、预测药物(蓝色节点)和靶标(绿色节点)关联网络 Fig 2 Association network of disease stages (red nodes), predicted drugs (blue nodes) and their targets (green nodes) Different disease stages and the drugs were connected by red lines, and the width represents the degree of negative correlation. C: Cirrhosis; L: Low-grade dysplastic nodule; H: High-grade dysplastic nodule; E: Early hepatocellular carcinoma |
2.3 3种预防HCC候选药物作用机制探索
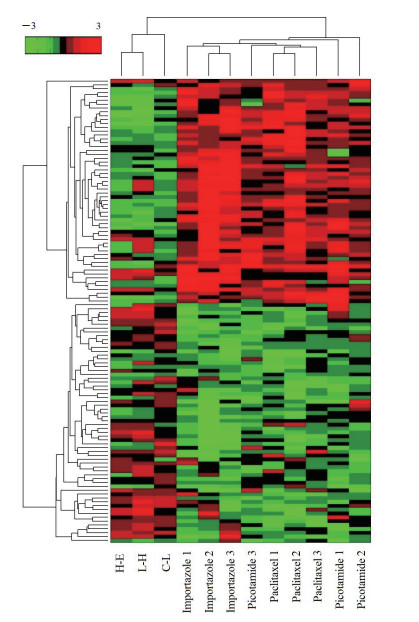
共得到120个显著差异表达基因,其中62个上调、58个下调,其热图如图 3所示。从图中可以看出3种药物(importazole、吡考他胺、紫杉醇)作用模式相似,且与肝硬化到早期HCC的不同进展阶段基因表达模式呈负相关,从转录水平证明了这3种药物对肝硬化到早期HCC的进展有阻碍作用。
|
图 3 HCC不同进展阶段和3种药物表达谱热图 Fig 3 Heatmap of gene expression profiles of HCC with different stages and 3 drugs There are 3 samples for each of the 3 drugs including importazole, picotamide and paclitaxel, which are labeled as 1, 2 and 3. HCC: Hepatocellular carcinoma; C: Cirrhosis; L: Low-grade dysplastic nodule; H: High-grade dysplastic nodule; E: Early hepatocellular carcinoma |
2.4 药物作用网络与功能富集分析
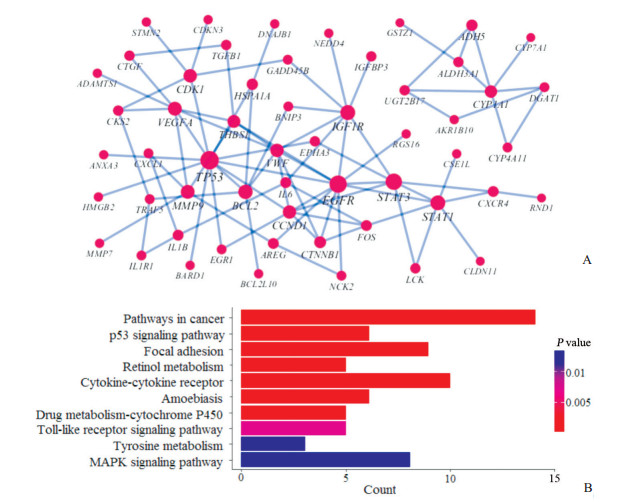
将KEGG基因调控网络和蛋白相互作用网络整合,最终得到包含12 906个基因、49 584个相互作用关系的背景网络。以120个显著差异表达的基因作为“种子”构建药物激活子网,如图 4A所示。为了确定网络中的核心分子,本研究计算了网络中基因的连接度,筛选了连接度>10的枢纽基因,分别是肿瘤蛋白P53(tumor protein P53,TP53)、EGFR、信号转导和转录激活因子(signal transducer and activator of transcription 3,STAT3)、胰岛素样生长因子1受体(insulin-like growth factor 1 receptor,IGF1R)和BCL-2,提示这些基因在药物作用中发挥重要作用。对3种药物(importazole、吡考他胺、紫杉醇)影响的基因进行通路富集分析,发现10条通路显著富集(P<0.01),其中最显著的5条通路分别是肿瘤相关通路、p53信号通路、黏附斑、视黄醇代谢及细胞因子-受体相互作用,提示这3种药物可能通过这些通路发挥预防HCC的作用。
|
图 4 差异表达基因的相互作用网络(A)和通路富集分析(B) Fig 4 Interaction network (A) and pathway enrichment analysis (B) of the differentially expressed genes |
3 讨论
与传统的药物研发策略相比,药物重定位具有成本低、研究周期短、风险小等优势,目前成功进行重定位的药物已超过100种,近年重定位类药物占美国食品药品管理局(Food and Drug Administration,FDA)所有新批准药物的30%[13]。目前抗HCC药物的研发多针对晚期HCC,以期延长患者的生存时间;临床和基础研究的数据表明HCC预防和早期干预同样重要,并有望获得更好的临床和经济效益[14]。本研究关注肝硬化到早期HCC的不同进展阶段,首次利用药物重定位策略,通过转录组比较方法从3 927种化合物中筛选出阻断HCC癌前不同进展阶段的药物,部分药物已被证明具有抗HCC或抗其他肿瘤的作用,如紫杉醇[15]、姜黄素[11]、蒽贝素[12]、达沙替尼[16]和厄洛替尼[17]等。
本研究发现importazole、吡考他胺和紫杉醇对HCC癌前不同进展阶段均有一定阻断作用,其中importazole和紫杉醇已被证明具有抑制HCC细胞增殖的作用[18-19]。吡考他胺是一种新型的血小板抑制剂,用于预防和治疗血栓栓塞性疾病,其抗癌活性尚未见报道。血小板是血管稳态的重要效应因子,有研究表明阿司匹林和氯吡格雷在乙型肝炎病毒相关急、慢性肝病中发挥重要作用,可改善HCC患者预后[20],本研究结果提示吡考他胺对HCC有预防作用。本研究用网络药理学方法构建了药物作用网络,发现importazole、吡考他胺和紫杉醇可以影响多个在HCC发生、发展过程中发挥重要功能的基因,包括TP53、EGFR、STAT3、IGF1R和BCL-2等,并通过p53信号通路、黏附斑、视黄醇代谢及细胞因子-受体相互作用等通路发挥作用。
综上所述,本研究整合了LINCS、DrugBank数据库及基因相互作用网络等多个数据库,综合运用药物重定位和网络药理学的方法,确定了3种HCC预防性药物(importazole、吡考他胺和紫杉醇),特别提示抗血小板治疗在预防HCC发生中的可能作用,为后续研究提供了线索。
| [1] |
CHEN W, ZHENG R, BAADE P D, ZHANG S, ZENG H, BRAY F, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66: 115-132. DOI:10.3322/caac.21338 |
| [2] |
JIN G, WONG S T. Toward better drug repositioning: prioritizing and integrating existing methods into efficient pipelines[J]. Drug Discov Today, 2014, 19: 637-644. DOI:10.1016/j.drudis.2013.11.005 |
| [3] |
ZHENG L, YANG W, WU F, WANG C, YU L, TANG L, et al. Prognostic significance of AMPK activation and therapeutic effects of metformin in hepatocellular carcinoma[J]. Clin Cancer Res, 2013, 19: 5372-5380. DOI:10.1158/1078-0432.CCR-13-0203 |
| [4] |
LV H, WANG C, FANG T, LI T, LV G, HAN Q, et al. Vitamin C preferentially kills cancer stem cells in hepatocellular carcinoma via SVCT-2[J/OL]. NPJ Precis Oncol, 2018, 2: 1. doi: 10.1038/s41698-017-0044-8.
|
| [5] |
SIROTA M, DUDLEY J T, KIM J, CHIANG A P, MORGAN A A, SWEET-CORDERO A, et al. Discovery and preclinical validation of drug indications using compendia of public gene expression data[J/OL]. Sci Transl Med, 2011, 3: 96ra77. doi: 10.1126/scitranslmed.3001318.
|
| [6] |
CHEN B, WEI W, MA L, YANG B, GILL R M, CHUA M S, et al. Computational discovery of niclosamide ethanolamine, a repurposed drug candidate that reduces growth of hepatocellular carcinoma cells in vitro and in mice by inhibiting cell division cycle 37 signaling[J]. Gastroenterology, 2017, 152: 2022-2036. DOI:10.1053/j.gastro.2017.02.039 |
| [7] |
CORSELLO S M, BITTKER J A, LIU Z, GOULD J, MCCARREN P, HIRSCHMAN J E, et al. The Drug Repurposing Hub: a next-generation drug library and information resource[J]. Nat Med, 2017, 23: 405-408. DOI:10.1038/nm.4306 |
| [8] |
KESHAVA PRASAD T S, GOEL R, KANDASAMY K, KEERTHIKUMAR S, KUMAR S, MATHIVANAN S, et al. Human Protein Reference Database—2009 update[J]. Nucleic Acids Res, 2009, 37(Database issue): D767-D772. |
| [9] |
YU G, WANG L G, HAN Y, HE Q Y. clusterProfiler: an R package for comparing biological themes among gene clusters[J]. OMICS, 2012, 16: 284-287. DOI:10.1089/omi.2011.0118 |
| [10] |
AFRIN R, ARUMUGAM S, RAHMAN A, WAHED M I, KARUPPAGOUNDER V, HARIMA M, et al. Curcumin ameliorates liver damage and progression of NASH in NASH-HCC mouse model possibly by modulating HMGB1-NF-κB translocation[J]. Int Immunopharmacol, 2017, 44: 174-182. DOI:10.1016/j.intimp.2017.01.016 |
| [11] |
尹煜鹏, 孙树汉. 姜黄素诱导人肝癌细胞系Huh7自噬和凋亡[J]. 第二军医大学学报, 2019, 40: 38-42. YIN Y P, SUN S H. Curcumin inducing autophagy and apoptosis of human hepatocarcinoma cell line Huh7[J]. Acad J Sec Mil Med Univ, 2019, 40: 38-42. |
| [12] |
王世兵, 雷文, 徐燕华, 郭科妮, 王毅刚. 蒽贝素(Embelin)通过阻断NF-κB信号通路抑制肝癌细胞Bel-7404生长的研究[J]. 生物化学与生物物理进展, 2012, 12: 161-167. |
| [13] |
MULLARD A. 2014 FDA drug approvals[J]. Nat Rev Drug Discov, 2015, 14: 77-81. DOI:10.1038/nrd4545 |
| [14] |
NAKAGAWA S, WEI L, SONG W M, HIGASHI T, GHOSHAL S, KIM R S, et al. Molecular liver cancer prevention in cirrhosis by organ transcriptome analysis and lysophosphatidic acid pathway inhibition[J]. Cancer Cell, 2016, 30: 879-890. DOI:10.1016/j.ccell.2016.11.004 |
| [15] |
JIN C, BAI L, LIN L, WANG S, YIN X. Paclitaxel-loaded nanoparticles decorated with bivalent fragment HAb18 F(ab')2 and cell penetrating peptide for improved therapeutic effect on hepatocellular carcinoma[J]. Artif Cells Nanomed Biotechnol, 2018, 46: 1076-1084. DOI:10.1080/21691401.2017.1360325 |
| [16] |
HEKIM C, ILANDER M, YAN J, MICHAUD E, SMYKLA R, VÄHÄ-KOSKELA M, et al. Dasatinib changes immune cell profiles concomitant with reduced tumor growth in several murine solid tumor models[J]. Cancer Immunol Res, 2017, 5: 157-169. DOI:10.1158/2326-6066.CIR-16-0061-T |
| [17] |
TANI T, NAOKI K, YASUDA H, ARAI D, ISHIOKA K, OHGINO K, et al. A phase Ⅱ trial of induction of erlotinib followed by cytotoxic chemotherapy for EGFR mutation-positive non-squamous non-small cell lung cancer patients[J/OL]. Cancer Chemother Pharmacol, 2019. doi: 10.1007/s00280-019-03934-y.
|
| [18] |
SODERHOLM J F, BIRD S L, KALAB P, SAMPATHKUMAR Y, HASEGAWA K, UEHARA-BINGEN M, et al. Importazole, a small molecule inhibitor of the transport receptor importin-β[J]. ACS Chem Biol, 2011, 6: 700-708. DOI:10.1021/cb2000296 |
| [19] |
WANG T H, WANG H S, SOONG Y K. Paclitaxel-induced cell death: where the cell cycle and apoptosis come together[J]. Cancer, 2000, 88: 2619-2628. DOI:10.1002/1097-0142(20000601)88:11<2619::AID-CNCR26>3.0.CO;2-J |
| [20] |
AIOLFI R, SITIA G. Emerging role of dual antiplatelet therapy in the prevention of hepatitis B virus-associated hepatocellular carcinoma[J]. J Hepatocell Carcinoma, 2014, 1: 183-186. |
 2019, Vol. 40
2019, Vol. 40


