呼吸系统并发症是急性脊髓损伤(acute spinal cord injury,ASCI)后最常见的并发症及引起死亡的主要原因[1-2]。本课题组前期研究发现大鼠发生ASCI后会继发肺损伤、肺水肿等病理变化,但具体机制尚不明确[3]。肺C类神经纤维(pulmonary C-fiber,PCF)约占肺迷走神经的75%[4],PCF上的瞬时受体电位香草酸1(transient receptor potential vanilloid 1,TRPV1)可被某些介质激活并释放下游神经肽P物质等发挥生物效应[5-7]。肾上腺素是肾上腺分泌的主要激素,成年大鼠吸入肾上腺素后,通过激活肺部TRPV1,可使PCF活动明显升高[8]。TRPV1是几乎所有神经元炎症信号通路的枢纽[9],在不同原因引起的肺损伤中,TRPV1发挥了重要作用[10-11]。P物质是存在于中枢神经系统和周围神经系统中的十一肽,可通过促进血管的舒张,导致血浆外渗等加重组织损伤[12]。本研究旨在观察ASCI后肾上腺素、肺组织中TRPV1和P物质的变化,初步探讨其对ASCI继发肺损伤的意义。
1 材料和方法 1.1 主要试剂与仪器TRPV1抗体购自美国Santa Cruz公司,β-actin抗体购自英国Abcam公司,蛋白质印迹分析仪购自美国Bio-Rad公司,P物质酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒购自美国Cayman Chemical公司,高效液相色谱仪电化学检测器购自日本Shimadzu公司。
1.2 动物与分组SPF级健康雌性SD大鼠228只,7~8周龄,体质量为220~240 g,由重庆医科大学实验动物中心提供[动物使用许可证号:SYXK(渝)2017-0012]。采用随机数字表法将实验动物分为假手术组(90只)、双侧肾上腺切除组(15只)、ASCI组(108只)、双侧肾上腺切除后ASCI组(15只)。
1.3 ASCI模型制备用40 mg/kg戊巴比妥钠腹腔注射麻醉大鼠,将大鼠以俯卧位固定于操作台,常规备皮消毒。以T10 为中心,沿脊柱方向做一长约2 cm的纵向切口,依次切开皮肤、肌肉后,暴露椎板。完全去除T10 椎板,保留硬脊膜。采用改良Allen's法,将一个带有刻度的玻璃管置于暴露段脊髓作为引导,以设定强度(打击锤质量为10 g,打击高度为25 mm)打击脊髓后,立即移除打击装置。观察到大鼠脊髓迅速充血,双后肢回缩扑动,尾部卷曲、摆动,提示造模成功。将切口逐层缝合后置于加热垫上复温,待大鼠麻醉清醒后饲养于独立通风笼具内,自由饮食。ASCI组大鼠行人工按压辅助排尿,每日3次,直至恢复自主排尿。ASCI组大鼠造模过程中有4只于术后2~24 h死亡,予以及时补充。
1.4 双侧肾上腺切除模型制备术前准备同前。以肋脊角为中心,沿脊柱方向做一长约2 cm的纵向切口,依次切开皮肤、肌肉后,游离肾脏,暴露肾上腺,完全去除肾上腺。逐层缝合后置于加热垫上复温,待大鼠麻醉清醒后饲养于独立通风笼具内自由饮食。双侧肾上腺切除后ASCI组于双侧肾上腺切除5 d后制作ASCI模型。双侧肾上腺切除后ASCI组大鼠造模过程中有8只于术后2~24 h死亡,予以及时补充。
1.5 组织及标本采集在脊髓损伤后2 h、6 h、12 h、24 h、48 h、72 h、1周,分别取假手术组和ASCI组大鼠各6只,采集血液标本,离心后保存于-80℃冰箱,用于血清肾上腺素水平检测;取上述脊髓损伤后6 h、24 h、48 h、72 h、1周的假手术组和ASCI组大鼠,用于检测肺湿干质量比。在脊髓损伤后24 h、48 h、72 h、1周分别取ASCI组大鼠各3只,以及假手术组大鼠3只,用于肺组织中TRPV1蛋白检测。在脊髓损伤后6 h、24 h、48 h、72 h、1周,分别取假手术组和ASCI组大鼠各6只,用于肺组织中P物质检测。在脊髓损伤后6 h、72 h,分别取假手术组、ASCI组、双侧肾上腺切除组、双侧肾上腺切除后ASCI组大鼠各6只,用于检测肺湿干质量比。在脊髓损伤后24 h、48 h、72 h、1周分别取ASCI组大鼠各3只,在脊髓损伤后72 h分别取假手术组、双侧肾上腺切除组、双侧肾上腺切除后ASCI组大鼠各3只,用于肺组织H-E染色;取上述假手术组和脊髓损伤后24 h、48 h、72 h、1周的ASCI组大鼠,用于肺组织免疫组织化学染色。
1.6 各指标检测 1.6.1 高效液相色谱法[13]检测肾上腺素水平取大鼠腹主动脉血液2 mL于EDTA抗凝管中,离心取血清。按照高效液相色谱仪操作流程,分别检测假手术组和ASCI组大鼠脊髓损伤后2 h、6 h、12 h、24 h、48 h、72 h和1周时血清肾上腺素水平。
1.6.2 肺组织湿干质量法评估肺水肿将各组大鼠在手术后的不同时间点处死,用40 g/L多聚甲醛溶液灌注后,立即取出肺并剔除结缔组织,称量以获得肺湿质量。将肺在70℃烘箱中烘烤3 d后,再次称量以获得肺干质量。计算肺湿干质量比,评估肺水肿程度。
1.6.3 H-E染色观察肺组织损伤情况将各组大鼠用体积分数为0.9%的等渗生理盐水40 mL及40 g/L多聚甲醛溶液40 mL经心脏灌注后取出肺组织,经乙醇梯度脱水后用石蜡包埋,制备4 μm厚的组织切片,行H-E染色,在普通光学显微镜下观察肺组织病理学变化。
1.6.4 免疫组织化学法检测肺组织中TRPV1表达将制备好的石蜡切片常规脱蜡水化,用Triton X-100破膜,枸橼酸钠缓冲液修复抗原,用牛血清白蛋白封闭非特异性抗原,加入一抗4℃孵育过夜,加入二抗室温孵育1 h,二氨基联苯胺染色,苏木精复染,脱水,封片,拍照。实验重复3次。用ImageJ软件对TRPV1蛋白表达水平进行半定量分析。
1.6.5 蛋白质印迹法法检测肺组织中TRPV1的表达将大鼠处死后取肺组织,保存于液氮中备用。取出大鼠肺组织,匀浆破碎,加入裂解液提取蛋白。将高温变性后的蛋白样本加入十二烷基硫酸-聚丙烯酰胺凝胶中进行电泳,然后经湿转法电转至聚偏二氟乙烯膜上,加入50 g/L脱脂奶粉室温封闭1 h后,加TRPV1抗体(稀释比例为1:200)4℃孵育过夜。用吐温20-Tris盐缓冲液洗膜后,加入二抗室温孵育1 h,再次用吐温20-Tris盐缓冲液清洗后,加显影剂拍照。实验重复3次。用ImageJ软件分析蛋白条带的灰度值,计算目的蛋白的相对表达量。
1.6.6 ELISA法检测肺组织中P物质含量将大鼠处死后取肺组织,放入冰盐水中漂洗,剔除附属的结缔组织,称取适量组织块。按体积比1:10加入磷酸盐缓冲液,用眼科剪剪碎组织,匀浆器匀浆。以上操作均在冰上进行。将组织匀浆在4℃下以1 690×g 离心15 min,取上清分装冻存备用。按照ELISA试剂盒说明书步骤严格操作,检测P物质含量。
1.7 统计学处理应用SPSS 25.0软件进行统计学分析。满足正态分布的计量资料以x±s表示。两组数据比较采用独立样本t检验;多组数据比较采用方差分析,两两比较采用LSD检验(方差齐)、Dunnett's T3检验(方差不齐)或Dunnett's C检验(方差不齐)。检验水准(α)为0.05。
2 结果 2.1 ASCI大鼠血清肾上腺素水平变化ASCI组大鼠脊髓损伤后2、6、12、24、48、72 h血清肾上腺素水平分别为(585.72±14.56)、(1 862.15±134.96)、(2 441.96±151.27)、(2 878.41±218.23)、(455.72±75.59)、(320.56±31.03)pg/mL,均高于相应时间点的假手术组,差异均有统计学意义(P均<0.01);脊髓损伤后1周ASCI组大鼠血清肾上腺素水平为(202.17±15.87)pg/mL,与同时间点的假手术组相比差异无统计学意义(P>0.05)。脊髓损伤后不同时间点ASCI组大鼠血清肾上腺素水平差异有统计学意义(F=741.87,P<0.01);血清肾上腺素在脊髓损伤后12 h和24 h时达到较高水平,2个时间点之间差异无统计学意义(P>0.05),48 h和72 h时急剧下降,1周时接近假手术组水平。见图 1。

|
图 1 ASCI大鼠血清肾上腺素水平的变化 Fig 1 Change of serum adrenaline levels in rats with ASCI ASCI: Acute spinal cord injury. **P < 0.01 vs sham group at same time point; △△P < 0.01 vs ASCI 2 h group; ▲▲P < 0.01 vs ASCI 6 h group. n=6, x±s |
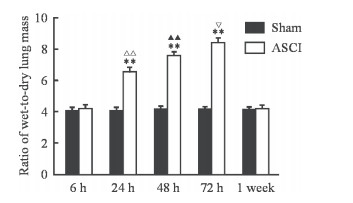
2.2 ASCI大鼠肺湿干质量比变化
假手术组大鼠各时间点肺湿干质量比稳定在4.00左右。脊髓损伤后6 h,ASCI组大鼠肺湿干质量比与同时间点假手术组相比差异无统计学意义(P>0.05);脊髓损伤后24、48、72 h,ASCI组大鼠肺湿干质量比分别为6.50±0.34、7.52±0.31、8.36±0.39,与同时间点假手术组比较差异均有统计学意义(P均<0.01);脊髓损伤后1周,ASCI组大鼠肺湿干质量比与同时间点假手术组相比差异无统计学意义(P>0.05)。脊髓损伤后不同时间点ASCI组大鼠肺湿干质量比差异有统计学意义(F=207.06,P<0.01),肺湿干质量比在脊髓损伤后24~72 h逐渐增高,脊髓损伤后1周接近假手术组水平。见图 2。
|
图 2 ASCI大鼠肺湿干质量比的变化 Fig 2 Change of wet-to-dry lung mass ratio in rats with ASCI ASCI: Acute spinal cord injury. **P < 0.01 vs sham group at same time point; △△P < 0.01 vs ASCI 6 h group; ▲▲P < 0.01 vs ASCI 24 h group; ▽P < 0.05 vs ASCI 48 h group. n=6, x±s |
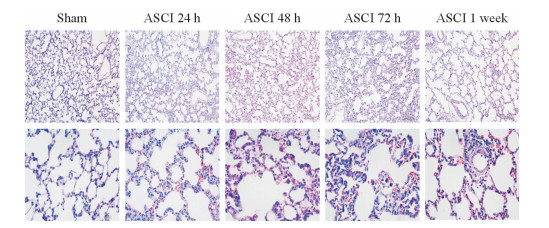
2.3 ASCI大鼠肺组织病理学变化
大鼠肺组织H-E染色结果显示,假手术组大鼠肺泡结构正常,无淤血及出血,无炎性细胞浸润。脊髓损伤后24 h,ASCI组大鼠肺泡间质有一定增宽,有出血等表现;脊髓损伤后48 h,ASCI组大鼠肺损伤进一步加重,出血增多,肺泡发生一定的融合,可见炎性细胞浸润;脊髓损伤后72 h,ASCI组大鼠肺损伤最为严重,肺泡结构紊乱、严重塌陷、融合,可见大量出血和炎性细胞浸润;脊髓损伤后1周,ASCI组大鼠肺损伤开始恢复,可见出血、炎性细胞浸润,肺泡结构基本清晰可见。见图 3。
|
图 3 ASCI大鼠肺组织病理学改变 Fig 3 Pathological changes of lung tissues in rats with ASCI ASCI: Acute spinal cord injury. H-E staining. Original magnification: ×100 (upper row), ×400 (lower row) |
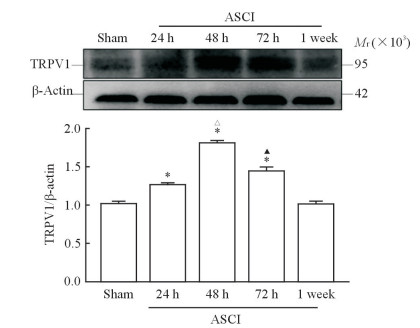
2.4 ASCI大鼠肺组织中TRPV1蛋白表达变化
免疫组织化学染色结果(图 4)显示,假手术组大鼠肺组织中TRPV1表达量较低,阳性表达主要定位于肺泡上。脊髓损伤后24~72 h,ASCI组大鼠肺组织中TRPV1蛋白表达较假手术组明显升高,表达水平分别为1.46±0.46、1.80±0.46、1.52±0.35,与假手术组(0.78±0.35)比较差异均有统计学意义(P均<0.05);脊髓损伤后1周,ASCI组大鼠肺组织中TRPV1蛋白表达(0.89±0.52)较72 h时下降,接近假手术组水平(P>0.05)。脊髓损伤后不同时间点ASCI组大鼠肺组织中TRPV1蛋白表达水平差异有统计学意义(F=102.09,P<0.01),48 h的蛋白表达量最高。蛋白质印迹分析结果(图 5)与免疫组织化学染色结果一致。

|
图 4 免疫组织化学染色检测ASCI大鼠肺组织中TRPV1蛋白的表达 Fig 4 TRPV1 protein expression in lung tissues in rats with ASCI by immunohistochemistry ASCI: Acute spinal cord injury; TRPV1: Transient receptor potential vanilloid 1. Original magnification: ×400 |
|
图 5 蛋白质印迹法检测ASCI大鼠肺组织中TRPV1蛋白的表达 Fig 5 TRPV1 protein expression in lung tissues in rats with ASCI by Western blotting ASCI: Acute spinal cord injury; TRPV1: Transient receptor potential vanilloid 1. *P < 0.05 vs sham group; △P < 0.05 vs ASCI 24 h group; ▲P < 0.05 vs ASCI 48 h group. n=3, x±s |
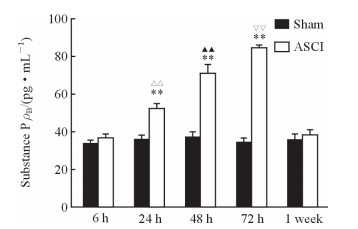
2.5 ASCI大鼠肺组织中P物质含量的变化
脊髓损伤后6 h、24 h、48 h、72 h、1周,ASCI组大鼠肺组织中P物质含量分别为(36.02±2.99)、(51.81±3.30)、(70.43±5.42)、(84.03±4.43)、(37.57±3.56)pg/mL,其中24、48、72 h均较同时间点的假手术组升高(P均<0.01),6 h、1周与同时间假手术组相比差异均无统计学意义(P均>0.05)。不同时间点ASCI组大鼠肺组织中P物质含量差异有统计学意义(F=160.78,P<0.05),脊髓损伤后24~72 h ASCI组大鼠肺组织中P物质含量逐渐升高,1周时接近假手术组水平。见图 6。
|
图 6 ASCI大鼠肺组织中P物质含量的变化 Fig 6 Change of substance P contents in lung tissues in rats with ASCI ASCI: Acute spinal cord injury. **P < 0.01 vs sham group at same time point; △△P < 0.01 vs ASCI 6 h group; ▲▲P < 0.01 vs ASCI 24 h group; ▽▽P < 0.01 vs ASCI 48 h group. n=6, x±s |
2.6 双侧肾上腺切除对ASCI大鼠肺损伤的影响
脊髓损伤后6 h,假手术组、ASCI组、双侧肾上腺切除组、双侧肾上腺切除后ASCI组大鼠肺湿干质量比差异均无统计学意义(P均>0.05)。脊髓损伤后72 h,ASCI组和双侧肾上腺切除后ASCI组大鼠肺湿干质量比均明显升高,与各组6 h时相比差异均有统计学意义(8.49±0.49 vs 4.15±0.31,P<0.01;6.23±0.32 vs 4.29±0.22,P<0.01);脊髓损伤后72 h,双侧肾上腺切除后ASCI组大鼠肺湿干质量比低于ASCI组,差异有统计学意义(P<0.01)。H-E染色结果(图 7)显示,双侧肾上腺切除组大鼠肺泡结构正常,间质无明显增宽;脊髓损伤后72 h,ASCI组大鼠肺泡结构被破坏,肺泡塌陷融合;脊髓损伤后72 h,双侧肾上腺切除后ASCI组大鼠肺泡融合、间质增宽等病理表现较ASCI组明显减轻,但仍有一定出血和炎性细胞浸润。
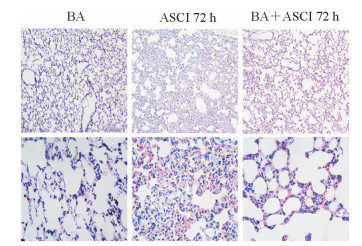
|
图 7 双侧肾上腺切除后ASCI大鼠肺组织的病理学变化 Fig 7 Pathological changes of lung tissues in rats with ASCI after bilateral adrenalectomy (BA) ASCI: Acute spinal cord injury. H-E staining. Original magnification: ×100 (upper row), ×400 (lower row) |
3 讨论
颈段脊髓损伤后发生呼吸系统并发症的可能原因是膈肌及辅助呼吸肌瘫痪,导致呼吸受限、咳嗽无效、气道内分泌物滞留,但对于低胸段脊髓(T10)损伤,这些机制显然是不充分的[3]。肾上腺素是肾上腺分泌的主要激素,是产生应激反应的重要激素,研究发现肾上腺素可能通过增加肺泡肿瘤坏死因子α加重大鼠肝脏缺血再灌注引起的肺部损伤[14]。本研究发现,大鼠ASCI后肺水肿与肺损伤组织病理学变化趋势一致,血清肾上腺素水平的变化趋势较肺水肿、肺损伤病理进程有所提前。肾上腺素的分泌可在短时间内增加心输出量,使脉压增大[15],瞬间增高的血压可能造成毛细血管内皮细胞损伤,导致红细胞外漏,但如果完全用血压瞬间升高来解释出血和损伤理由显然不够充分。我们推测在大鼠ASCI后的肺水肿、肺损伤病理进程中,肾上腺素可能作为一个上游始动因素,通过激活下游通路发挥主要作用。
在特发性鼻炎患者中,抑制鼻黏膜中TRPV1的过度表达和鼻腔分泌物中P物质水平,可明显降低炎性浸润,改善症状[16]。罗伊氏乳杆菌DSM 17938通过抑制TRPV1表达,导致下游P物质水平降低,减轻小鼠胃部损伤[17]。上述研究提示TRPV1-P物质信号轴与组织的损伤密切相关。本研究发现ASCI后大鼠肺组织TRPV1蛋白动态变化的峰值(48 h)较ASCI继发肺水肿、肺损伤病理变化的峰值(72 h)提前,但较肾上腺素水平变化的峰值(24 h)有所延迟。肾上腺素可通过作用于TRPV1活化PCF,释放神经肽P物质和降钙素基因相关肽发挥生物学效应[18-19]。我们推测肾上腺素可能作为TRPV1的上游介质调控TRPV1-P物质轴发挥作用。P物质通过增加血管通透性、蛋白外渗、肥大细胞脱颗粒等参与组织损伤进程[20]。P物质在缺血再灌注诱导的肺部损伤[21]、烧伤引起的肺损伤[22]中均起到加重损伤的作用。Jacob等[23]研究发现,P物质受体拮抗剂可有效抑制肥大细胞活化,减少炎性细胞因子和趋化因子表达,从而减轻肺损伤、肺水肿。本研究发现ASCI后肺组织P物质的表达变化与ASCI继发的肺水肿、肺损伤病理变化趋势基本一致,说明P物质可能参与了大鼠ASCI后肺水肿、肺损伤的进程。
Miller等[24]研究发现,双侧肾上腺切除后,臭氧诱导的大鼠肺部损伤明显减轻。吕向鹏等[25]研究发现,α2A-肾上腺素能受体阻断剂可明显抑制脂多糖诱导的急性肺损伤。本研究初步探索发现,在ASCI并发肺损伤、肺水肿最严重的72 h时间点,切除双侧肾上腺可减轻ASCI并发的肺损伤和肺水肿程度,进一步提示肾上腺素可能参与了大鼠ASCI后的肺水肿、肺损伤进程。
综上所述,在大鼠ASCI模型中,肾上腺素、TRPV1、P物质依次在脊髓损伤后24、48、72 h达到峰值,并且与脊髓损伤后肺损伤、肺水肿进程关系密切。我们认为肾上腺素可能参与了大鼠ASCI并发的肺水肿、肺损伤病理进程,这种效应可能与TRPV1、P物质的上调有关;双侧肾上腺切除预处理可减轻肺水肿和肺损伤病理变化。但肾上腺素是否通过直接活化TRPV1-P物质轴起作用有待进一步深入研究。
| [1] |
ROGERS W K, TODD M. Acute spinal cord injury[J]. Best Pract Res Clin Anaesthesiol, 2016, 30: 27-39. DOI:10.1016/j.bpa.2015.11.003 |
| [2] |
TOLLEFSEN E, FONDENES O. Respiratory complications associated with spinal cord injury[J]. Tidsskr Nor Laegeforen, 2012, 132: 1111-1114. DOI:10.4045/tidsskr.10.0922 |
| [3] |
HE B, NAN G. Pulmonary edema and hemorrhage after acute spinal cord injury in rats[J]. Spine J, 2016, 16: 547-551. DOI:10.1016/j.spinee.2015.11.065 |
| [4] |
AGOSTONI E, CHINNOCK J E, DE DALY M B, MURRAY J G. Functional and histological studies of the vagus nerve and its branches to the heart, lungs and abdominal viscera in the cat[J]. J Physiol, 1957, 135: 182-205. DOI:10.1113/jphysiol.1957.sp005703 |
| [5] |
TAYLOR-CLARK T E, UNDEM B J. Sensing pulmonary oxidative stress by lung vagal afferents[J]. Respir Physiol Neurobiol, 2011, 178: 406-413. DOI:10.1016/j.resp.2011.05.003 |
| [6] |
ZHUANG J, ZHAO L, ZANG N, XU F. Prenatal nicotinic exposure augments cardiorespiratory responses to activation of bronchopulmonary C-fibers[J]. Am J Physiol Lung Cell Mol Physiol, 2015, 308: L922-L930. DOI:10.1152/ajplung.00241.2014 |
| [7] |
ZHAO L, ZHUANG J, ZANG N, LIN Y, LEE L Y, XU F. Prenatal nicotinic exposure upregulates pulmonary C-fiber NK1R expression to prolong pulmonary C-fiber-mediated apneic response[J]. Toxicol Appl Pharmacol, 2016, 290: 107-115. DOI:10.1016/j.taap.2015.10.023 |
| [8] |
GU Q, LIN Y S, LEE L Y. Epinephrine enhances the sensitivity of rat vagal chemosensitive neurons: role of β3-adrenoceptor[J]. J Appl Physiol (1985), 2007, 102: 1545-1555. DOI:10.1152/japplphysiol.01010.2006 |
| [9] |
LIAO M, CAO E, JULIUS D, CHENG Y. Structure of the TRPV1 ion channel determined by electron cryo-microscopy[J]. Nature, 2013, 504: 107-112. DOI:10.1038/nature12822 |
| [10] |
WANG M, JI P, WANG R, ZHAO L, XIA Z. TRPV1 agonist capsaicin attenuates lung ischemia-reperfusion injury in rabbits[J]. J Surg Res, 2012, 173: 153-160. DOI:10.1016/j.jss.2010.08.053 |
| [11] |
LI C, BO L, LIU Q, LIU W, CHEN X, XU D, et al. Activation of TRPV1-dependent calcium oscillation exacerbates seawater inhalation-induced acute lung injury[J]. Mol Med Rep, 2016, 13: 1989-1998. DOI:10.3892/mmr.2016.4804 |
| [12] |
SUVAS S. Role of substance P neuropeptide in inflammation, wound healing, and tissue homeostasis[J]. J Immunol, 2017, 199: 1543-1552. DOI:10.4049/jimmunol.1601751 |
| [13] |
BERGH M S, BOGEN I L, ANDERSEN J M, ØIESTAD Å M L, BERG T. Determination of adrenaline, noradrenaline and corticosterone in rodent blood by ion pair reversed phase UHPLC-MS/MS[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2018, 1072: 161-172. DOI:10.1016/j.jchromb.2017.11.016 |
| [14] |
OTA S, YAZAWA T, TOJO K, BABA Y, UCHIYAMA M, GOTO T, et al. Adrenaline aggravates lung injury caused by liver ischemia-reperfusion and high-tidal-volume ventilation in rats[J/OL]. J Intensive Care, 2016, 4: 8. doi: 10.1186/s40560-016-0130-y.
|
| [15] |
BRANT J M. Breathlessness with pulmonary metastases: a multimodal approach[J]. J Adv Pract Oncol, 2013, 4: 415-422. |
| [16] |
VAN GERVEN L, ALPIZAR Y A, WOUTERS M M, HOX V, HAUBEN E, JORISSEN M, et al. Capsaicin treatment reduces nasal hyperreactivity and transient receptor potential cation channel subfamily Ⅴ, receptor 1 (TRPV1) overexpression in patients with idiopathic rhinitis[J/OL]. J Allergy Clin Immunol, 2014, 133: 1332-1339, 1339.e1-3. doi: 10.1016/j.jaci.2013.08.026.
|
| [17] |
OLIVEIRA A P, SOUZA L K M, ARAÚJO T S L, ARAÚJO S, NOGUEIRA K M, SOUSA F B M, et al. Lactobacillus reuteri DSM 17938 protects against gastric damage induced by ethanol administration in mice: role of TRPV1/substance P axis[J/OL]. Nutrients, 2019, 11. pii: E208. doi: 10.3390/nu11010208.
|
| [18] |
LEE L Y, SHUEI LIN Y, GU Q, CHUNG E, HO C Y. Functional morphology and physiological properties of bronchopulmonary C-fiber afferents[J]. Anat Rec A Discov Mol Cell Evol Biol, 2003, 270: 17-24. |
| [19] |
CHEN X, LEVINE J D. Epinephrine-induced excitation and sensitization of rat C-fiber nociceptors[J]. J Pain, 2005, 6: 439-446. DOI:10.1016/j.jpain.2005.02.004 |
| [20] |
VINK R, GABRIELIAN L, THORNTON E. The role of substance P in secondary pathophysiology after traumatic brain injury[J/OL]. Front Neurol, 2017, 8: 304. doi: 10.3389/fneur.2017.00304.
|
| [21] |
OKAYA T, HOLTHAUS R, KATO A, LENTSCH A B. Involvement of the neuropeptide substance P in lung inflammation induced by hepatic ischemia/reperfusion[J]. Inflamm Res, 2004, 53: 257-261. DOI:10.1007/s00011-004-1256-2 |
| [22] |
SIO S W, PUTHIA M K, LU J, MOOCHHALA S, BHATIA M. The neuropeptide substance P is a critical mediator of burn-induced acute lung injury[J]. J Immunol, 2008, 180: 8333-8341. DOI:10.4049/jimmunol.180.12.8333 |
| [23] |
JACOB S, DEYO D J, COX R A, JACOB R K, HERNDON D N, TRABER D L, et al. Substance P antagonist CP-96345 blocks lung vascular leakage and inflammation more effectively than its stereoisomer CP-96344 in a mouse model of smoke inhalation and burn injury[J]. Toxicol Mech Methods, 2010, 20: 197-203. DOI:10.3109/15376511003674657 |
| [24] |
MILLER D B, SNOW S J, SCHLADWEILER M C, RICHARDS J E, GHIO A J, LEDBETTER A D, et al. Acute ozone-induced pulmonary and systemic metabolic effects are diminished in adrenalectomized rats[J]. Toxicol Sci, 2016, 150: 312-322. DOI:10.1093/toxsci/kfv331 |
| [25] |
吕向鹏, 丛竹凯, 陶一凡, 李丹, 朱 |
 2019, Vol. 40
2019, Vol. 40


