胃肠道间质瘤(gastrointestinal stromal tumor,GIST)是胃肠道最常见的非上皮来源性肿瘤,全消化道中均可发生,其中十二指肠GIST发病率较低,仅占GIST的3%~5%[1]。十二指肠GIST极少突破包膜或发生淋巴结转移,因此将肿瘤完整切除、切缘阴性(距肿瘤边缘≥1 cm)、无瘤体破裂即为达到根治标准。传统术式多为胰十二指肠切除术,手术时间长、创伤大[2]。除肿瘤最大径>3 cm及系膜侧肿瘤累及血管、胰腺、壶腹部、胆管外,其余部位的十二指肠GIST均可通过局部切除或区段切除+消化道重建达到根治,目前已在临床得到一定程度的推广应用[3]。本研究回顾性分析于我院接受局部手术治疗的29例十二指肠GIST患者的临床资料,并总结诊治经验。
1 资料和方法 1.1 研究对象本研究为回顾性研究,选取2010年1月至2018年1月于我院肛肠外科行局部手术切除治疗的29例十二指肠GIST患者作为研究对象。十二指肠GIST根据术后病理确诊,组织学形态符合GIST,DOG1(高表达于GIST的一个功能未知蛋白)和CD117呈弥漫强阳性[3]。本研究通过我院医学伦理委员会审批。
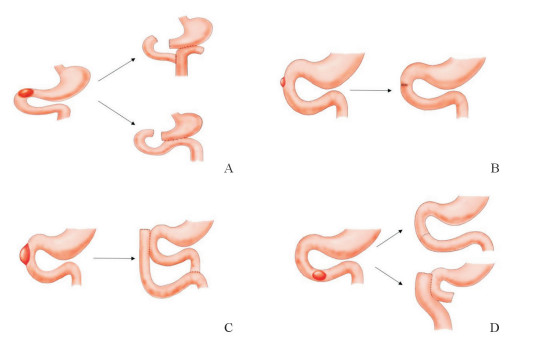
1.2 手术方法手术方式包括开腹手术和腹腔镜下手术,切除方式包括楔形切除术和节段切除术,并根据术中情况选择吻合方式。具体步骤:患者取仰卧位,于全身麻醉下插管,常规消毒铺单,术前根据影像学检查结果中十二指肠部位和肠系膜与反肠系膜交界处确定十二指肠GIST的准确位置,并决定切除方法。对于肿瘤靠近胃小弯或胃窦且切除肿瘤可能会对残胃造成较大影响的患者,在保证安全切缘和保护好腹腔的前提下切开肠壁,沿肿瘤根部将其切除。对于腔内-腔外、壁间或腔外型肿瘤,在肠壁浆膜面用线性切割闭合器直接切除肿瘤后闭合,并进行合理的消化道重建。根据十二指肠GIST的部位和大小选择手术切除与消化道重建方法,对于十二指肠球部和降部上段肿瘤在远端胃切除后可选择毕Ⅱ式吻合和端-侧Roux-en-Y式十二指肠空肠吻合术(图 1A);对于十二指肠降部肿瘤,根据肿瘤大小选择楔形切除后直接一期缝合,或实施侧-侧Roux-en-Y式十二指肠空肠吻合术(图 1B、1C);对于十二指肠水平部和升部肿瘤,在实施节段切除术后可选择行端-端或侧-侧十二指肠空肠吻合术(图 1D)。
|
图 1 不同部位十二指肠GIST的局部切除和消化道重建方法 A:十二指肠球部和降部上段肿瘤在远端胃切除后可选择毕Ⅱ式吻合和端-侧Roux-en-Y式十二指肠空肠吻合术; B, C:对于十二指肠降部肿瘤, 根据肿瘤大小选择楔形切除后直接一期缝合(B), 或实施侧-侧Roux-en-Y式十二指肠空肠吻合术(C); D:对于十二指肠水平部和升部肿瘤, 在实施节段切除术后可选择行端-端或侧-侧十二指肠空肠吻合术. GIST:胃肠道间质瘤 |
1.3 研究指标
分析患者的一般资料、手术报告、影像学和病理检查报告,记录患者的年龄、性别、临床表现、解剖定位、肿瘤大小、高倍镜下核分裂计数、手术方式、切缘状态、新辅助治疗情况、辅助治疗情况、风险分级和随访情况。参照Fletcher等[4]报道的方法进行十二指肠GIST风险分级(表 1)。
|
|
表 1 十二指肠GIST Fletcher风险分级标准[4] |
2 结果 2.1 患者临床特征及手术情况
29例患者中男22例、女7例,年龄为33~80岁,平均年龄为(58.2±10.6)岁。24例(82.8%)患者的GIST发生于十二指肠球部和降部,5例(17.2%)发生于水平部和升部。12例(41.4%)患者以腹痛、腹胀为首发症状,8例(27.6%)以黑便为首发症状,其余9例(31.0%)为健康体检时偶然发现。1例患者术前诊断GIST伴肝转移,首发症状为黑便。所有患者均接受局部切除手术治疗,其中19例行单纯楔形切除+一期吻合(16例开腹手术、3例腹腔镜手术),7例行开腹区段切除术+毕Ⅱ式胃空肠吻合+Roux-en-Y式吻合(含1例肝转移患者,转移灶未行手术治疗),2例行开腹楔形切除术+Roux-en-Y式十二指肠空肠吻合,1例行开腹区段切除术+侧-侧十二指肠空肠吻合。术后病理示所有患者肿瘤切缘均为阴性(R0)。术后发生吻合口瘘2例(毕Ⅱ式+Roux-en-Y式吻合、单纯楔形切除各1例),肠梗阻3例,均经对症支持治疗后好转,无二次手术。29例患者平均住院时间为(15.1±5.6)d,住院费用为(38 946.4±4 896.9)元。
2.2 患者辅助治疗、病理特征及随访情况3例患者在术前接受新辅助药物治疗(伊马替尼400 mg/d,疗程12周)。术后病理示29例患者的肿瘤平均最长径为(57.3±14.2)mm,25例CD117阳性,22例DOG1阳性;肿瘤风险分级:高危8例(包括2例新辅助治疗患者),中危10例(包括1例新辅助治疗患者),低危10例,极低危1例。29例患者的随访时间为15~60个月,平均(36.8±17.1)个月,18例中高危十二指肠GIST患者术后均口服伊马替尼进行辅助治疗。随访至2018年8月30日,3例患者死于内科疾患,1例患者死于意外事故,包括1例肝转移病例在内的其余25例患者存活,且均无局部复发。
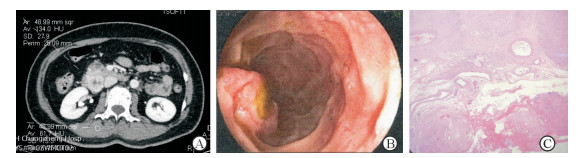
2.3 典型病例患者女,51岁,因“黑便1周”入院。术前上腹部计算机断层扫描检查示十二指肠降部占位病变(图 2A),术前胃镜检查示十二指肠降部乳头下方乳头侧肠壁发现一黏膜隆起性病灶(图 2B),术后病理证实为十二指肠GIST(图 2C)。行开腹十二指肠楔形切除+一期吻合术,术后恢复良好,随访40个月,未复发。
|
图 2 1例51岁女性十二指肠降部GIST患者的病历资料 A:术前上腹部计算机断层扫描检查示十二指肠降部远端占位病变; B:术前胃镜检查示十二指肠降部乳头下方乳头侧肠壁可见一黏膜隆起性病灶, 大小约3.5 cm×2.5 cm, 表面可见不规则巨大溃疡且覆盖黄白苔、质硬、易出血; C:术后病理结果示GIST,每50个高倍视野下核分裂数<5 (H-E染色. Original magnification: ×40). GIST:胃肠道间质瘤 |
3 讨论 3.1 GIST流行病学特征及临床表现
GIST是一类起源于胃肠道间叶组织的肿瘤,占消化道间叶组织肿瘤的大部分,该肿瘤细胞与胃肠道肌间神经丛周围的Cajal间质细胞相似,均有c-kit基因、CD117和CD34表达阳性[5]。GIST占胃肠道恶性肿瘤的1%~3%,年发病率为10/100万~20/100万,多发于中老年患者,40岁以下患者少见,男女发病率无明显差异[6]。大部分GIST发生于胃和小肠,十二指肠GIST是临床上较少见的类型,发病率低、起病隐匿、缺乏特异性表现[7]。十二指肠GIST的临床表现取决于肿瘤部位、大小和浸润深度等因素,一些肿瘤较小的患者可通过健康体检等方式偶然发现,肿瘤稍大侵犯黏膜并形成溃疡时可表现为消化道出血[8]。本研究中大部分十二指肠GIST患者以上腹部不适和消化道出血为首发症状,与既往报道结果[9]一致。
3.2 手术经验我科在具体手术过程中根据不同部位选择了不同手术方案。对于十二指肠球部及壶腹部近端的小肿瘤,尤其是那些位于肠系膜边缘的小肿瘤,如果可以保留壶腹和其余肠管,那么无论其位置如何,均可以进行楔形切除并一期吻合。如该位置肿瘤较大,肠壁缺损吻合有张力或者可能致肠腔狭窄,可以进行消化道重建,常用方式为毕Ⅱ式胃空肠吻合+Roux-en-Y式吻合[10]。壶腹部对侧的较大肿瘤,目前可选择楔形切除术+Roux-en-Y式十二指肠空肠吻合,该术式的应用使患者避免行胰十二指肠切除术[11],本研究中2例行此术式患者恢复良好。十二指肠区段切除并端-端或侧-侧十二指肠空肠吻合术适于治疗壶腹远端和水平段较大肿瘤[12]。
3.3 术后随访本研究中十二指肠4个节段均发现肿瘤,3例患者在术前接受新辅助药物治疗(伊马替尼400 mg/d,疗程12周),目前生存良好,无复发和转移,但新辅助药物治疗价格昂贵,无法广泛普及。本研究中患者经不同手术方式治疗后预后较满意,在随访期间发现接受局部切除术的患者因保护了正常肠道生理结构,因此不良反应较少。结合既往研究[13],我们认为肿瘤直径<2 cm、距离十二指肠乳头较远、具有充分吻合空间且术后不会导致肠腔狭窄等并发症的患者,应将局部切除作为首选手术方式。GIST多经腹腔种植或通过血液循环播散,极少数发生淋巴结转移[14],本研究入组的29例患者均未行淋巴结清扫,在随访期间均未发生局部复发。术前诊断存在肝转移的1例患者因黑便入院,行腹腔镜下手术局部切除肿瘤,术后口服伊马替尼治疗23个月,肝左叶较大病灶由10 cm缩小至5 cm,无局部复发征象,患者生存良好,下一步拟行肝脏射频消融术治疗。
对于十二指肠GIST患者,在切缘条件许可的情况下行局部手术切除可获得较好的疗效和无瘤生存率。在实际手术过程中应最大程度地实现切缘阴性,当肿瘤与胰腺边界不清或出现胰腺受侵导致局部切除术无法完全切除肿瘤时应行扩大切除术。
| [1] |
MENGE F, JAKOB J, KASPER B, SMAKIC A, GAISER T, HOHENBERGER P. Clinical presentation of gastrointestinal stromal tumors[J]. Visc Med, 2018, 34: 335-340. DOI:10.1159/000494303 |
| [2] |
BARBU L A, MĂRGĂRITESCU N D, GHILUŞI M C, BELIVACĂ D, GEORGESCU E F, GHELASE Ş M, et al. Severe upper gastrointestinal bleeding from gastrointestinal stromal tumor of the stomach[J]. Rom J Morphol Embryol, 2016, 57: 1397-1401. |
| [3] |
MELO C, CANHOTO C, MANATA F, BERNARDES A. Surgical treatment of giant GIST with acute gastrointestinal bleeding:case report[J]. Int J Surg Case Rep, 2018, 53: 354-357. DOI:10.1016/j.ijscr.2018.11.021 |
| [4] |
FLETCHER C D, BERMAN J J, CORLESS C, GORSTEIN F, LASOTA J, LONGLEY B J, et al. Diagnosis of gastrointestinal stromal tumors:a consensus approach[J]. Hum Pathol, 2002, 33: 459-465. DOI:10.1053/hupa.2002.123545 |
| [5] |
CROWN A, BIEHL T R, ROCHA F G. Local resection for duodenal gastrointestinal stromal tumors[J]. Am J Surg, 2016, 211: 867-870. DOI:10.1016/j.amjsurg.2016.02.006 |
| [6] |
TSENG C M, LIN I C, CHANG C Y, WANG H P, CHEN C C, MO L R, et al. Role of computed tomography angiography on the management of overt obscure gastrointestinal bleeding[J/OL]. PLoS One, 2017, 12: e0172754. doi: 10.1371/journal.pone.0172754.
|
| [7] |
ŞAHIN S, EKINCI Ö, SEÇKIN S, DURSUN A. The diagnostic and prognostic utility of DOG1 expression on gastrointestinal stromal tumors[J]. Turk Patoloji Derg, 2017, 33: 1-8. |
| [8] |
LIN J X, CHEN Q F, ZHENG C H, LI P, XIE J W, WANG J B, et al. Is 3-years duration of adjuvant imatinib mesylate treatment sufficient for patients with high-risk gastrointestinal stromal tumor? A study based on long-term follow-up[J]. J Cancer Res Clin Oncol, 2017, 143: 727-734. DOI:10.1007/s00432-016-2334-x |
| [9] |
FU Y, HAO H, GUO L, YANG G, ZHANG X. Retrospective analysis of 85 cases of intermediate-risk gastrointestinal stromal tumor[J]. Oncotarget, 2017, 8: 10136-10144. |
| [10] |
POPIVANOV G, TABAKOV M, MANTESE G, CIROCCHI R, PICCININI I, D'ANDREA V, et al. Surgical treatment of gastrointestinal stromal tumors of the duodenum: a literature review[J/OL]. Transl Gastroenterol Hepatol, 2018, 3: 71. doi: 10.21037/tgh.2018.09.04.
|
| [11] |
KOO D H, RYU M H, KIM K M, YANG H K, SAWAKI A, HIROTA S, et al. Asian consensus guidelines for the diagnosis and management of gastrointestinal stromal tumor[J]. Cancer Res Treat, 2016, 48: 1155-1166. DOI:10.4143/crt.2016.187 |
| [12] |
NISHIDA T, BLAY J Y, HIROTA S, KITAGAWA Y, KANG Y K. The standard diagnosis, treatment, and follow-up of gastrointestinal stromal tumors based on guidelines[J]. Gastric Cancer, 2016, 19: 3-14. DOI:10.1007/s10120-015-0526-8 |
| [13] |
JOENSUU H, ERIKSSON M, SUNDBY HALL K, REICHARDT A, HARTMANN J T, PINK D, et al. Adjuvant imatinib for high-risk GI stromal tumor:analysis of a randomized trial[J]. J Clin Oncol, 2016, 34: 244-250. |
| [14] |
HOEPPNER J, KULEMANN B, MARJANOVIC G, BRONSERT P, HOPT U T. Limited resection for duodenal gastrointestinal stromal tumors:surgical management and clinical outcome[J]. World J Gastrointest Surg, 2013, 5: 16-21. DOI:10.4240/wjgs.v5.i2.16 |
 2019, Vol. 40
2019, Vol. 40


