2. 海军军医大学(第二军医大学)长海中医医院, 上海 200433;
3. 海军军医大学(第二军医大学)纳米医学研究室, 上海 200433
2. Changhai Traditional Chinese Medicine Hospital, Naval Medical University(Second Military Medical University), Shanghai 200433, China;
3. Laboratory of Nano Biomedicine, Naval Medical University(Second Military Medical University), Shanghai 200433, China
随着环境污染的加剧和食品添加剂、化工制品等的使用,恶性肿瘤已逐步取代心脑血管疾病而成为严重威胁国民身心健康的重大恶性疾病[1]。早期恶性肿瘤的临床治疗以手术为主,配合以综合辅助方法,但晚期恶性肿瘤则以放射和化学治疗为主要治疗手段。临床上这些治疗手段各有特点,但又有其局限性,治疗效果也因恶性肿瘤种类不同而存在差异,对正常组织或细胞也有一定的毒副作用[2-3]。相比化学治疗,中医药治疗强调治本,主要从提升宿主免疫力,抑制病灶复发、转移,增强自身正气,平衡阴阳,以及抵制外来邪气方面达到治疗目的。中医认为肿瘤的形成与机体的正气虚、邪气趁机而入有关[4]。中医治疗肿瘤着重于整体调整和培正固本,注重分析病因、病机,是一个多层次、多渠道、多靶点的整体综合治疗过程。深入探讨中药复方有效成分的抗肿瘤作用,尤其是对具体靶细胞的作用机制,对开发新的纳米中药制剂和临床中西医结合治疗肿瘤有重要意义。本文首先概述了中药复方及单味中药的抗肿瘤作用特点及机制,并在此基础上总结分析了目前传统纳米中药剂型的研究进展。然后以中药紫草中的紫草素为例,阐述了基于纳米高分子胶束新型中药剂型的设计策略、抗肿瘤作用机制及优势,为新型高效纳米中药剂型的设计提供新的思路。
1 中药复方抗肿瘤的临床应用中医治疗离不开中药复方。中药复方是指在中医临证论治和整体观念指导下,依据中药理论将多种中药材组合形成的中药混合体[5]。近年来随着中医药研究的深入和技术的提高,中药复方在抗肿瘤治疗方面的研究取得了很大进展,许多中药复方已被证实具有显著的抗癌作用,如参麦注射液治疗弥漫大B细胞淋巴瘤、复方苦参注射剂治疗非小细胞肺癌等[6-7]。中西医结合临床实践也证明,多种单味中药提取物也具有显著的抗肿瘤作用,如紫杉醇具有抗卵巢癌作用、秋水仙碱具有抗胶质瘤作用等[8]。分析中药复方的功效并阐明其机制,尤其是探讨中药复方中具体成分的抗肿瘤作用机制,已成为当前中医治疗恶性肿瘤研究的热点之一。
药理学实验研究证明,四君子汤具有诱导细胞凋亡、抑制肿瘤细胞生长作用[9]。文献报道全蝎、赤芍、莪术、川芎、红花、当归等中药及以此为主要组分的多个方剂均具有良好的活血化瘀功能,且均有不同程度的抗肿瘤作用[10]。李蔚等[11]发现,中药复方龙蝎胶囊对晚期消化道肿瘤有抑制作用,并能提高患者的免疫功能,改善患者生活质量。汤铭新等[12]研究表明,中药复方天仙胶囊对小鼠移植性肿瘤生长有明显的抑制作用。孙静和马丽芳[13]总结了益气养阴方的抗肿瘤机制与临床应用。周红光和吴勉华[14]以荷瘤小鼠实体瘤质量和抑瘤率评价消癌解毒方对S180移植性肉瘤的抑制作用,以荷瘤小鼠存活时间评价消癌解毒方对H22移植性腹水癌的抑制作用。结果显示消癌解毒方能明显降低实体瘤质量,并延长荷瘤小鼠的存活时间,同时消癌解毒方对S180、H22肿瘤细胞株诱发的移植性肿瘤有抑制作用。由此可见,中药复方对肿瘤具有独特、显著的治疗效果。但是,中药复方的组成和成分复杂,若想提高复方疗效、扩大治疗范围和缩短治疗周期,还需进一步分析和研究中药复方的组成,尤其是某些单味中药的疗效和作用机制。
2 单味中药抑制肿瘤的机制海军军医大学(第二军医大学)长海中医医院在中西医结合治疗恶性肿瘤过程中,发现多种单味中药表现出良好的治疗效果。例如,常规治疗联合含有蟾酥(华蟾素)的中药方剂可有效提高肝癌的治疗效果,且在治疗过程中对患者的毒副作用较小[15]。从蟾酥中提取的有效成分华蟾素现已广泛应用于临床。目前已有研究从细胞和分子水平探讨中药抗肿瘤作用的机制。例如,人参皂苷Rg3可能通过抑制细胞间黏附分子1(intercellular adhesion molecule 1,ICAM-1)的表达上调封闭蛋白(occludin),从而抑制人结肠癌细胞系SW480的增殖[16]。刘佳维等[17]研究证明,半枝莲多糖对人肝癌细胞系SMMC7721的增殖有抑制作用,其机制可能与周期蛋白依赖性激酶2(cyclin-dependent kinase 2,CDK2)表达下调有关。刘细平和钟德[18]对蜈蚣提取液治疗裸鼠移植肝癌的作用及机制进行了研究,结果显示蜈蚣提取液能抑制裸鼠人肝癌细胞Bel-7404移植瘤的生长,其机制与抑制肿瘤血管生成、促进肿瘤细胞凋亡有关。因此,进一步深入了解单味中药及其成分的抗癌机制,以及其在抗晚期恶性肿瘤中的作用机制,对中药治疗恶性肿瘤的临床用药决策具有重要意义。
已有多项实验研究证实紫草素有抑制肿瘤细胞增殖、迁移和侵袭的作用,因此我们以单味中药紫草中的紫草素为例,系统分析单味中药有效组分的作用机制(图 1)。Jeung等[19]研究发现在体内异种移植瘤模型中,紫草素通过激活叉头转录因子O3a(forkhead box O3a,FOXO3a)/早期生长应答因子1(early growth response 1,EGR1)/沉默信息调节因子1(silent mating type information regulation 1,SIRT1)信号通路增强靶向基因Bcl-2相互作用细胞死亡介导因子(Bcl-2 interacting mediator of cell death,Bim)表达、降低蛋白激酶B(protein kinase B,Akt)和p300活性,影响非小细胞肺癌细胞的存活、诱导细胞凋亡。Qu等[20-21]研究发现,紫草素通过抑制肺癌细胞中的细胞外调节蛋白激酶(extracellular regulated protein kinase,ERK)途径降低细胞活力,可诱导人大细胞肺癌细胞NCI-H460凋亡;并发现紫草素也可通过负性调控磷酸肌醇3激酶(phosphoinositide 3 kinase,PI3K)/Akt信号通路诱导肺癌细胞凋亡,说明紫草素具有诱导肿瘤细胞凋亡的作用。

|
图 1 单味中药成分紫草素抑制肿瘤细胞机制示意图 Fig 1 Mechanism of monomeric drug shikonin inhibiting tumor cells FOXO3a: Forkhead box O3a; EGR1: Early growth response 1; SIRT1: Silent mating type information regulation 1; PI3K: Phosphoinositide 3 kinase; Akt: Protein kinase B; ERK: Extracellular regulated protein kinase; Bim: Bcl-2 interacting mediator of cell death |
3 纳米中药研究进展
早期中药复方制剂多采用传统剂型,如颗粒剂、胶囊剂、水煎剂、口服液等,但中药大部分属于植物来源,传统剂型导致其有效成分溶出度低,存在治疗要求剂量大、体内药物浓度低、有效成分释放不稳定且吸收困难、药物代谢不稳定、药效作用不清晰等不足[22-23]。改进剂型的工艺设计是提升中药复方抗肿瘤效果的方法之一。目前,部分单味中药被制成微粒系统,如抗肝癌或抗肝炎药物紫草素、华蟾素、斑蝥素,抗感染药小檗碱,治疗消化道疾病的硫酸氢黄连素,治疗心血管疾病的银杏叶有效成分等[8]。也有部分中药复方成分被制成复合纳米剂型,如便通胶囊、四君子汤、鳖甲煎丸、桂枝茯苓丸等[8]。范雯等[24]采用机械式超微粒粉碎技术将中药复方苁蓉精中各组分药粉碎,研究复方苁蓉精纳米微粉的粒径与活性成分的关系,发现中药颗粒细度越高,细胞内有效成分暴露越充分,提取率越高。张君利等[25]通过建立电刺激致大鼠血栓模型,观察三七复方纳米颗粒剂抗血栓的作用及其对血液流变学的影响,结果证明三七复方纳米颗粒剂具有抗血栓作用,其作用机制与降低血液黏度和改变前列环素I2(prostacyclin,PGI2)/血栓素A2(thromboxane A2,TXA2)比值密切相关。施峰等[26]以牛黄醒消丸为例,提出了中药复方纳米给药系统的设计思路,并证明中药复方纳米化在多元给药系统中有明显优势。
随着纳米技术和新型生物相容性载体材料的研发,纳米靶向治疗渐渐成为临床肿瘤精准治疗的热点[27],研究和利用纳米级物质的性质开发载体材料在多个领域具有广阔的应用前景。将纳米材料和纳米技术应用于中药复方制剂形成新的纳米中药制剂,有助于提高中药治疗效果、扩大治疗范围和缩短治疗周期。相比传统药物治疗,纳米中药制剂具有毒副作用低、靶向性高等优点,在生物传感器、生物分子检测、荧光成像、药物靶向、药物运输等领域均有良好的效果[28-32]。章越等[33]构建了可共载丹参-三七复方多组分且在特定部位实现程序性释药的羟丙基-β-环糊精-聚乳酸-羟基乙酸共聚物磁性纳米递药系统。该纳米递药系统在外置磁铁条件下,可靶向摄取磁性纳米粒,使包载罗丹明B和香豆素6(荧光物质)的纳米粒在小鼠成纤维细胞L929内呈程序性释放;体外实验也证明该纳米递药系统具有外壳快速降解-内核缓释的双相释放动力学特征。但是深入分析目前的纳米中药剂型,我们发现大部分纳米中药剂型仍是将传统中药以物理粉碎的方式使其细微化,实现其有效成分的快速溶解和吸收,增加药物的生物利用度。该方法虽然对疗效有促进作用,但不能精确定位单味中药的作用靶点,不能在细胞水平将中药作用靶点与纳米载体的组成、微结构和靶向性很好地结合起来。
4 基于高分子的新型纳米中药剂型的优势针对临床治疗需求,在充分理解并参考传统中药方剂组成和组方原则、结合单药抗肿瘤机制研究和最新纳米医药的抗肿瘤治疗优势、深入分析体内病灶病理生理特点的基础上参考中药复方中单药具体靶点,利用纳米材料和技术设计构建新型纳米中药制剂,成为提升传统中药疗效的新思路。必须利用先端测试分析手段尽可能解析中药复方中某一种或几种成分,并了解其作用机制。大多数中药为天然植物,水溶性差,严重影响了其在体内的稳定性及疗效的发挥[34],为此还需了解中药的物理化学特性。另外,针对不同疾病,每种中药在整体和(或)细胞水平的作用靶点可能不同,不同单味中药在中药复方中的角色也可能不同。构建新型纳米体系有助于在时间、空间上实现不同药物的递送和释放,从而使中药复方中各成分各就各位、各行其是,最终从整体上提高中药复方治疗恶性肿瘤的效果[8]。这也是我们提出的纳米中药方剂中纳米载体体系的设计原则。
对植物性来源的难溶性中药而言,高分子胶束无疑是纳米中药制剂设计构建的首选体系。高分子纳米胶束具有体内稳定性好、载药范围广、毒副作用小、体内滞留时间长等独特优势[35-39]。而且,其作为载体可多次反复注射,无遗传毒性和细胞毒性,可以实现药物或基因的可控释放,有效延长药物作用时间,维持血药浓度,避免药物在体内的降解和变性。最关键的是,高分子纳米胶束具有其他载体无法比拟的核壳结构。高分子纳米胶束的疏水内核能够通过疏水作用大量负载疏水性的天然植物来源的药物,而且亲水外壳可以实现纳米中药的血清稳定性、体内循环和靶向修饰等[39-42]。组成高分子胶束的载体材料可以有针对性地选择不同的功能单体,实现可控释放。具体基于纳米胶束递送中药单体药物的剂型设计如图 2所示。
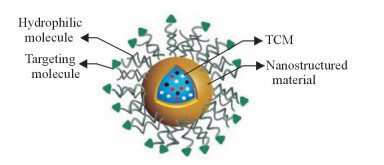
|
图 2 纳米中药胶束剂型结构示意图 Fig 2 Schematic diagram of micellar nano-TCM formulation TCM: Traditional Chinese medicine |
前期,我们曾以上述设计思路为指导,针对紫草素的疏水特性,合成了含有聚N-异丙基丙烯酰胺-聚乳酸两亲性温度敏感性嵌段聚合物(PID118-b-PLA39)[42]。通过透析自组装调节PID118-b-PLA39在水中的结构形态,并利用聚乳酸(polylactic acid,PLA)的疏水内核改善紫草素的水溶性,制成负载紫草素温度敏感性纳米中药剂型。体内外实验结果均显示,相比单体药物,该纳米中药剂型明显增加了紫草素的瘤内富集,通过荷瘤小鼠模型研究发现其体内抑瘤效果也明显增强。紫草素是该纳米中药体系的核心单体药物,其亲水分子能够促使载体在血液中长时间循环而实现被动靶向,在进一步研究中,我们在载体表面偶联抗体靶向分子,靶向肝癌细胞高表达的人类表皮生长因子受体1(human epidermal growth factor receptor 1,Her1),实现该中药剂型对肝癌细胞的主动靶向。当Her1-TCM@PEG-PLA纳米中药进入体内(静脉或皮下给药)后,在亲水外壳的保护下,大量有效中药成分在体内的血液循环时间大大延长,并且药物不被遗漏,毒副作用明显降低;当纳米中药体系在生物靶向分子Her1抗体的引导下与肝癌细胞相互作用后,抗体-抗原结合使Her1-TCM@PEG-PLA纳米粒被肿瘤细胞大量捕获内吞,在细胞内通过内含体→自噬体→自噬溶酶体→溶酶体路径进入溶酶体。溶酶体内的酸性微环境(pH<5.0)能够快速降解PLA内核,导致该纳米体系崩解,释放大量紫草素发挥靶向抗肿瘤作用(待发表资料)。
5 展望传统中药的研究历史悠久,根据其独特的组方原则如“君臣佐使”等治疗肿瘤的效果已被临床证明。文献报道和我们的实验研究证明,相比传统的中药治疗,基于高分子胶束的纳米中药会降低毒副作用、精准靶向肿瘤、提高疗效[43]。随着分子生物学、基因检测和大数据的应用,新型分析检测手段、人工智能和大数据给中药复方的分析研究带来井喷式发展,肿瘤微环境及肿瘤靶标也被更深入地揭示,这些均为新型纳米材料的选择、智能纳米载体的设计和精准靶向分子的选择提供了更多依据,也为新型抗肿瘤纳米中药制剂的设计提供了更多思路。因此,基于智能纳米材料和技术的新型纳米中药剂型的研发对解决目前西医治疗恶性肿瘤时无法克服的问题有不可替代的作用,将是未来临床中药治疗肿瘤的发展趋势。
| [1] |
李曼, 杨玉婷, 何勤, 张志荣. 纳米载体在肿瘤免疫治疗中的研究进展[J]. 药学学报, 2017, 52: 1839-1848. |
| [2] |
曹远东, 孙新臣. 肿瘤治疗的演变和思考[J]. 医学与哲学(人文社会医学版), 2009, 30: 13-16, 38. |
| [3] |
任芳, 王茂云, 陈格格, 崔艺馨, 王海明, 冯宇, 等. 参芪扶正注射液联合全身化疗减轻肿瘤化疗不良反应的临床观察[J]. 肿瘤研究与临床, 2018, 30: 251-254. DOI:10.3760/cma.j.issn.1006-9801.2018.04.008 |
| [4] |
张宗歧.试论中医肿瘤的病因和治法[C]//第八届全国中西医结合肿瘤学术研讨会论文集.北京: 中国中西医结合学会, 2003: 232-235.
|
| [5] |
刘建勋, 任建勋, 林成仁. 中药复方功效的研究与发展[J]. 中国中药杂志, 2016, 41: 971-975. |
| [6] |
胡姗姗, 施方静, 黄沆, 罗信国, 高新芳. 参麦注射液联合化疗对弥漫大B细胞淋巴瘤患者的临床疗效[J]. 中成药, 2019, 41: 1747-1749. DOI:10.3969/j.issn.1001-1528.2019.07.056 |
| [7] |
赵忠仁, 崔淑敏. 复方苦参注射液联合放疗治疗晚期非小细胞肺癌的临床观察[J]. 天津药学, 2013, 25: 51-52. |
| [8] |
苏永华, 凌昌全. 构建纳米方剂体系的可能性和必要性[J]. 中西医结合学报, 2010, 8: 101-105. |
| [9] |
郑玲英, 赵银鹰. 四君子汤抗肿瘤药理研究[J]. 实用中西医结合临床, 2010, 10: 93-94. |
| [10] |
喻明, 曹琦琛, 苏玉茜, 隋鑫, 杨洪军, 黄璐琦, 等. 基于中医传承辅助系统的中医治疗肿瘤方剂组方分析及新方发现[J]. 中国中药杂志, 2015, 40: 3110-3114. |
| [11] |
李蔚, 章烨, 朱寿兴, 张斌. 中药复方治疗晚期胃肠道肿瘤临床观察[J]. 吉林中医药, 2012, 32: 900-902. |
| [12] |
汤铭新, 孙桂芝, 陈长怀, 王桂绵. 中药复方天仙胶囊抑制小鼠肿瘤的实验研究和治疗食管癌胃癌的临床观察[J]. 中国肿瘤临床, 1990, 17: 28-31. |
| [13] |
孙静, 马丽芳. 益气养阴方抗肿瘤机制及临床应用研究进展[J]. 中医药信息, 2016, 33: 101-104. |
| [14] |
周红光, 吴勉华. 消癌解毒方抗肿瘤作用的实验研究[J]. 时珍国医国药, 2010, 21: 815-816. DOI:10.3969/j.issn.1008-0805.2010.04.018 |
| [15] |
荣震, 陈羽娜, 莫春梅, 牛鑫, 陈小云, 甘芷川, 等. 华蟾素注射液联合肝动脉栓塞化疗治疗原发性肝癌的Meta分析[J]. 广州中医药大学学报, 2016, 33: 274-280. |
| [16] |
简捷, 刘利珍, 黄缘, 李双, 邓峰. 人参皂苷Rg3对人结肠癌细胞株SW480增殖的影响及其作用机制[J]. 山东医药, 2016, 56: 8-10. |
| [17] |
刘佳维, 宋高臣, 刘洋, 张秀萍. 半枝莲多糖对肝癌细胞SMMC7721生长抑制及机制的研究[J]. 广州中医药大学学报, 2012, 29: 695-698. |
| [18] |
刘细平, 钟德. 蜈蚣提取液对裸鼠移植肝癌抑癌作用及机制的研究[J]. 中国普通外科杂志, 2010, 19: 164-168. |
| [19] |
JEUNG Y J, KIM H G, AHN J, LEE H J, LEE S B, WON M, et al. Shikonin induces apoptosis of lung cancer cells via activation of FOXO3a/EGR1/SIRT1 signaling antagonized by p300[J]. Biochim Biophys Acta, 2016, 1863: 2584-2593. DOI:10.1016/j.bbamcr.2016.07.005 |
| [20] |
QU D, CHEN Y U, XU X M, ZHANG M, ZHANG Y I, LI S Q. Cbl-b-regulated extracellular signal-regulated kinase signaling is involved in the shikonin-induced apoptosis of lung cancer cells in vitro[J]. Exp Ther Med, 2015, 9: 1265-1270. DOI:10.3892/etm.2015.2283 |
| [21] |
QU D, XU X M, ZHANG M, JIANG T S, ZHANG Y, LI S Q. Cbl participates in shikonin-induced apoptosis by negatively regulating phosphoinositide 3-kinase/protein kinase B signaling[J]. Mol Med Rep, 2015, 12: 1305-1313. DOI:10.3892/mmr.2015.3510 |
| [22] |
王璐婷, 奉建芳, 胡凯莉. 中药纳米制剂在脑部疾病治疗中的应用[J]. 中成药, 2015, 37: 2011-2018. |
| [23] |
于斌, 连海燕, 王野, 张红霞, 朱海英. 纳米材料应用于肿瘤治疗的研究进展[J]. 中国细胞生物学学报, 2015, 37: 594-598. DOI:10.11844/cjcb.2015.04.0294 |
| [24] |
范雯, 曾建伟, 陈发兴, 叶水芬, 魏维, 陈诗雅, 等. 中药复方苁蓉精纳米微粉制剂的制备及其活性成份分析[J]. 时珍国医国药, 2016, 27: 2654-2657. |
| [25] |
张君利, 贾乘, 苑博, 汪洋, 程嘉艺. 三七复方纳米颗粒剂抑制血栓形成作用及机制初探[J]. 中国实验方剂学杂志, 2010, 16: 81-83. |
| [26] |
施峰, 杨刚, 刘颖, 冯年平.以牛黄醒消丸为例探讨中药复方纳米给药系统的设计[C]//2013年"好医生杯"中药制剂创新与发展论坛论文集.成都: 中华中医药学会、世界中医药学会联合会, 2013: 308-311.
|
| [27] |
潘佐, 杨晓峰, 刘红耀. 纳米粒子的生物学性能及光学应用前景[J]. 中国现代医药杂志, 2015, 17: 98-102. |
| [28] |
LI Y, DUAN X, JING L, YANG C, QIAO R, GAO M. Quantum dot-antisense oligonucleotide conjugates for multifunctional gene transfection, mRNA regulation, and tracking of biological processes[J]. Biomaterials, 2011, 32: 1923-1931. DOI:10.1016/j.biomaterials.2010.11.024 |
| [29] |
GILJOHANN D A, SEFEROS D S, PRIGODICH A E, PATEL P C, MIRKIN C A. Gene regulation with polyvalent siRNA-nanoparticle conjugates[J]. J Am Chem Soc, 2009, 131: 2072-2073. DOI:10.1021/ja808719p |
| [30] |
WANG B, CHEN N, WEI Y, LI J, SUN L, WU J, et al. Akt signaling-associated metabolic effects of dietary gold nanoparticles in Drosophila[J/OL]. Sci Rep, 2012, 2: 563. doi: 10.1038/srep00563.
|
| [31] |
FIRME C P 3rd, BANDARU P R. Toxicity issues in the application of carbon nanotubes to biological systems[J]. Nanomedicine, 2010, 6: 245-256.
|
| [32] |
HE Q, ZHANG Z, GAO F, LI Y, SHI J. In vivo biodistribution and urinary excretion of mesoporous silica nanoparticles: effects of particle size and PEGylation[J]. Small, 2011, 7: 271-280. DOI:10.1002/smll.201001459 |
| [33] |
章越, 丁陈陈, 温露, 陈钢. 核壳型聚乳酸-羟基乙酸共聚物磁性纳米系统用于中药复方多组分的时空递释[J]. 药学学报, 2018, 53: 31-38. |
| [34] |
于波涛, 宋宗辉, 呼永河, 王燕燕, 张文静. 左旋紫草素体外稳定性研究[J]. 解放军药学学报, 2016, 32: 25-27. |
| [35] |
LI W, ZHAO H, QIAN W, LI H, ZHANG L, YE Z, et al. Chemotherapy for gastric cancer by finely tailoring anti-Her2 anchored dual targeting immunomicelles[J]. Biomaterials, 2012, 33: 5349-5362. DOI:10.1016/j.biomaterials.2012.04.016 |
| [36] |
LI W, LI J, GAO J, LI B, XIA Y, MENG Y, et al. The fine-tuning of thermosensitive and degradable polymer micelles for enhancing intracellular uptake and drug release in tumors[J]. Biomaterials, 2011, 32: 3832-3844. DOI:10.1016/j.biomaterials.2011.01.075 |
| [37] |
ZHANG F, ZHU X, GONG J, SUN Y, CHEN D, WANG J, et al. Lysosome-mitochondria-mediated apoptosis specifically evoked in cancer cells induced by gold nanorods[J]. Nanomedicine (Lond), 2016, 11: 1993-2006. DOI:10.2217/nnm-2016-0139 |
| [38] |
ZHU X, SUN Y, CHEN D, LI J, DONG X, WANG J, et al. Mastocarcinoma therapy synergistically promoted by lysosome dependent apoptosis specifically evoked by 5-Fu@nanogel system with passive targeting and pH activatable dual function[J]. J Control Release, 2017, 254: 107-118. DOI:10.1016/j.jconrel.2017.03.038 |
| [39] |
张付雷, 李威. 精准治疗中2个相互依存的元素:精准医学和纳米医药[J]. 第二军医大学学报, 2017, 38: 689-698. ZHANG F L, LI W. Precision medicine and nanomedicine: two essential and interdependent elements in precision therapy[J]. Acad J Sec Mil Med Univ, 2017, 38: 689-698. |
| [40] |
陈迪, 李威. 建立"纳米物理药剂学"原理解决纳米医药发展中的瓶颈问题[J]. 第二军医大学学报, 2017, 38: 699-706. CHEN D, LI W. Proposing"nano-based physical pharmacy" principle for overcoming bottlenecks in development of nanomedicine[J]. Acad J Sec Mil Med Univ, 2017, 38: 699-706. |
| [41] |
张莉, 王颖, 金崇, 董霞, 李威. 主被动双靶向纳米凝胶递送RRM2-siRNA的体外抗肿瘤效应[J]. 第二军医大学学报, 2017, 38: 720-726. ZHANG L, WANG Y, JIN C, DONG X, LI W. In vitro anti-tumor effect of RRM2-siRNA based on active and passive dual targeted nanogel[J]. Acad J Sec Mil Med Univ, 2017, 38: 720-726. |
| [42] |
黄念.负载紫草素的温敏被动靶向纳米胶束的制备及抗乳腺癌作用研究[D].上海: 第二军医大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-90030-1016162322.htm
|
| [43] |
LI W, WEI H, LI H, GAO J, FENG S S, GUO Y. Cancer nanoimmunotherapy using advanced pharmaceutical nanotechnology[J]. Nanomedicine (Lond), 2014, 9: 2587-2605. DOI:10.2217/nnm.14.127 |
 2019, Vol. 40
2019, Vol. 40


