类风湿关节炎是一种系统性的自身免疫性疾病,轻者表现为关节疼痛,严重者出现关节畸形、萎缩,还常伴有胸膜炎、心包炎等病变,严重影响人们的生活和工作[1-2]。关节滑膜是类风湿关节炎累及的主要器官,滑膜中的成纤维样滑膜细胞是类风湿关节炎的主要病变细胞[3]。从佐剂性关节炎动物模型中分离培养成纤维样滑膜细胞是研究类风湿关节炎发病机制与体外筛选药物的重要手段之一[4]。现有成纤维样滑膜细胞分离培养的主要方法之一是组织块贴壁法,然而该方法存在组织块贴壁难、操作时间长的问题。本实验以佐剂性关节炎动物模型为研究对象,采用悬浮组织块法体外培养成纤维样滑膜细胞,并与组织块贴壁法作比较。
1 材料和方法 1.1 实验动物健康新西兰大白兔16只,体质量(2.0±0.5)kg,由武汉市新洲区万千佳禾实验动物养殖场提供[实验动物生产许可证号SCXK(鄂)2011-0011]。在解放军中部战区总医院医学实验科动物实验设施内进行实验[实验动物使用许可证号SYXK(鄂)2014-0082],实验过程中对动物的处置符合实验动物伦理学标准。
1.2 试剂与仪器弗氏完全佐剂购自美国Sigma公司;CCK-8试剂盒购自上海碧云天生物技术有限公司;DMEM高糖培养液、磷酸盐缓冲液(phosphate buffer saline,PBS)购自美国HyClone公司;胎牛血清购自杭州四季青生物工程材料有限公司;荧光(Cy3)标记羊抗小鼠免疫球蛋白G、小鼠波形蛋白一抗购自武汉博士德生物工程有限公司;生物安全柜购自青岛海尔股份有限公司;倒置荧光显微镜购自日本奥林巴斯公司;MCO-175 CO2细胞培养箱购自日本三洋公司。
1.3 实验方法 1.3.1 佐剂性关节炎兔模型的制备[5]新西兰大白兔适应性喂养1周后,随机分为正常组和模型组,每组8只。剃去背部肩胛骨间、双膝关节以下的毛,每只兔右跖部皮下注射0.4 mL弗氏完全佐剂,同时在背部肩胛骨间随机取4点,每点注射0.2 mL弗氏完全佐剂。7 d后进行加强注射1次:每只兔右跖部皮下注射0.4 mL弗氏完全佐剂,背部肩胛骨间任取2点,每点注射0.2 mL弗氏完全佐剂。造模24 d后观察两组兔足趾肿胀情况和足关节的病理切片,鉴定模型。
1.3.2 成纤维样滑膜细胞的分离培养(1)悬浮组织块法。随机选取佐剂性关节炎模型兔2只,参照既往报道的方法[6]取出平滑光亮的滑膜组织,放入含青链霉素双抗的PBS中,然后移入生物安全柜内。用含青链霉素双抗的PBS洗3~4次,剪成绿豆大小,置入3.5 cm平皿中(3~4块/皿)并立即加入含10%胎牛血清的DMEM高糖培养液使组织块处于悬浮状态,轻晃平皿使组织块分布均匀后即可放入37 ℃、5% CO2培养箱培养。5 d后首次换液,9~10 d后去除组织块。约2周细胞融合度达80%~90%时用胰酶消化,按1:2的比例传代,在显微镜下观察细胞生长形态。从将取出的滑膜组织移入生物安全柜后开始计时,将平皿放入培养箱开始培养结束计时,得到采用悬浮组织块法分离成纤维样滑膜细胞的操作时间。
(2)组织块贴壁法。采用与上述相同的方法取出滑膜组织并移入生物安全柜中,然后用含青链霉素双抗的PBS洗3~4次,无菌滤纸吸干组织表面水分后剪成绿豆大小,均匀置入3.5 cm平皿中(7~8块/皿),将平皿倒置于培养箱内30 min后轻缓地加入5~6 mL含10%胎牛血清的DMEM高糖培养液,于37 ℃、5% CO2培养箱继续培养。3 d后首次换液。约12 d细胞融合度达80%~90%时用胰酶消化,按1:2的比例传代,在显微镜下观察细胞生长形态。同样从将取出的滑膜组织移入生物安全柜后开始计时,将平皿倒置培养后加入生长液放入培养箱开始培养结束计时,得到采用组织块贴壁法分离成纤维样滑膜细胞的操作时间。
1.3.3 细胞活力检测将第3代细胞接种到96孔培养板内(1×103/孔),每组设6个复孔,分别于培养1、2、3、4、5、6、7 d后随机取出一孔,参照CCK-8试剂盒操作说明进行检测,读取450 nm波长处光密度(D450)值,绘制细胞生长曲线。
1.3.4 细胞鉴定将第3代细胞接种到铺有无菌爬片的6孔板中(1×105/孔),培养2 d后去上清,PBS洗3次,用40 g/L多聚甲醛溶液4 ℃固定25 min。PBS洗3次,用0.5% Triton X-100室温下处理20 min。PBS洗3次、每次3 min,吸水纸吸干残留的PBS。用山羊血清室温封闭30 min,吸水纸吸去封闭液。加入1:100稀释的波形蛋白一抗并放入湿盒,4 ℃静置过夜。PBS洗3次,吸水纸吸干残留液体,滴加1:100稀释的荧光(Cy3)标记羊抗小鼠免疫球蛋白G,放入湿盒中,于25 ℃静置1 h。PBS洗3次,滴加4’, 6-二脒基-2-苯基吲哚染核5 min,磷酸盐吐温缓冲液洗4次、每次5 min。吸干爬片上的液体,封片,在荧光显微镜下观察。
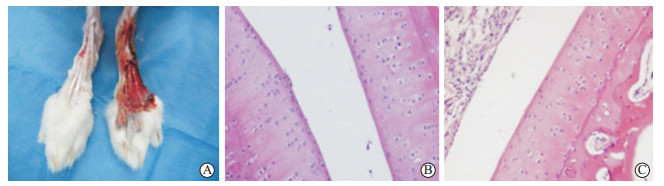
2 结果 2.1 佐剂性关节炎新西兰大白兔模型的鉴定造模完成后,从外观上看,模型组新西兰大白兔足跗关节及足趾部较正常组明显肿胀,解剖兔足趾部后肉眼可见模型组伴有明显的微血管增生和炎症(图 1A)。病理切片H-E染色结果显示,正常组滑膜细胞呈串珠样规则排列(图 1B),而模型组滑膜细胞排列紊乱(图 1C),提示佐剂性关节炎新西兰大白兔模型制备成功。
|
图 1 新西兰大白兔足趾部的病变特征 Fig 1 Histopathological changes of the toes in New Zealand white rabbits A: The toes of New Zealand white rabbits in normal control group (left) and model group (right); B: Synovial tissue in normal control group; C: Synovial tissue in model group. H-E staining. Original magnification: ×200 (B, C) |
2.2 两种方法操作时间与分离细胞形态
组织块贴壁法接种组织块后要先用滤纸吸干组织块表面附着的水分,再将平皿倒置培养30 min后才能缓慢加入培养液,且需避免组织块脱落。采用悬浮组织块法接种滑膜组织块后可立即加入培养液使组织块处于悬浮状态,不存在组织块贴壁难易的问题。组织块贴壁法的操作时间约为1 h,悬浮组织块法的操作时间约为25 min,悬浮组织块法操作时间较组织块贴壁法缩短至少30 min。两种方法组织块接种3~4 d后均可见少量长梭形细胞生长,随后细胞数量明显变多。组织块贴壁法需12 d细胞融合度达到80%~90%,悬浮组织块法约2周细胞融合度达到80%~90%。两种方法所得的原代细胞透明度大、折光度强、轮廓不清,形态以典型的长梭形为主。初步判断为成纤维样滑膜细胞。两种方法分离获得的细胞均可在培养1周左右传代1次。传至第3代时可见大量均匀分布的长梭形细胞。随着传代次数增加,细胞逐渐出现轮廓增强、折光度变弱、细胞间隙加大等衰老迹象。见图 2。

|
图 2 佐剂性关节炎新西兰大白兔成纤维样滑膜细胞原代培养 Fig 2 Primary culture of fibroblast-like synoviocytes from adjuvant arthritis rabbits A-C: Suspended explant culture. A: 3-4 d after culture; B: The first passage; C: The third passage. D-F: Explant culture. D: 3-4 d after culture; E: The first passage; F: The third passage. Original magnification: ×100 |
2.3 两种方法分离细胞生长曲线
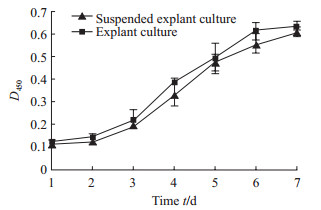
悬浮组织块法和组织块贴壁法分离获得的细胞经短暂的潜伏期后即进入指数生长期,在第7天进入平台期后生长稳定,最后出现衰老迹象,细胞生长曲线均呈“S”形,细胞活力较高。见图 3。
|
图 3 佐剂性关节炎新西兰大白兔成纤维样滑膜细胞生长曲线 Fig 3 Growth curve of fibroblast-like synoviocytes from adjuvant arthritis rabbits n=6, x±s |
2.4 两种方法分离细胞的鉴定
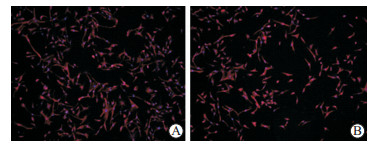
根据免疫荧光结果,悬浮组织块法和组织块贴壁法分离获得的细胞均强表达成纤维样滑膜细胞特异性分子波形蛋白,阳性率分别为98.01%、98.35%(图 4)。
|
图 4 免疫荧光检测佐剂性关节炎新西兰大白兔成纤维样滑膜细胞波形蛋白表达 Fig 4 Expression of vimentin in fibroblast-like synoviocytes from adjuvant arthritis rabbits by immunofluorescence staining A: Explant culture; B: Suspended explant culture. Original magnification: ×100 |
3 讨论
合适的动物模型是医学科研的重要手段。类风湿关节炎的造模方法有很多,如胶原酶诱导法、佐剂诱导法、抗原诱导法等[7],其中弗氏完全佐剂诱导是比较经典的类风湿关节炎造模方法。目前关于弗氏完全佐剂诱导的佐剂性关节炎动物建模方法还缺乏统一的标准[8]。本实验以新西兰大白兔为研究对象,在其右跖部皮下和背部多点多次注射弗氏完全佐剂。造模24 d后,模型组新西兰大白兔足跗关节及足趾部明显肿胀,解剖后可见足趾部有明显的微血管增生和炎症,H-E染色示滑膜细胞排列紊乱,这些表现与类风湿关节炎相符。
组织块贴壁法是原代细胞分离培养的主要方法[9],也是成纤维样滑膜细胞常见的体外分离培养方法,但组织块贴壁法经常出现组织块脱落的情况,虽然已有一些解决组织块贴壁难的方法,如将接种有组织块的培养瓶(皿)倒置培养或培养瓶(皿)在接种组织块之前加入适量的血清,但这些方法均延长了操作时间。与组织块贴壁法相比,本实验的创新点在于将组织块悬浮培养,既不需要用无菌滤纸吸干组织表面的水分和将培养皿倒置培养30 min克服组织块贴壁难的问题,也不需要人为地将组织块一块一块地接种均匀,仅需轻轻摇晃平皿使组织块分布均匀即可,一方面简化了操作步骤,另一方面缩短了操作时间(至少缩短30 min)。在培养过程中,悬浮组织块法分离培养的原代细胞融合度达到80%~90%的时间稍长于组织块贴壁法,这可能与悬浮组织块法接种时的组织块(3.5 cm平皿,3~4块/皿)少于组织块贴壁法(3.5 cm平皿,7~8块/皿)有关(经过多次尝试发现使用悬浮组织块法时,一个3.5 cm培养皿中加入3~4块剪碎的组织块即可,组织块过多可能会导致实验失败),但这种差异在传代过程中即消失,传代时细胞融合度达到80%~90%的时间均为1周左右。两种方法所得细胞的形态无明显差异,细胞活力都较高。传至5~6代时,细胞出现明显的衰老迹象。原代细胞的纯度是判断原代培养成功与否的关键因素之一。滑膜细胞有巨噬样滑膜细胞、成纤维样滑膜细胞、树突状细胞,其中成纤维样滑膜细胞是主要成分[10]。其他杂细胞因与成纤维样滑膜细胞的贴壁能力和增殖能力不同,故可在连续的传代过程中被逐步去除。传至第3代时,根据免疫荧光鉴定结果,两种方法所得的细胞纯度均较高,无明显差异,与文献报道结果[11-12]相符。
采用悬浮组织块法能成功从佐剂性关节炎模型新西兰大白兔滑膜组织中分离出成纤维样滑膜细胞,与组织块贴壁法相比,不存在组织块贴壁难的问题,操作简单,所需时间短,并且可在一定程度上克服原代培养因长时间操作常出现的细菌或真菌污染问题。通过多次的实验,我们发现该方法有2个关键点:(1)轻轻摇晃平皿使组织块尽量均匀分布,保证游离的细胞在平皿中的分布较均匀;(2)建议使用平皿接种,相同体积培养液加入平皿或细胞瓶后,组织块在平皿中的悬浮状态更佳。
建立关节炎动物模型的方法很多,各个动物模型的特点也存在差异[7]。采用不同方法建立的关节炎动物模型中分离的成纤维样滑膜细胞在蛋白水平、基因水平是否存在差异还不得而知,造成类风湿关节炎的机制、治疗药物的作用效果及作用机制是否存在差异也还有待探究。
| [1] |
褚克丹, 苏晓宇, 李煌, 徐伟. 类风湿性关节炎治疗中雷公藤的减毒增效措施的研究现状[J]. 中国实验方剂学杂志, 2015, 21: 208-213. |
| [2] |
周宇子, 华潞, 李一石. 类风湿性关节炎合并冠心病患者的红细胞沉降率与心肌梗死病史的关系[J]. 中国循环杂志, 2015, 30: 6-8. |
| [3] |
ZHANG H, XIAO W. TNFR1 and TNFR2 differentially mediate TNF-α-induced inflammatory responses in rheumatoid arthritis fibroblast-like synoviocytes[J]. Cell Biol Int, 2017, 41: 415-422. DOI:10.1002/cbin.10735 |
| [4] |
CHOUDHARY N, BHATT L K, PRABHAVALKAR K S. Experimental animal models for rheumatoid arthritis[J]. Immunopharmacol Immunotoxicol, 2018, 40: 193-200. DOI:10.1080/08923973.2018.1434793 |
| [5] |
梅焕平, 张源潮, 杨清锐, 遇晓, 潘正伦, 李晓云. 青紫兰家兔佐剂性关节炎的诱导方法研究[J]. 中华风湿病学杂志, 2002, 6: 278-279. DOI:10.3760/j:issn:1007-7480.2002.04.018 |
| [6] |
王俊伟. 一种实验兔膝关节滑膜组织提取新方法[J]. 中国比较医学杂志, 2016, 26: 94. DOI:10.3969/j.issn.1671-7856.2016.06.017 |
| [7] |
MCNAMEE K, WILLIAMS R, SEED M. Animal models of rheumatoid arthritis:how informative are they?[J]. Eur J Pharmacol, 2015, 759: 278-286. DOI:10.1016/j.ejphar.2015.03.047 |
| [8] |
BONEZZI F T, SASSO O, PONTIS S, REALINI N, ROMEO E, PONZANO S, et al. An important role for N-acylethanolamine acid amidase in the complete Freund's adjuvant rat model of arthritis[J]. J Pharmacol Exp Ther, 2016, 356: 656-663. DOI:10.1124/jpet.115.230516 |
| [9] |
司徒镇强, 吴军正. 细胞培养[M]. 2版. 西安: 世界图书出版西安公司, 2007: 57-63.
|
| [10] |
邹仲之. 组织学与胚胎学[M]. 6版. 北京: 人民卫生出版社, 2004: 54-55.
|
| [11] |
李向阳, 秦苏萍, 颜超, 于倩, 华慧, 潘伟, 等. 丙酮酸乙酯对类风湿性关节炎大鼠滑膜成纤维细胞增殖的影响[J]. 免疫学杂志, 2017, 33: 13-17. |
| [12] |
朱琪, 林芳. 成纤维样滑膜细胞原代培养方法的优化[J]. 国际免疫学杂志, 2016, 39: 459-462. DOI:10.3760/cma.j.issn.1673-4394.2016.05.009 |
 2019, Vol. 40
2019, Vol. 40


