近年来,随着临床治疗手段的提高,广谱抗生素、免疫抑制剂及糖皮质激素的广泛应用,以及各种有创诊疗技术的大量开展,真菌血流感染的发病率和死亡率呈上升趋势[1-2]。有研究显示,住院患者真菌血流感染发病率为0.03%~0.1% [3],死亡率高达35%~50% [4]。血培养是诊断真菌血流感染的金标准,但常规的培养方法耗时较长,易导致诊断和治疗的延误,造成不良后果[5]。(1-3)-β-D葡聚糖是大多数真菌细胞壁的重要组成成分之一,细菌、病毒和人体细胞都不存在这种多聚糖,它的检出是诊断深部真菌感染的有效依据[6]。本研究拟回顾性分析海军军医大学(第二军医大学)长海医院2015年1月至2017年12月真菌血流感染的临床分布,并评估血浆(1-3)-β-D葡聚糖检测试验(G试验)对真菌血流感染的临床诊断价值,为临床上真菌血流感染的早期诊断提供参考。
1 材料和方法 1.1 标本来源收集海军军医大学(第二军医大学)长海医院2015年1月至2017年12月临床各科室送检的真菌血培养和G试验血液标本。其中真菌血培养阳性并且患者有临床症状且确诊有真菌血流感染[5, 7]的标本共264例(其中137例同时进行G试验),用于分析真菌血流感染的临床科室分布和菌种分布;同时进行真菌血培养和G试验的标本1 678例(其中137例真菌血培养阳性,1 541例真菌血培养阴性),用于评估G试验对真菌血流感染的诊断价值。均去除重复送检标本。本研究经海军军医大学(第二军医大学)长海医院伦理委员会审批。
1.2 仪器与试剂Bactec 9240全自动血培养仪及配套血培养瓶购自美国BD公司;Bact/Alert 3D全自动血培养仪及配套血培养瓶、VITEK 2 Compact全自动微生物分析仪和配套酵母菌鉴定卡购自法国梅里埃公司;沙保罗培养基购自英国Oxoid公司;假丝酵母菌显色平板购自上海科玛嘉微生物技术有限公司;LKM微生物快速动态检测系统及配套G试验试剂盒购自湛江安度斯生物有限公司。
1.3 真菌血培养与菌株鉴定使用Bactec 9240全自动血培养仪进行血培养,将血培养阳性、涂片结果为真菌的血液标本转种于沙保罗培养基和假丝酵母菌显色平板,置于35 ℃培养箱内孵育24~72 h,观察菌落形态,用VITEK 2 Compact全自动微生物分析仪鉴定。
1.4 G试验采用无致热原真空采血管采取空腹静脉血2 mL,混匀,400×g离心10 min获得血浆,严格按照G试验试剂盒操作说明书检测,试剂盒质量控制阴性结果应<100.5 pg/mL,质量控制阳性结果应在靶值2倍标准差以内。判断标准:G试验结果0~100.5 pg/mL为阴性,>100.5 pg/mL为阳性。
1.5 统计学处理采用SPSS 19.0软件进行数据分析,绘制受试者工作特征(receiver operating characteristic,ROC)曲线,应用ROC曲线评估G试验对真菌血流感染的诊断效能。
2 结果 2.1 血流感染真菌的来源科室和菌种分布我院2015—2017年共检出血培养阳性真菌264株,主要分布在肝胆外科(81株)、心血管外科(57株)、急救科(包括急诊监护室、急诊观察室及抢救室,24株)、胸外科(22株)、血液科(16株)等科室,见表 1。在264株真菌中,以假丝酵母菌属为主,其中近平滑假丝酵母菌最多(142株,53.8%),其次为角膜假丝酵母菌(36株,13.6%)、白假丝酵母菌(20株,7.6%)和热带假丝酵母菌(18株,6.8%);另外还有罗伦特隐球菌和黏红酵母菌各1株。见表 2。
|
|
表 1 血流感染真菌的来源科室分布 Tab 1 Department distribution of bloodstream infection fungi |
|
|
表 2 血流感染真菌的菌种分布 Tab 2 Type distribution of bloodstream infection fungi |
2.2 血浆G试验结果及其对真菌血流感染的诊断价值
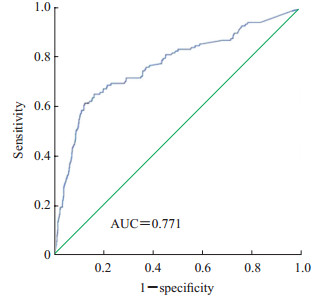
1 678例标本同时进行了血培养和血浆G试验,血培养阳性137例、阴性1 541例,G试验阳性270例、阴性1 408例(表 3)。以血培养阳性为标准,G试验诊断真菌血流感染的灵敏度和特异度分别为61.3%和87.9%,阳性预测值和阴性预测值分别为31.1%和96.2%。ROC曲线分析结果显示,G试验对真菌血流感染的诊断效能较好,曲线下面积(area under curve,AUC)为0.771,95%置信区间(confidence interval,CI)为0.723~0.819(图 1)。
|
|
表 3 真菌血培养及血浆G试验结果 Tab 3 The results of fungal blood culture and plasma G test |
|
图 1 G试验诊断真菌血流感染的ROC曲线 Fig 1 ROC curve of G test for diagnosis of fungal bloodstream infection G test: (1-3)-β-D-glucan test; ROC: Receiver operating characteristic; AUC: Area under curve |
2.3 真菌血培养前的G试验检测结果
以当次入院真菌血培养之前2~5 d为时间节点,1 541例非真菌血流感染病例中共有1 456例预先进行了G试验检测,检出阴性1 327例(91.1%)。137例真菌血流感染病例中共有102例预先进行了G试验检测,检出阳性71例(69.6%),其中15例提前2 d检测并检出阳性12例,14例提前3 d检测并检出阳性11例,9例提前4 d检测并检出阳性6例,64例提前5 d检测并检出阳性42例。
3 讨论血流感染是临床上严重危及患者生命的感染性疾病,病情进展迅速,致死率高,其中真菌血流感染近年来呈逐年增长趋势,且真菌血流感染通常不易被及时发现,其临床症状易为原发病所掩盖,早期诊断困难,易造成误诊或漏诊,从而造成抗真菌治疗的延迟,引起严重的后果[8]。以往白假丝酵母菌在真菌血流感染中的分离率最高,但近年来的研究显示,白假丝酵母菌的感染率下降,而近平滑假丝酵母菌等非白假丝酵母菌更为常见[9]。本研究分离的264株真菌菌株中,近平滑假丝酵母菌142株,占53.8%,为2015—2017年我院真菌血流感染的主要病原菌。有研究指出,近平滑假丝酵母菌所致的血流感染主要与静脉置管、胃肠外营养等有关[10]。我院发生真菌感染的患者也主要分布在肝胆外科(81株,30.7%)、心血管外科(57株,21.6%)等静脉置管和胃肠外营养较多的科室。
传统的真菌培养耗时长、阳性率低。β-葡聚糖广泛分布于多种真菌细胞壁中,为真菌的特有成分,其中(1-3)-β-葡聚糖约占80%,(1-6)-β-葡聚糖约占20%。(1-3)-β-D葡聚糖占真菌胞壁成分50%以上,当真菌进入人体血液或深部组织后,经吞噬细胞吞噬、消化,(1-3)-β-D葡聚糖可从胞壁中释放,使得血液或其他体液中(1-3)-β-D葡聚糖含量增高,通过检测(1-3)-β-D葡聚糖的含量能够及时反映真菌感染情况[11-12]。因此,检测(1-3)-β-D葡聚糖成为判断真菌感染的有效途径。
本研究结果显示,当G试验结果截断值设定为100.5 pg/mL时,其AUC为0.771(95% CI:0.723~0.819),灵敏度为61.3%,特异度为87.9%。上述结果表明G试验对真菌血流感染的诊断效能较好[13];但与既往研究及相关指南[14-19]比较,本研究得出的特异度比较理想,但灵敏度不高。本研究中102例确诊真菌血流感染患者在当次入院真菌血培养之前2~5 d曾进行G试验检测,结果发现71例(69.6%)为G试验阳性,其中64例提前5 d检测并检出阳性42例(65.6%)。由此可见,在真菌血培养前进行G试验检测,尤其是提前5 d检测已有较高的阳性率,提示G试验对真菌血流感染的早期诊断有一定的价值。但由于本次研究是回顾性分析,所收集的临床数据参差不齐,故不能在具体的时间点来更好地分析和比较G试验的诊断效能。
本研究纳入的1 678例患者中,真菌血培养和G试验均为阳性有84例,阳性预测值为31.1%;而真菌血培养和G试验均为阴性的有1 355例,阴性预测值为96.2%。相比较高的阴性预测值,阳性预测值非常低。由于本研究的研究对象都是疑似真菌血流感染的患者,相对较危重,在治疗期间不能排除患者接受过血液透析治疗,或注射过香菇多糖、脂肪乳、人血白蛋白等药物,或注射过双黄连、生脉等某些中药注射剂等,这些因素易造成假阳性。因此在进行G试验检测时要考虑到这些相关因素的影响,对于一些高危人群进行2次或2次以上的动态监测以降低假阳性率[20-21]。本研究还发现有53例真菌血培养阳性而G试验检测阴性的结果,原因主要为:(1)(1-3)-β-D葡聚糖只是真菌细胞壁的成分,如果真菌被厚壁纤维组织包裹,则很难释放入血,导致假阴性;(2)葡聚糖虽然存在于绝大多数真菌的细胞壁中,但仍有部分真菌感染如隐球菌属和接合菌属无法通过G试验检测诊断,因为隐球菌具有厚壁包膜,且在免疫缺陷患者体内生长缓慢,导致假阴性[12]。
综上所述,血浆G试验试剂盒作为非培养技术对于真菌血流感染的早期诊断具有一定的价值。本研究使用的G试验试剂盒是目前国内覆盖较广的产品,虽然在灵敏度方面不突出,但在特异度方面尚可;通过其较高的阴性预测值,可以帮助临床排除非真菌血流感染。
| [1] |
ESCRIBANO P, RODRÍGUEZ-CRÉIXEMS M, SÁNCHEZ-CARRILLO C, MUÑOZ P, BOUZA E, GUINEA J. Endemic genotypes of Candida albicans causing fungemia are frequent in the hospital[J]. J Clin Microbiol, 2013, 51: 2118-2123. DOI:10.1128/JCM.00516-13 |
| [2] |
文艳, 刘爱胜, 张勇, 李伟. ICU危重病患者深部真菌感染血清中降钙素原和(1, 3)-β-D葡聚糖联合检测的临床意义[J]. 现代检验医学杂志, 2015, 30: 120-122. |
| [3] |
LI D, ZHANG W, ZHENG S, MA Z, ZHANG P, LIU Z. Surveillance study of candidemia in cancer patients in North China[J]. Med Mycol, 2013, 51: 378-384. DOI:10.3109/13693786.2012.727481 |
| [4] |
ARIAS S, DENIS O, MONTESINOS I, CHERIFI S, MIENDJE DEYI V Y, ZECH F. Epidemiology and mortality of candidemia both related and unrelated to the central venous catheter:a retrospective cohort study[J]. Eur J Clin Microbiol Infect Dis, 2017, 36: 501-507. DOI:10.1007/s10096-016-2825-3 |
| [5] |
张建芳, 徐修礼, 樊新, 孙怡群. 深部真菌感染患者血浆1-3-β-D葡聚糖检测的临床意义[J]. 中华医院感染学杂志, 2005, 15: 354-355. DOI:10.3321/j.issn:1005-4529.2005.03.040 |
| [6] |
左向华, 陈建魁, 于农, 金欣, 尹秀云, 宋世平, 等. 侵袭性真菌感染患者1, 3-β-D葡聚糖检测的临床价值[J]. 国际检验医学杂志, 2010, 31: 220-221, 223. DOI:10.3760/cma.j.issn.1673-4130.2010.03.005 |
| [7] |
周道银, 倪语星, 王明贵. 血流感染实验诊断与临床诊治[M]. 上海: 上海科学技术出版社, 2011: 6-7.
|
| [8] |
刘云, 黄晓春, 万玉香, 马炜, 李亚周, 秦琴. 临床真菌血流感染的菌株分布及耐药性分析[J]. 现代检验医学杂志, 2018, 33: 81-82, 86. |
| [9] |
GARNACHO-MONTERO J, DÍAZ-MARTÍN A, GARCÍA-CABRERA E, RUIZ PÉREZ DE PIPAÓN M, HERNÁNDEZ-CABALLERO C, LEPE-JIMÉNEZ J A. Impact on hospital mortality of catheter removal and adequate antifungal therapy in Candida spp. bloodstream infections[J]. J Antimicrob Chemother, 2013, 68: 206-213. DOI:10.1093/jac/dks347 |
| [10] |
LIU Y, KANG M, YE H, ZONG Z, LV X. Analysis on clinical characteristics and drug resistance of Candida parapsilosis bloodstream infections in West China Hospital, China, from 2012 to 2015[J]. J Mycol Med, 2018, 28: 222-226. DOI:10.1016/j.mycmed.2017.05.001 |
| [11] |
KEDZIERSKA A, KOCHAN P, PIETRZYK A, KEDZIERSKA J. Current status of fungal cell wall components in the immunodiagnostics of invasive fungal infections in humans:galactomannan, mannan and (1→3)-β-D-glucan antigens[J]. Eur J Clin Microbiol Infect Dis, 2007, 26: 755-766. DOI:10.1007/s10096-007-0373-6 |
| [12] |
张鹏, 李小宁, 欧成举. 血浆(1-3)-β-D葡聚糖检测对真菌感染的诊断价值[J]. 检验医学与临床, 2012, 9: 564-565. DOI:10.3969/j.issn.1672-9455.2012.05.026 |
| [13] |
FARAGGI D, REISER B. Estimation of the area under the ROC curve[J]. Stat Med, 2002, 21: 3093-3106. DOI:10.1002/sim.1228 |
| [14] |
ACOSTA J, CATALAN M, DEL PALACIO-PERÉZ-MEDEL A, LORA D, MONTEJO J C, CUETARA M S, et al. A prospective comparison of galactomannan in bronchoalveolar lavage fluid for the diagnosis of pulmonary invasive aspergillosis in medical patients under intensive care:comparison with the diagnostic performance of galactomannan and of (1→3)-β-D-glucan chromogenic assay in serum samples[J]. Clin Microbiol Infect, 2011, 17: 1053-1060. DOI:10.1111/j.1469-0691.2010.03357.x |
| [15] |
PERSAT F, RANQUE S, DEROUIN F, MICHEL-NGUYEN A, PICOT S, SULAHIAN A. Contribution of the (1→3)-β-D-glucan assay for diagnosis of invasive fungal infections[J]. J Clin Microbiol, 2008, 46: 1009-1013. DOI:10.1128/JCM.02091-07 |
| [16] |
宋敏, 向成玉, 杨葵, 吴泽才, 林雁.血浆1-3-β-D葡聚糖早期诊断深部真菌感染的临床价值[J/CD].中华临床医师杂志(电子版), 2015, 9: 3445-3447.
|
| [17] |
曾文新, 黄园, 邓郁, 温妙云, 韩永丽, 钟文宏, 等. 真菌(1, 3)-β-D葡聚糖检测在重症肺炎患者中真菌检测的临床价值[J]. 中华急诊医学杂志, 2016, 25: 659-662. DOI:10.3760/cma.j.issn.1671-0282.2016.05.023 |
| [18] |
CUENCA-ESTRELLA M, VERWEIJ P E, ARENDRUP M C, ARIKAN-AKDAGLI S, BILLE J, DONNELLY J P, et al. ESCMID* guideline for the diagnosis and management of Candida diseases 2012:diagnostic procedures[J]. Clin Microbiol Infect, 2012, 18(Suppl 7): 9-18. |
| [19] |
PAPPAS P G, KAUFFMAN C A, ANDES D R, CLANCY C J, MARR K A, OSTROSKY-ZEICHNER L, et al. Clinical practice guideline for the management of candidiasis: 2016 update by the Infectious Diseases Society of America[J/OL]. Clin Infect Dis, 2016, 62: e1-50. doi: 10.1093/cid/civ933.
|
| [20] |
吴真, 徐晓刚. 深部真菌病的实验诊断进展[J]. 中国感染与化疗杂志, 2014, 14: 82-85. |
| [21] |
刘春玉, 王红, 任爱民, 杜琨, 胡岚, 李世荣, 等. 血浆(1-3)-β-D葡聚糖诊断深部真菌感染的临床研究[J]. 中国真菌学杂志, 2012, 7: 207-210. DOI:10.3969/j.issn.1673-3827.2012.04.004 |
 2019, Vol. 40
2019, Vol. 40


