2. 中南大学湘雅三医院检验科, 长沙 410013
2. Department of Laboratory Medicine, The Third Xiangya Hospital, Central South University, Changsha 410013, Hunan, China
铜绿假单胞菌(Pseudomonas aeruginosa)是医院感染最常见的病原菌之一,尤其易感染免疫力低下的人群和囊性纤维化患者[1]。生物被膜是铜绿假单胞菌的主要毒力因子之一,可黏附在物体表面,进而造成严重的持续性感染。铜绿假单胞菌生物被膜感染的发生率和耐药性较高,现有的抗菌药物很难将其彻底去除[1]。研究铜绿假单胞菌生物被膜形成的分子机制,有助于寻找新的靶点,为防治生物被膜相关的难治性感染提供新的思路。
细菌能通过蛋白质分泌系统转运效应蛋白,与周围环境相互作用。Ⅵ型分泌系统(type Ⅵ secretion system,T6SS)是革兰阴性细菌中的一种重要的毒性因子分泌系统,与病原菌的致病性密切相关。溶血素共调节蛋白(hemolysin co-regulated protein,Hcp)由160个氨基酸构成,是典型的T6SS效应分子[2]。铜绿假单胞菌含有3种T6SS基因簇,分别编码Hcp1、Hcp2和Hcp3蛋白[3]。群体感应(quorum sensing,QS)系统是细菌根据生物被膜内的细胞密度来调控自身基因表达的信号系统,有研究发现QS系统抑制剂可抑制铜绿假单胞菌的生物被膜形成[4],并且铜绿假单胞菌QS系统对T6SS有重要的调控作用[5]。
本研究拟通过观察铜绿假单胞菌PAO1菌株的成熟阶段生物被膜菌与浮游菌中T6SS相关基因和QS系统相关基因表达水平的差异,探讨T6SS和QS系统在铜绿假单胞菌生物被膜形成中的作用。
1 材料和方法 1.1 菌株、试剂与仪器铜绿假单胞菌生物被膜阳性的模式菌株PAO1由南开大学乔明强教授惠赠。血琼脂平板培养基(上海科玛嘉微生物技术有限公司),96孔和6孔细胞培养板(加拿大JET公司),LB(Lurib-Bertani)液体培养基(北京陆桥技术股份有限公司),细菌总RNA提取试剂盒(美国Omega公司),反转录试剂盒、荧光定量PCR试剂盒TransStart Green qPCR SuperMix UDG(北京全式金生物技术有限公司)。PCR仪(美国Applied Biosystems公司),实时荧光定量PCR仪(德国Eppendorf公司)。
1.2 PAO1浮游菌和生物被膜菌制备 1.2.1 PAO1浮游菌制备将4 ℃保存的PAO1菌种接种于血琼脂平板培养基上,37 ℃培养18 h;挑取单个菌落接种到5 mL LB液体培养基中,半拧紧管盖,置于气浴恒温摇床上,37 ℃、160 r/min过夜培养18 h,获得浮游菌。
1.2.2 PAO1生物被膜菌制备将4 ℃保存的PAO1菌种接种于血琼脂平板培养基上,37 ℃培养18 h;挑取单个菌落接种到15 mL LB液体培养基中,半拧紧管盖,置于气浴恒温摇床上,37 ℃、160 r/min过夜培养18 h;调整菌液浓度至0.5麦氏浊度(1.5×108 CFU/mL),在6孔板中每孔加800 μL菌液和2.4 mL LB液体培养基,置于恒温培养箱中,37 ℃培养6 d成膜(生物被膜成熟阶段),其间每2 d用新鲜LB液体培养基换1次液。培养6 d后,可见6孔板的底部明显黏着一层膜状物,即为形成的生物被膜。弃去培养液,加入适量无菌生理盐水,轻轻震荡洗去浮游菌;再弃去液体,向每孔中加入少量生理盐水,用细胞刮刮下黏附在6孔板底部和壁上的生物被膜菌;最后将各孔的菌液混合,获得生物被膜菌的菌悬液。
1.3 各基因表达检测按照细菌总RNA提取试剂盒说明书,分别提取PAO1浮游菌和生物被膜菌的总RNA,将提取的总RNA用1.5%琼脂糖凝胶进行电泳,检测RNA完整性;用紫外分光光度法检测RNA的浓度及260 nm和280 nm处的光密度值并计算其比值(D260/D280)。使用反转录试剂盒将提取的总RNA反转录合成cDNA。以16S rRNA为内参基因,采用实时荧光定量PCR扩增浮游菌中T6SS相关基因Hcp1、Hcp2和Hcp3,QS系统相关基因LasR,胞外多糖相关多糖合成位点基因A(polysaccharide synthesis locus A,PslA)和菌膜基因A(pellicle A,PelA),以及Ⅳ型菌毛基因(pilus A,PilA)、鞭毛蛋白基因(flagellin C,FliC)。各基因实时荧光定量PCR引物序列及目的产物长度见表 1,引物由生工生物工程(上海)股份有限公司合成。以上所有实验过程均重复3次,根据3次实验结果中各目的基因和内参基因16S rRNA的Ct值,分别计算出PAO1浮游菌和生物被膜菌各基因的Ct均值和ΔCt值,进而根据2-ΔΔCt法计算出各目的基因的相对表达量。
|
|
表 1 实时荧光定量PCR引物序列及目的产物长度 Tab 1 Primer sequences for quantitative real-time PCR and the length of expected product |
1.4 统计学处理
采用SPSS17.0软件进行统计学分析,符合正态分布的计量资料以x ± s表示,两组间比较采用独立样本t检验。检验水准(α)为0.05。
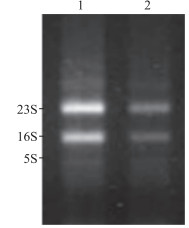
2 结果 2.1 RNA提取物完整性及纯度检测将提取的总RNA用1.5%琼脂糖凝胶进行电泳,可见23S和16S RNA两条明显条带,说明总RNA完整,未发生明显降解(图 1)。经紫外分光光度法检测RNA的纯度,其D260/D280均在1.9~2.0,提示RNA纯度良好。
|
图 1 PAO1浮游菌和生物被膜菌总RNA电泳图 Fig 1 Electrophoretogram of total RNA from PAO1 planktonic bacteria and biofilm bacteria 1: PAO1 planktonic bacteria; 2: PAO1 biofilm bacteria |
2.2 PAO1生物被膜菌的鉴定
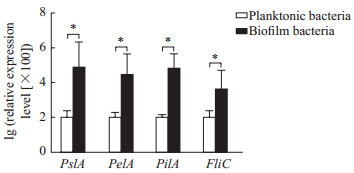
实时荧光定量PCR检测结果显示,各目的基因熔解曲线均为单一峰,说明引物的特异性良好。PAO1生物被膜菌PslA、PelA、PilA、FliC基因的相对表达量分别为浮游菌的714、274、604和42倍,差异均有统计学意义(P均<0.05,图 2)。提示制备的PAO1生物被膜菌形成了具有鞭毛和菌毛结构的成熟生物被膜。
|
图 2 PAO1浮游菌和生物被膜菌PslA、PelA、PilA和FliC基因的相对表达量比较 Fig 2 Comparison of expression levels of PslA, PelA, PilA and FliC in PAO1 planktonic bacteria and biofilm bacteria PslA: Polysaccharide synthesis locus A; PelA: Pellicle A; PilA: Pilus A; FliC: Flagellin C. *P < 0.05. n=3, x ± s |
2.3 T6SS相关基因和QS系统与PAO1生物被膜形成的关系
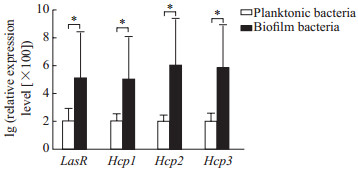
实时荧光定量PCR检测结果显示,PAO1生物被膜菌QS系统相关基因LasR的相对表达量为浮游菌的1 226倍,T6SS相关基因Hcp1、Hcp2和Hcp3基因的相对表达量分别是浮游菌的1 045、11 268和6 654倍,差异均有统计学意义(P均<0.05,图 3)。提示T6SS和QS系统与PAO1菌生物被膜的形成有关。
|
图 3 PAO1浮游菌和生物被膜菌LasR、Hcp1、Hcp2和Hcp3基因的相对表达量比较 Fig 3 Comparison of expression levels of LasR, Hcp1, Hcp2 and Hcp3 in PAO1 planktonic bacteria and biofilm bacteria Hcp: Hemolysin co-regulated protein. *P < 0.05. n=3, x ± s |
3 讨论
细菌的生物被膜是细菌黏附在惰性物体表面而形成的一种生长方式,其形成是一个动态发展的过程,具有稳定的生长周期。位于生物被膜里层的细菌处于休眠甚至静止的状态,生长代谢较为缓慢,生物学特性也与浮游菌显著不同,对环境的适应力和对外界压力的抵抗力明显增强[6]。
在细菌生物被膜形成过程中,多糖合成位点(polysaccharide synthesis locus,Psl)和菌膜(pellicle,Pel)基因群构成的两种操纵子与细胞外多糖合成密切相关。Psl基因群包括15个开放阅读框架,即PslA~PslO。Pel基因群包括7个开放阅读框架,即PelA~PelG [7]。在生物被膜形成的初始阶段,一些细菌细胞外多糖基因的转录就被激活,进而大量合成多糖复合物,在胞外形成能将细菌包绕在其中的基质,增强细菌的黏附力,促进生物被膜的形成和成熟[7]。铜绿假单胞菌中Ⅳ型菌毛位于菌体端部,由单一基因PilA编码,与细菌黏附力相关。FilC基因编码的功能性鞭毛蛋白(flagellin)具有较强的免疫原性,是铜绿假单胞菌鞭毛丝状部的主要蛋白。铜绿假单胞菌的运动性与其致病性密切相关,失去鞭毛的菌株不能黏附于物体表面,失去Ⅳ型菌毛的菌株只能在物体表面形成单层结构,而不能进一步形成成熟的蘑菇状生物被膜结构[8]。本研究结果显示,铜绿假单胞菌PAO1成熟阶段生物被膜菌的细胞外多糖相关基因PslA、PelA以及运动相关基因PilA、FliC的表达水平均高于浮游菌,与上述理论和相关研究相符。
LasR是QS系统中Las系统的组分之一。Las系统通过激活LasR和LasI蛋白质的转录,促进铜绿假单胞菌某些群感应信号因子的合成,进而调控蛋白酶、外毒素A和弹性蛋白酶等细菌毒力因子的表达[4]。本研究发现,铜绿假单胞菌PAO1成熟期生物被膜菌的LasR基因表达量明显高于浮游菌。目前公认的研究结果认为QS系统的激活是铜绿假单胞菌形成成熟的生物被膜所必需的因素[4],然而细菌是如何将这些外部信号转化为内部信号以及其中基因水平的调控网络仍不清楚。有研究发现,铜绿假单胞菌能通过与生物膜形成相关的酪氨酸磷酸酶(tyrosine phosphatase related to biofilm formation A,TpbA),将胞外QS信号和细菌细胞外多糖的产生及生物被膜的形成联系起来[9]。
T6SS与病原菌致病性相关,并在细菌识别异己的过程中发挥重要作用[10]。铜绿假单胞菌含有3种不同的T6SS基因簇,分别为H1-T6SS、H2-T6SS和H3-T6SS,各自在不同方面参与细菌与其他生物体的相互作用。近期Burkinshaw等[11]发现一种由H2-T6SS分泌的效应蛋白TOX-REase-5(TseT)与铜绿假单胞菌杀伤竞争性细菌的毒力密切相关。亦有研究发现鼠疫耶尔森菌中存在6种Hcp蛋白,分别在诱导细胞毒性和抗吞噬作用等方面发挥不同的作用[12]。本研究提示在铜绿假单胞菌PAO1生物被膜成熟阶段,3种T6SS相关基因Hcp1、Hcp2和Hcp3的表达水平均远高于浮游状态,说明T6SS可能在铜绿假单胞菌生物被膜的形成中起着重要作用。T6SS在转录水平的表达受QS系统调控因子LasR的调控,QS系统对铜绿假单胞菌3种T6SS的调控不同,然而在铜绿假单胞菌的Hcp分泌岛上并没有发现LasR的结合位点[13],因此,LasR通过何种途径来影响T6SS的表达尚有待进一步研究。混合传感器蛋白激酶RetS是一种多功能调控因子,是QS系统的重要组分,Moscoso等[14]研究表明,RetS基因缺失不仅能促进生物被膜的形成,还可诱导高水平的胞内第二信使环鸟苷二磷酸(cyclic di-guanylate,c-di-GMP)的产生,而c-di-GMP是细菌从浮游状态向定植状态转换过程中的传感器,高水平的c-di-GMP可促进生物被膜的形成;RetS基因的缺失还可抑制Ⅲ型分泌系统(type Ⅲ secretion system,T3SS)表达,上调T6SS的表达。Allsopp等[15]研究发现H2-T6SS和H3-T6SS的活性被QS系统的转录后调节因子RsmA和转录调节因子AmrZ抑制。此外,Mougous等[16]研究发现,一种磷酸化的丝氨酸-苏氨酸激酶PpkA参与了T6SS翻译后水平的调控,其可以调控Hcp1的分泌。因此,这些途径之间可能存在一定的关联,通过某些信号分子的调控,形成复杂的调控网络。
综上所述,铜绿假单胞菌中T6SS和QS系统与生物被膜的形成有着重要的关系,QS系统以及其他信号通路与T6SS之间可能存在着一个相互联系的复杂的调控网络,共同调控着细菌生物被膜的形成,其具体调控机制有待进一步研究。
| [1] |
DRISCOLL J A, BRODY S L, KOLLEF M H. The epidemiology, pathogenesis and treatment of Pseudomonas aeruginosa infections[J]. Drugs, 2007, 67: 351-368. DOI:10.2165/00003495-200767030-00003 |
| [2] |
MA J, SUN M, PAN Z, SONG W, LU C, YAO H. Three Hcp homologs with divergent extended loop regions exhibit different functions in avian pathogenic Escherichia coli[J/OL]. Emerg Microbes Infect, 2018, 7: 49. doi: 10.1038/s41426-018-0042-0.
|
| [3] |
DAS S, CHAUDHURI K. Identification of a unique IAHP (IcmF associated homologous proteins) cluster in Vibrio cholerae and other proteobacteria through in silico analysis[J]. In Silico Biol, 2003, 3: 287-300. |
| [4] |
KALAIARASAN E, THIRUMALASWAMY K, HARISH B N, GNANASAMBANDAM V, SALI V, JOHN J. Inhibition of quorum sensing-controlled biofilm formation in Pseudomonas aeruginosa by quorum-sensing inhibitors[J]. Microb Pathog, 2017, 111: 99-107. DOI:10.1016/j.micpath.2017.08.017 |
| [5] |
LESIC B, STARKEY M, HE J, HAZAN R, RAHME L G. Quorum sensing differentially regulates Pseudomonas aeruginosa type Ⅵ secretion locus Ⅰ and homologous loci Ⅱ and Ⅲ, which are required for pathogenesis[J]. Microbiology, 2009, 155(Pt 9): 2845-2855. |
| [6] |
MANN E E, WOZNIAK D J. Pseudomonas biofilm matrix composition and niche biology[J]. FEMS Microbiol Rev, 2012, 36: 893-916. DOI:10.1111/j.1574-6976.2011.00322.x |
| [7] |
AL-WRAFY F, BRZOZOWSKA E, GÓRSKA S, GAMIAN A. Pathogenic factors of Pseudomonas aeruginosa-the role of biofilm in pathogenicity and as a target for phage therapy[J]. Postepy Hig Med Dosw (Online), 2016, 70: 78-91. |
| [8] |
O'TOOLE G A, KOLTER R. Flagellar and twitching motility are necessary for Pseudomonas aeruginosa biofilm development[J]. Mol Microbiol, 1998, 30: 295-304. DOI:10.1046/j.1365-2958.1998.01062.x |
| [9] |
UEDA A, WOOD T K. Connecting quorum sensing, c-di-GMP, pel polysaccharide, and biofilm formation in Pseudomonas aeruginosa through tyrosine phosphatase TpbA (PA3885)[J/OL]. PLoS Pathog, 2009, 5: e1000483. doi: 10.1371/journal.ppat.1000483.
|
| [10] |
GALLIQUE M, BOUTEILLER M, MERIEAU A. The Type Ⅵ secretion system: a dynamic system for bacterial communication?[J/OL]. Front Microbiol, 2017, 8: 1454. doi: 10.3389/fmicb.2017.01454.
|
| [11] |
BURKINSHAW B J, LIANG X, WONG M, LE A N H, LAM L, DONG T G. A type Ⅵ secretion system effector delivery mechanism dependent on PAAR and a chaperone-co-chaperone complex[J]. Nat Microbiol, 2018, 3: 632-640. DOI:10.1038/s41564-018-0144-4 |
| [12] |
ANDERSSON J 1, SHA J, EROVA T E, FITTS E C, PONNUSAMY D, KOZLOVA E V, et al. Identification of new virulence factors and vaccine candidates for Yersinia pestis[J/OL]. Front Cell Infect Microbiol, 2017, 7: 448. doi: 10.3389/fcimb.2017.00448.
|
| [13] |
SANA T G, HACHANI A, BUCIOR I, SOSCIA C, GARVIS S, TERMINE E, et al. The second type Ⅵ secretion system of Pseudomonas aeruginosa strain PAO1 is regulated by quorum sensing and Fur and modulates internalization in epithelial cells[J]. J Biol Chem, 2012, 287: 27095-27105. DOI:10.1074/jbc.M112.376368 |
| [14] |
MOSCOSO J A, MIKKELSEN H, HEEB S, WILLIAMS P, FILLOUX A. The Pseudomonas aeruginosa sensor RetS switches type Ⅲ and type Ⅵ secretion via c-di-GMP signalling[J]. Environ Microbiol, 2011, 13: 3128-3138. DOI:10.1111/j.1462-2920.2011.02595.x |
| [15] |
ALLSOPP L P, WOOD T E, HOWARD S A, MAGGIORELLI F, NOLAN L, WETTSTADT S, et al. RsmA and AmrZ orchestrate the assembly of all three type Ⅵ secretion systems in Pseudomonas aeruginosa[J]. Proc Natl Acad Sci USA, 2017, 114: 7707-7712. DOI:10.1073/pnas.1700286114 |
| [16] |
MOUGOUS J D, GIFFORD C A, RAMSDELL T L, MEKALANOS J J. Threonine phosphorylation post-translationally regulates protein secretion in Pseudomonas aeruginosa[J]. Nat Cell Biol, 2007, 9: 797-803. DOI:10.1038/ncb1605 |
 2019, Vol. 40
2019, Vol. 40


