结核病是一种传染性疾病,由机体被结核分枝杆菌(Mycobacterium tuberculosis,TB)感染引起,每年全球感染人数近1 000万,有超过100万人因结核病死亡[1]。我国是结核病高风险国家,结核病的诊断对于疫情的控制至关重要。目前,TB感染的诊断方法主要有影像学、抗酸染色镜检、TB培养以及结核菌素皮内敏感试验(tuberculin skin test,TST),但这些传统检测方法普遍存在灵敏度差、特异度低、测试周期长、需要回访等缺点[2-3]。血清学检测技术(测试血清中TB特异抗体或抗原)虽然操作简便、能够快速获知结果,但因容易产生大量的误诊、漏诊而在2011年被世界卫生组织正式叫停,进而一种基于T淋巴细胞介导免疫应答的全新体外诊断技术得到推荐,即γ干扰素释放试验(interferon γ release assay,IGRA)[4]。IGRA采用两种TB特异的重组蛋白[早期分泌靶向抗原(early secretory antigenic target,ESAT-6)和培养滤液蛋白10(culture filtrate protein 10,CFP-10)]体外刺激T淋巴细胞,如果受试者曾经感染过TB,其体内存在的T淋巴细胞再次受到该类抗原刺激时,将增殖分化并释放大量γ干扰素(interferon γ,IFN-γ),通过检测IFN-γ含量判断机体是否存在TB感染。目前,基于IGRA检测TB感染的市售主流产品的检测技术主要分为酶联免疫斑点试验(enzyme-linked immunospot assay,ELISPOT)和酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)两种,这两种方法操作流程相对烦琐、耗时较长。有研究发现,市售IGRA产品在结核病诊断中的准确度不足[4],有待进一步改进。本研究旨在利用流式荧光免疫分析法快速高效的特点[5],建立一种基于IGRA原理检测TB感染的新方法。
1 材料和方法 1.1 主要试剂及仪器Luminex 200多功能流式点阵仪为美国Luminex公司产品,EliSpot Classic免疫斑点读数仪为德国AID公司产品,Multiskan酶标仪为美国Thermo公司产品。植物凝集素(phytagglutinin,PHA)购自美国Sigma公司,AIM-Ⅴ培养基购自美国Gibco公司,万泰TB-IGRA试剂盒购自北京万泰生物药业股份有限公司,T淋巴细胞斑点试验(T lymphocyte spot test,T-SPOT)试剂盒购自上海复星医药(集团)股份有限公司,QuantiFERON-TB Gold(QFT)试剂盒购自德国Qiagen公司,IFN-γ纯品、TB特异混合多肽(ESAT-6、CFP-10)、包被抗体、标记抗体、荧光编码微球及藻红蛋白(R-phycoerythrin,RPE)均由上海透景生命科技股份有限公司提供。
1.2 标本来源收集2015年1月13日至2016年11月21日海军军医大学(第二军医大学)长海医院实验诊断科120例临床全血标本,通过查阅临床诊断资料证实其中57例为确诊TB感染阳性的全血标本,63例为阴性对照全血标本,采用流式荧光免疫分析法进行检测。收集2016年7月13日至2016年9月21日长海医院实验诊断科133例临床全血标本,分别采用T-SPOT试剂盒常规检测及流式荧光免疫分析法检测;收集2017年5月22日至2017年6月7日长海医院实验诊断科47例临床全血标本,分别采用QFT试剂盒及流式荧光免疫分析法检测;收集2017年5月15日至2017年11月30日长海医院实验诊断科212例临床全血标本,分别使用万泰TB-IGRA试剂盒及流式荧光免疫分析法检测。本研究通过海军军医大学(第二军医大学)长海医院伦理委员会审批。
1.3 基于IGRA的流式荧光免疫分析法的建立 1.3.1 试剂制备将PHA和TB特异性混合多肽使用AIM-Ⅴ培养基稀释,配制成阳性对照培养液及检测培养液;将1株IFN-γ单克隆抗体包被在荧光编码微球上,制成固相结合物工作液;将另1株IFN-γ单克隆抗体与RPE偶联,制成发光结合物工作液;使用含牛血清白蛋白的磷酸盐缓冲液(phosphate buffer saline,PBS)将IFN-γ纯品配制成6个浓度梯度(0、10、50、200、600、1 000 pg/mL)的校准品。
1.3.2 全血刺激孵育使用肝素化抗凝采血管采集全血标本,以每管1 mL分别加入N、T、P 3个培养管中(N管为本底对照培养管,T管为添加了TB特异性混合多肽的检测培养管,P管为添加了非特异性刺激剂PHA的阳性对照培养管),充分混匀后,迅速置于37 ℃恒温培养箱中孵育18~24 h。
1.3.3 流式荧光免疫分析在反应板中每孔加入25 μL固相结合物工作液和25 μL样品,加盖封板纸后充分振荡混匀;37 ℃避光反应15 min;孵育结束后,将反应板放置在磁性分离板上1 min,甩弃反应上清,并使用洗涤液洗涤1次,分离1 min后甩弃反应上清;加入25 μL发光结合物工作液,加盖封板纸后充分振荡混匀;37 ℃避光反应15 min;孵育结束后,将反应板放置在磁性分离板上1 min,甩弃反应上清,并使用洗涤液洗涤1次,分离1 min后甩弃反应上清;加入100 μL重悬液,在Luminex 200多功能流式点阵仪上读取每孔荧光编码微球信号强度。
1.3.4 IFN-γ释放浓度计算以平均荧光信号强度(mean fluorescence intensity,MFI)为纵坐标,以校准品浓度作为横坐标,通过五参数拟合法进行拟合,生成剂量反应曲线(图 1)。根据该曲线计算得到的IFN-γ浓度即为原标本中不同培养环境下IFN-γ的释放浓度。
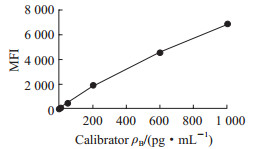
|
图 1 流式荧光免疫分析法检测IFN-γ的校准曲线 Fig 1 Calibration curve of IFN-γ as detected by flow cytometry fluorescence immunoassay IFN-γ: Interferon γ; MFI: Mean fluorescence intensity |
1.4 基于IGRA的流式荧光免疫分析法的方法学评价 1.4.1 线性范围
收集IFN-γ高值(1 000 pg/mL)、低值(2 pg/mL)标本,按美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)文件定量检测系统线性评价方法(EP6-A)[6],将高值和低值标本按一定比例相互混合成9个浓度(2.0、12.0、51.9、101.8、201.6、401.2、600.8、800.4、1 000 pg/mL)的样品,用流式荧光免疫分析法检测IFN-γ浓度,每个浓度的样品重复检测2次,计算平均值。采用线性、二次多项式及三次多项式模型对稀释浓度及检测均值进行回归分析。
1.4.2 最低检测限将20个空白孔加入不含IFN-γ的抗原稀释液(含牛血清白蛋白的PBS),然后分别测定其荧光信号值,计算其平均值(x)及标准差(s)。以荧光信号值x+2s对应的IFN-γ浓度作为最低检测限。
1.4.3 重复性使用100 pg/mL和500 pg/mL 2个浓度的标本,采用流式荧光免疫分析法重复检测20次,计算批内检测结果的平均值x、标准差s及变异系数(coefficient of variation,CV)。
1.4.4 回收率选择1例常规检测标本,分为4份,向其中3份标本中加入不同浓度的IFN-γ标准物质(赋过值的IFN-γ抗原纯品),1份标本加入等体积的基质溶液,制成3份不同浓度(30、100、300 pg/mL)的回收样品及1份基础样品。对这些样品进行3次重复分析,计算回收率。
1.4.5 抗干扰能力评估按照美国国家临床实验室标准委员会(National Committee for Clinical Laboratory Standards,NCCLS)制定的EP7-P干扰实验评价方案[7],在高低2个浓度(206.2、45.1 pg/mL IFN-γ)的样品中加入不同浓度的三酰甘油(25、50、75、100 mg/mL)、胆红素(0.2、0.4、0.6、0.8 mg/mL)和血红蛋白(5、10、15、20 mg/mL)模拟干扰,以相对偏差分析检测方法对这3种常见干扰物质的抗干扰能力。
1.5 基于IGRA的流式荧光免疫分析法的诊断价值评估收集120例临床全血标本,其中57例为确诊TB感染阳性标本,63例为阴性对照标本,使用流式荧光免疫分析法检测,对检测结果作受试者工作特征(receiver operating characteristic,ROC)曲线,获得最佳截断值,计算灵敏度和特异度。
1.6 基于IGRA的流式荧光免疫分析法与市售试剂盒检测一致性比较收集133例临床全血标本,分别使用T-SPOT试剂盒和流式荧光免疫分析法检测,比较两种方法检测结果的一致性;收集47例临床全血标本,分别使用QFT试剂盒和流式荧光免疫分析法检测,比较两种方法检测结果的一致性;收集212例临床全血标本,分别使用万泰TB-IGRA试剂盒和流式荧光免疫分析法检测,比较两种方法检测结果的一致性。
1.7 统计学处理采用SPSS 18.0软件与GraphPad Prism 5软件进行数据统计分析与图形处理。采用线性、二次多项式及三次多项式模型对稀释浓度及检测均值进行回归分析;采用ROC曲线评估流式荧光免疫分析法的诊断效能,选取约登指数最大时的浓度作为最佳截断值,计算灵敏度和特异度;绘制四格表,计算阴性符合率、阳性符合率和Kappa系数。检验水准(α)为0.05。
2 结果 2.1 方法学评估结果回归分析结果显示二次多项式及三次多项式的非线性系数无统计学意义(P值分别为0.684和0.361),线性回归系数有统计学意义(P<0.001),精密度评价测量相对误差为0.07%,可确定流式荧光免疫分析法检测IFN-γ在2~1 000 pg/mL范围内呈线性,此时R2=0.999。IFN-γ的最低检测限为0.3 pg/mL;重复性分析显示100 pg/mL和500 pg/mL 2个浓度下CV分别为4.58%和2.46%;回收试验显示30、100、300 pg/mL回收样品的回收率分别为94.9%、104.0%、95.1%,平均回收率为98.0%;抗干扰能力试验结果显示样品中三酰甘油≤50 mg/mL、胆红素≤0.6 mg/mL、血红蛋白≤10 mg/mL时对流式荧光免疫分析法检测结果无干扰(图 2)。
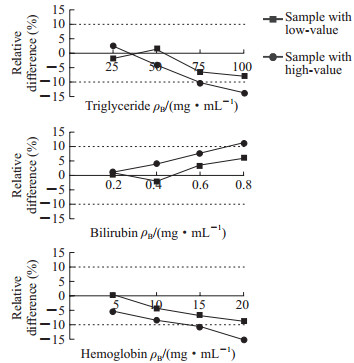
|
图 2 流式荧光免疫分析法检测IFN-γ的抗干扰实验结果 Fig 2 Anti-interference test results of IFN-γ as detected by flow cytometry fluorescence immunoassay FN-γ: Interferon γ |
2.2 诊断价值评估结果
收集120例临床全血标本,其中57例确诊TB感染阳性标本,63例阴性对照标本,使用流式荧光免疫分析法检测,对检测结果进行ROC曲线分析,结果显示曲线下面积(area under curve,AUC)为0.868 8(图 3),最佳截断值在9.8~10.1 pg/mL之间,取最佳截断值为10 pg/mL,此时灵敏度为82.46%,特异度为87.30%。
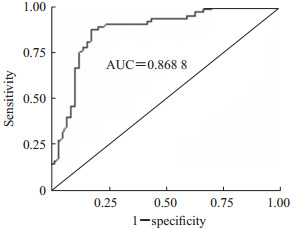
|
图 3 流式荧光免疫分析法检测IFN-γ诊断TB感染的ROC曲线 Fig 3 ROC curve of IFN-γ as detected by flow cytometry fluorescence immunoassay for diagnosis of TB infection IFN-γ: Interferon γ; TB: Mycobacterium tuberculosis; ROC: Receiver operating characteristic; AUC: Area under curve |
2.3 一致性检验结果
流式荧光免疫分析法和3种市售试剂盒的检测结果见表 1,一致性检验结果见表 2。市售T-SPOT试剂盒与流式荧光免疫分析法检测结果的阳性符合率为97.2%,阴性符合率为90.7%,总符合率为92.5%,Kappa系数为0.822;市售QFT试剂盒与流式荧光免疫分析法检测结果的阳性符合率为80.0%,阴性符合率为84.4%,总符合率为83.0%,Kappa系数为0.622;市售万泰TB-IGRA试剂盒与流式荧光免疫分析法检测结果的阳性符合率为76.4%,阴性符合率为88.5%,总符合率为85.4%,Kappa系数为0.630。
|
|
表 1 流式荧光免疫分析法和3种市售试剂盒的检测结果比较 Tab 1 Comparison of the results of flow cytometry fluorescence immunoassay with 3 commercially available reagents |
|
|
表 2 流式荧光免疫分析法与3种市售试剂盒检测结果的一致性分析 Tab 2 Consistency analysis between flow cytometry fluorescence immunoassay and 3 commercially available reagents |
3 讨论
目前市场上利用IGRA检测TB感染的主要产品有T-SPOT、QFT和TB-IGRA等,其中T-SPOT基于ELISPOT法以计数阳性细胞数目的方法来判定结果,细胞计数可以使用显微镜人工计数,此法存在工作量大、人员主观影响因素多、结果重复性差等缺点,若使用酶联斑点图像分析仪,相对减少了工作量,但价格相对昂贵,而且整个细胞培养的过程对人员操作要求高、操作烦琐;而QFT和TB-IGRA是基于ELISA法检测IFN-γ,其方法较T-SPOT结果判断相对简单,但ELISA孵育时间较长,使得检测IFN-γ过程就需要3 h以上,而且灵敏度和特异度较T-SPOT略差一些。
流式荧光免疫分析法整合了荧光编码微球、激光分析、应用流体学及高速数字信号处理等多项新技术,具有高通量、高敏感性、快速准确和仅需极少标本量等优势,可用于免疫分析、核酸研究、酶学分析、受体和配体识别分析等多领域的研究[5]。本研究将2株IFN-γ单克隆抗体分别连接在荧光编码微球及RPE上,形成双抗体夹心的反应模式,用以检测经TB特异性抗原刺激的全血标本产生的IFN-γ,检测过程可在1 h内完成,而且操作较T-SPOT、QFT和TB-IGRA等方法简单,影响因素也少。
本研究根据CLSI文件定量检测系统线性评价方法(EP6-A)[6],确定流式荧光免疫分析法检测IFN-γ的线性范围为2~1 000 pg/mL,最低检测限为0.5 pg/mL;而市售同类产品万泰TB-IGRA试剂盒的检测线性范围为12.5~400 pg/mL,最低检测限为2 pg/mL;T-SPOT试剂盒通过判读斑点数来判断阳性和阴性,主要用于定性分析;QFT试剂盒虽然能够利用ELISA技术测出相应的IFN-γ活性值(U/mL),但因其影响因素较多,因此其结果的判断仅是将加入TB抗原血浆的TB管与加入对照血浆的Nil管对比来判断阳性和阴性,无法精确定量。由此可见,流式荧光免疫分析法检测线性范围更宽、最低检测限更低,且操作流程简化,减少了部分高浓度标本重新稀释检测的过程,节约了检测时间及试剂成本。从本实验的回收率数据来看,平均回收率达98.0%,说明该方法是可行的。对检测线性范围内100 pg/mL和500 pg/mL 2个浓度的标本进行了重复性实验,其中100 pg/mL标本的CV为4.58%,500 pg/mL标本的CV为2.46%,说明该方法的重复性好,精密度较高。从抗干扰实验结果看,血液样品的三酰甘油≤50 mg/mL、胆红素≤0.6 mg/mL、血红蛋白≤10 mg/mL时,对IFN-γ检测结果无干扰。
韦海旭等[2]对57例临床标本分析发现T-SPOT试剂的灵敏度为83.3%,特异度为96.4%;鲍磊等[8]研究发现QFT试剂在成人中诊断灵敏度为78.57%,特异度为84.62%;万泰TB-IGRA试剂说明书给出对1 228例有效标本的灵敏度为78.3%,特异度为76.2%;本研究采用流式荧光免疫分析法对120例临床全血标本进行检测,发现以最佳截断值10 pg/mL为标准时,灵敏度为82.46%,特异度为87.30%。本研究还对流式荧光免疫分析法与市售同类产品的检测一致性进行了验证,结果显示流式荧光免疫分析法与T-SPOT试剂盒、QFT试剂盒和万泰TB-IGRA试剂盒均具有较高的一致性,总符合率分别为92.5%、83.0%和85.4%,Kappa系数分别为0.822、0.622和0.630。从上述数据可以看出,流式荧光免疫分析法检测的灵敏度及特异度与市售同类产品相当。说明本研究建立的新方法检测准确度达到了市售同类产品的要求,并且在最低检测限、检测范围、精密度、操作流程、检测时间等方面具有明显的优势,有利于在各级检验机构推广。
近年来,一些新的TB感染相关指标被报道,如IFN-γ诱导蛋白10(IFN-γ inducible protein 10,IP-10)。Wang等[9]研究发现全血结核特异性的IP-10检测可能成为结核病辅助诊断的指标之一;Jeong等[10]研究表明IP-10在鉴别活动性肺结核与潜伏性肺结核时具有重要意义;Qiu等[11]研究表明IP-10是一种有发展前景的诊断潜伏性TB感染的生物标志物。因此,可以利用流式荧光免疫分析法多指标联合检测的优势,在不增加检测时间的情况下,实现IFN-γ、IP-10甚至更多指标的同时检测,进一步提高TB感染诊断的准确度,为结核病的防治提供依据。
| [1] |
World Health Organization. Global tuberculosis report 2017[R]. Geneva: WHO Press, 2017: 1-2.
|
| [2] |
韦海旭, 席薇莲, 陆利欢, 陈健. γ-干扰素释放分析T-SPOT.TB在结核性疾病中的诊断价值[J]. 临床肺科杂志, 2012, 17: 1439-1440. DOI:10.3969/j.issn.1009-6663.2012.08.039 |
| [3] |
丰玫玫, 苏文琴. 结核分枝杆菌诊断技术的发展及目前临床应用的新型诊断技术产品分析[J]. 中国医药科学, 2012, 2: 26-28. |
| [4] |
WHITWORTH H S, BADHAN A, BOAKYE A A, TAKWOINGI Y, REES-ROBERTS M, PARTLETT C, et al. Clinical utility of existing and second-generation interferon-γ release assays for diagnostic evaluation of tuberculosis:an observational cohort study[J]. Lancet Infect Dis, 2019, 19: 193-202. DOI:10.1016/S1473-3099(18)30613-3 |
| [5] |
姚见儿. Luminex高通量检测技术的应用和挑战[J]. 临床检验杂志, 2010, 28: 250-251. |
| [6] |
Clinical and Laboratory Standards Institute. Evaluation of the linearity of quantitative measurement procedures: a statistical approach; approved guideline. CLSI document EP6-A[S]. Wayne: CLSI, 2003.
|
| [7] |
National Committee for Clinical Laboratory Standards. Interference testing in clinical chemistry; proposed guideline. Proposed Guideline, NCCLS document 1986; EP7-P[S]. Wayne: NCCLS, 1986.
|
| [8] |
鲍磊, 李涛, 卢水华. 全血γ干扰素释放试验在儿童和成人中的结核病诊断价值[J]. 微生物与感染, 2014, 9: 21-27. |
| [9] |
WANG Y, YANG Y, LI H, LIANG Y, LIU J, YU T, et al. Evaluation of a whole blood chemiluminescent immunoassay of interferon-gamma inducible protein 10(IP-10) for diagnosis of tuberculosis patients[J]. Clin Lab, 2016, 62(1/2): 165-172. |
| [10] |
JEONG Y H, HUR Y G, LEE H, KIM S, CHO J E, CHANG J, et al. Discrimination between active and latent tuberculosis based on ratio of antigen-specific to mitogen-induced IP-10 production[J]. J Clin Microbiol, 2015, 53: 504-510. DOI:10.1128/JCM.02758-14 |
| [11] |
QIU X, TANG Y, YUE Y, ZENG Y, LI W, QU Y, et al. Accuracy of interferon-γ-induced protein 10 for diagnosing latent tuberculosis infection:a systematic review and meta-analysis[J]. Clin Microbiol Infect, 2019, 25: 667-672. DOI:10.1016/j.cmi.2018.12.006 |
 2019, Vol. 40
2019, Vol. 40


