流式荧光免疫分析(flow cytometry fluorescence immunoassay)又称悬浮阵列(suspension bead array)或液态芯片(liquid chip),是利用荧光编码微球作为载体,共价交联针对被检物的抗原、抗体或探针,通过两束激光分别识别编码微球和检测报告分子的荧光强度,可以检测同一样品中的多个不同分子[1]。流式荧光免疫分析技术检测平台因具有高通量的优点,在肿瘤标志物、自身抗体、过敏原和病原微生物等方面的检测均得到广泛应用[2]。糖类抗原242(carbohydrate antigen 242,CA242)是一种唾液酸化的糖脂类抗原,在胰腺、结直肠组织的恶性肿瘤中常呈高表达,临床上被用作胰腺癌、结直肠癌的辅助诊断及预后判断[3-4]。我们在对Luminex流式荧光免疫分析法测定血清CA242的性能评价过程中发现,测定时环境温度与定标时环境温度的差异会对检测结果造成较明显的影响,现分析报告如下。
1 材料和方法 1.1 仪器与试剂TesmiF3999全自动加样仪(上海透景生命科技股份有限公司),Luminex-200多功能流式点阵分析仪(美国Luminex公司)。CA242定量检测试剂盒(流式荧光免疫分析法,上海透景生命科技股份有限公司),批号为2018A001,线性范围为6~500 U/mL。室内质控品(特殊肿瘤)购自上海市临床检验中心。
1.2 标本准备按试剂说明书的参考范围(<20 U/mL),取CA242中值和高值血清标本各1例;随机选择涵盖检测线性范围的高、中、低值临床标本49例。上述标本来源于51例患者,其中男26例、女25例,年龄为14~83岁(中位年龄为59岁)。本研究经海军军医大学(第二军医大学)长海医院伦理委员会审批。
1.3 检测结果偏倚分析按照CA242定量检测试剂盒的测定参数进行设置和检测,用试剂盒配套的定标品进行定标,定标通过(Luminex-200多功能流式点阵分析仪检测温度为25 ℃),室内质控在控。取临床CA242中值水平和高值水平标本各1例,作为检测标本。将CA242检测仪器定标时的环境温度设定为25 ℃,通过室内空调调节环境温度至18.3、20.1、21.5、22.2、24.1、25.0、25.4、26.5、27.4、28.5、30.0 ℃(仪器说明书要求工作温度为15~30 ℃),共11个环境温度进行检测,每例标本重复检测5次,检测结果以平均值表示。以中值和高值标本在环境温度为25 ℃(定标时环境温度)时的测定平均值为参比值,分别将不同环境温度下检测结果的平均值与参比值进行比较,计算偏倚(%)。按检测系统生产厂家说明书的要求偏倚不超过10%为通过,统计不合格情况。
1.4 临床标本测定将49例临床标本在环境温度为20、25和30 ℃时分别进行检测,检测方法同前,每例标本测定1次。以环境温度25 ℃的测定结果为参比值,对49例临床标本在环境温度20 ℃和30 ℃下的测定结果进行比较。
1.5 精密度验证将环境温度控制在(25 ± 1)℃,参照国家卫生行业标准(WS/T 492-2016)要求[5],使用2个浓度水平的质控品,每个浓度重复测定3次,连续测定5 d,计算其精密度,用变异系数(coefficient of variation,CV)表示。
1.6 统计学处理采用SPSS 19.0软件进行统计学分析。重复测定的计量资料以x ± s表示。49例临床标本在环境温度20 ℃和30 ℃下的测定结果与参比值的比较采用Wilcoxon秩和检验。两组变量之间的相关性分析采用一元线性回归分析。检验水准(α)为0.05。
2 结果 2.1 不同环境温度检测结果的偏倚与定标时环境温度(25 ℃)的检测结果相比,高值标本和中值标本在环境温度18.3 ℃和20.1 ℃下的检测结果均出现不同程度的负偏倚,中值标本在18.3 ℃和20.1 ℃时测定结果的偏倚均超出10%,高值标本在18.3 ℃时测定结果的偏倚为29.4%,超过了检测系统允许的偏倚范围;其余环境温度点测定的结果均显示了较好的重复性,偏倚均未超出10%(表 1)。环境温度升高时对检测结果的影响较小,在温度升高5 ℃时也同时产生负性偏倚,但均未超出10%。
|
|
表 1 不同环境温度下中值和高值标本流式荧光免疫分析法测定CA242检测结果的偏倚 Tab 1 Biases of CA242 results of median- and high-value samples measured by flow cytometry fluorescence immunoassay at different ambient temperatures |
2.2 不同环境温度对临床标本检测结果的影响
以49例临床标本在环境温度为25 ℃时的检测结果为参比值,将相同的标本分别在环境温度为20 ℃和30 ℃时的检测结果与参比值进行比较,结果显示20 ℃和30 ℃下的检测结果与参比值相比均降低(Z=-6.093,P<0.001;Z=-6.093,P<0.001)。分析环境温度为20 ℃和30 ℃时的检测结果与参比值的相关性,结果显示环境温度为20 ℃的检测结果与参比值有很好的相关性(图 1A),回归方程为Y=0.676 9 X + 0.374 7(R2=0.990 5,P<0.001),在医学决定水平处(20 U/mL)的偏倚为-30.4%;环境温度为30 ℃时,检测结果与参比值亦有很好的相关性(图 1B),回归方程为Y=0.896 6 X + 0.227 0(R2=0.999 4,P<0.001),在医学决定水平处(20 U/mL)的偏倚为-9.2%,但线性回归方程的斜率减小,致CA242水平越高的标本负偏倚越明显。
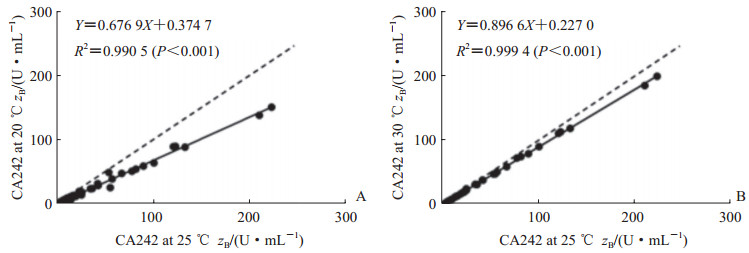
|
图 1 不同环境温度对49例临床标本检测结果的影响 Fig 1 Effect of different ambient temperatures on the test results of 49 clinical samples A: Correlation of the measurement results at ambient temperature of 20 ℃ and 25 ℃; B: Correlation of the measurement results at ambient temperature of 30 ℃ and 25 ℃. CA242: Carbohydrate antigen 242 |
2.3 精密度验证结果
通过对环境温度的严格控制,检测结果显示了较好的稳定性。浓度为46.4 U/mL的室内质控品批内CV为2.19%,批间CV为3.75%;浓度为130.6 U/mL的室内质控品批内CV为1.32%,批间CV为2.12%。
3 讨论流式荧光免疫分析法具有检测通量高、标本用量少、检测速度快、灵敏度高且线性范围广等优点[6-7]。Luminex技术平台作为流式荧光免疫分析技术的一个开放式平台,已有体外诊断研发公司基于此技术开发体外诊断试剂。研究显示,上海透景生命科技股份有限公司开发的CA242等检测试剂盒分析性能指标良好,具有较高的检测效率[8]。TesmiF3999全自动加样仪和配套Luminex-100系统实现了加样、孵育、检测的自动化,减少了了人工操作的步骤。进行多点定标后,同一批号的试剂盒在较长时间内都可使用,比较稳定。
基于免疫学原理的检测方法可受多种因素影响,如异嗜性抗体、类风湿因子、“Hook效应”等,Luminex技术平台同样也有相关报道[9-10],但环境温度的变化是否会对该检测系统的检测结果产生影响仍不明确。本研究在不同的环境温度条件下测定中值和高值血清标本CA242水平,以评价环境温度变化对检测结果的影响。结果发现,以定标时环境温度25 ℃测定的结果为参比值,环境温度降低4 ℃以上时,检测结果可出现明显的负偏倚,影响该检测系统的分析性能。对49例涵盖高、中、低值临床标本的检测结果也显示,环境温度为20 ℃和30 ℃条件下测定的结果与25 ℃条件下测定的参比值相比产生了显著的负偏倚,检测结果的差异具有统计学意义。这些负偏倚可能使高于参考区间的检测报告出现假性降低甚至落入参考区间内,也可能使含有高水平靶抗原的标本检测结果显著负偏离实际水平,从而严重影响临床诊治。
环境温度的改变会对Luminex技术平台的检测结果产生明显的影响,究其原因,我们认为可能与以下两点有关:(1)不同温度下抗原和抗体结合的效率不同,低温时结合效率降低;(2)温度过低或过高时荧光测定值发生偏差。Luminex-200系统作为开放的检测平台,仪器暴露于室温中,但TesmiF3999全自动加样仪具有独立的温浴模块,实时控制温度,因此在进行荧光检测前不受室温的影响,受环境温度影响的环节主要是最后的荧光检测。杨恩环和周宇琼[8]使用流式荧光免疫分析法测定CA242等肿瘤标志物时,每批测定均进行标准品定标,这样可以使定标时环境温度与标本检测时完全一致,避免环境温度对检测结果的影响。TesmiF3999全自动加样系统一次定标后,定标曲线可供同批号试剂多批次临床标本检测使用,较为方便,且节约成本。然而,由于多批检测临床标本,检测时的环境温度如果不是人为控制,较难完全与定标时的环境温度一致,使用同一定标曲线就会产生较大的系统误差。Luminex-200多功能流式点阵分析仪本身有较灵敏的温度检测系统,可实时显示荧光检测时的温度,仪器也能记录定标时温度。当我们将环境温度严格控制在定标时环境温度± 1 ℃范围内时,检测结果显示了较好的稳定性。因此,在使用此类技术平台检测临床标本测定时,应对环境温度严格控制,以获得稳定的检测结果。
| [1] |
VIGNALI D A. Multiplexed particle-based flow cytometric assays[J]. J Immunol Methods, 2000, 243(1/2): 243-255. |
| [2] |
张立营, 刘国凤, 李克峰. 液相芯片技术在医学检验诊断中的应用[J]. 实用医药杂志, 2016, 33: 179-180. |
| [3] |
DOU H, SUN G, ZHANG L. CA242 as a biomarker for pancreatic cancer and other diseases[J]. Prog Mol Biol Transl Sci, 2019, 162: 229-239. DOI:10.1016/bs.pmbts.2018.12.007 |
| [4] |
于海涛, 曲义坤, 于海波, 赵斌, 李晶, 赵晓莲. 外周血内基质金属蛋白酶-7、糖类抗原242在直肠癌诊断及术后评估中的价值[J]. 中国老年学杂志, 2018, 38: 2098-2100. DOI:10.3969/j.issn.1005-9202.2018.09.021 |
| [5] |
中华人民共和国国家卫生和计划生育委员会.临床检验定量测定项目精密度与正确度性能验证: WS/T 492-2016[S/OL]. (2016-07-07)[2019-02-16]. http://www.nhc.gov.cn/ewebeditor/uploadfile/2016/07/20160719110237175.pdf.
|
| [6] |
徐京昕, 鲁劲松, 张宏印. 流式荧光免疫法检测多肿瘤标志物的方法学评价[J]. 检验医学, 2010, 25: 167-170. |
| [7] |
PARSA S F, VAFAJOO A, ROSTAMI A, SALARIAN R, RABIEE M, RABIEE N, et al. Early diagnosis of disease using microbead array technology:a review[J]. Anal Chim Acta, 2018, 1032: 1-17. DOI:10.1016/j.aca.2018.05.011 |
| [8] |
杨恩环, 周宇琼. 流式荧光法检测多肿瘤标志物性能评估及临床应用[J]. 临床检验杂志, 2012, 30: 960-963. |
| [9] |
谢冲, 唐群业, 王国民. Luminex液相芯片同时检测tPSA和fPSA方法的建立与评价[J]. 复旦学报(医学版), 2010, 37: 391-395. DOI:10.3969/j.issn.1672-8467.2010.04.003 |
| [10] |
JAIN D, CHOUDHURI J, CHAUHAN R, DORWAL P, SHARMA D, TIWARI A K, et al. False negative single antigen bead assay: is it always an effect of prozone?[J/OL]. J Clin Lab Anal, 2018, 32. doi: 10.1002/jcla.22237.
|
 2019, Vol. 40
2019, Vol. 40


