在现代海战中,水雷、鱼雷等水下高爆性武器的广泛应用会导致大批量水下冲击伤伤员[1]。水下高爆性武器在水下爆炸之后可以产生强烈的水下冲击波,具有传播速度快、传播距离远、无典型的压缩区与稀疏区等特点[2],与陆上空气冲击波致伤存在着本质上的差异。目前研究人员对空气冲击波的致伤进行了充分研究,同时也开展了较多的水下冲击波致伤研究,但由于水下爆炸实施难度大,同时难以保证实验动物在水下正常呼吸,尚存在部分难题有待进一步解决。本研究对水下爆炸液体冲击波致水下比格犬颅脑及肺的损伤情况进行了初步探索,以期为该类损伤的防治提供实验参考。
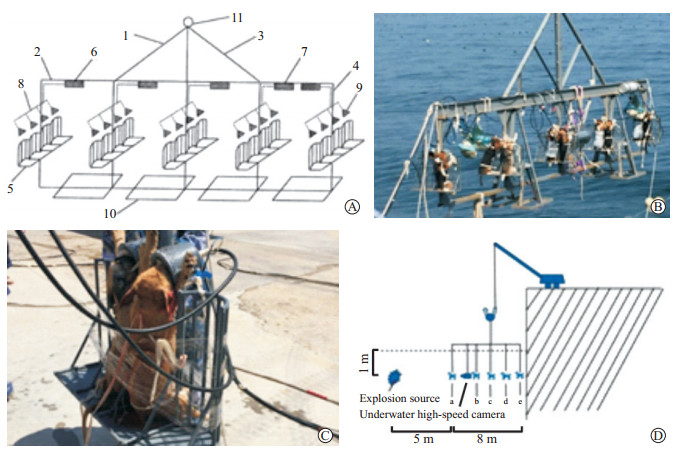
1 材料和方法 1.1 水下爆炸装置制备该水下爆炸装置(图 1)由水下试验支架、水下呼吸系统和载体平台构成。水下试验支架包括固定框、吊杆、试验臂和动物固定支具;水下呼吸系统由压缩空气罐和水下呼吸装置依次相连而成。相邻2个试验臂之间、固定框上设置有载体平台。具体制备方法见专利《一种动物水下试验装置》[3]。
|
图 1 水下爆炸装置及动物布放示意图 Fig 1 Underwater explosion device and the diagram of animal placement A: Diagram of underwater explosion device. 1: Bracket; 2: Fixing frame; 3: Suspender; 4: Support arm; 5: Animal fixator; 6: Underwater breathing system; 7: Compressed air tank; 8: Ventilator tube; 9: Breathing mask; 10: Animal carrier platform; 11: Eyebolt. B: Underwater explosion device. C: Animal fixator. D: Diagram of animal placement. a-e: The distances to explosion source were 5, 7, 9, 11 and 13 m, respectively |
1.2 实验动物
比格犬购于大连医科大学实验动物中心[许可证号:SYXK(辽)2016-0041],相关动物实验经海军军医大学(第二军医大学)长征医院伦理委员会审批。取18只标准比格犬,雌雄不限,体质量为10~12 kg,身高为40~55 cm,体长为50~60 cm。根据比格犬距离爆源的距离随机分为6组:5个实验组(距离爆源5 m、7 m、9 m、11 m、13 m组)和对照组,每组3只。实验组比格犬用3%戊巴比妥钠(1 mL/kg)腹腔注射麻醉后,戴上呼吸面罩固定于水下爆炸装置上,用岸上的吊车上下升降。对照组用同样的方法放入水中,不进行爆炸。
1.3 爆炸流程(1)爆源定位浮标布放:用吊车将爆源定位浮标吊放至海里,用小艇将爆源定位浮标拖至指定海区(距离岸边30 m),并将其一端固定至岸边、一端固定至海上浮筏。(2)测量系统准备:将压力传感器固定于各组实验动物头部附近,将水下高速摄像系统固定于距爆源5 m组与7 m组实验动物之间,摄像方向朝向距爆源5 m组实验动物(图 1D)。(3)爆源布放:爆源为1 kg当量的2, 4, 6-三硝基甲苯(2, 4, 6-trinitrotoluene,TNT)。通过小艇将起爆缆一端放置在浮标附近,将炸药布放至浮标正下方,深度为1 m。(4)水下动物布放:通过吊车将水下试验验架吊至海上,动物头颅在水面以下。用小艇拖至指定位置。(5)连接起爆电缆与爆源,起爆。(6)爆炸后用吊车将水下试验架吊至岸上,进行后续处理。
1.4 爆炸后实验动物处理 1.4.1 影像学检查爆炸后6 h对存活比格犬行头颅和胸部计算机断层扫描(computed tomography,CT)平扫检查,观察爆炸对比格犬颅脑和肺的损伤情况。
1.4.2 病理学检查爆炸后现场立即对死亡比格犬解剖并取材,存活比格犬在爆炸后24 h放血处死。断头取脑,开胸取肺,观察并记录颅脑和肺的大体损伤情况。然后取海马组织及损伤的肺组织标本制作石蜡切片,行H-E染色并观察。
1.4.3 免疫组织化学染色检测采用免疫组织化学SP法对比格犬海马组织进行白细胞介素(interleukin,IL)-6、IL-1β、IL-10、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)和转化生长因子β(transforming growth factor β,TGF-β)染色,然后利用光学显微镜观察其表达情况并记录相应的光密度值。
1.5 统计学处理采用SPSS 19.0软件进行统计学处理。呈正态分布的计量资料以x±s表示,各实验组与对照组数据的比较采用两独立样本t检验。检验水准(α)为0.05。
2 结果 2.1 水下爆炸后一般情况描述 2.1.1 爆炸压力时程曲线根据距爆源水平距离5 m、7 m、9 m、11 m和13 m处实测的爆炸压力时程曲线可知,距爆源5 m处爆炸后压力高峰上升时间短于其余分布点,且压力峰值和正压持续时间也大于其余分布点(表 1、图 2A)。
|
|
表 1 爆炸后各测量点压力参数 Tab 1 Pressure parameters of different measuring points after explosion |

|
图 2 水下爆炸压力测量及水下高速摄像结果 Fig 2 Underwater explosion pressure measurement and results of high-speed films A: Pressure curve of the point with the distance to explosion source being 5 m after explosion. B-D: Results of high-speed films. B: Before explosion; C: During explosion; D: After explosion |
2.1.2 水下高速摄影
水下高速摄影拍摄频率为500帧/s,由图 2B~2D可以看到水下爆炸对实验动物的毁伤包括冲击波和气泡脉动2个过程,冲击波的作用使动物产生的位移更大。
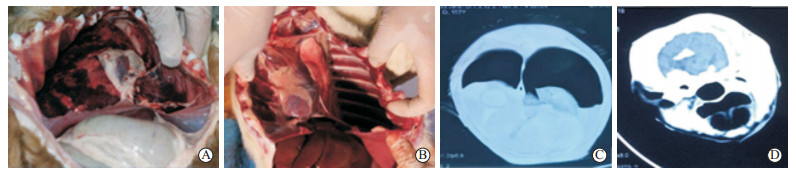
2.2 水下比格犬致伤情况 2.2.1 大体伤情特点爆炸后实验组比格犬总死亡率为40.0%(6/15),5 m、7 m、9 m组分别死亡3只、2只和1只,死亡边界距离为9 m;11 m及其后的比格犬爆炸后24 h内均存活。生理指标观察提示爆炸后比格犬发生一过性呼吸心跳加速,随后逐渐恢复正常水平。各实验组比格犬均出现不同程度的肺部冲击损伤,主要包括出血、胸腔积液及气胸(图 3A),对照组比格犬肺部则没有明显伤情(图 3B)。各组比格犬均没有发现明显的颅内出血、骨折等。
|
图 3 实验动物肺和脑大体观察及CT检查结果 Fig 3 General observation and CT scans of lung and brain of canines in experimental groups A: Pulmonary hemorrhage and pleural effusion; B: Normal thoracic cavity; C: CT scan indicates pneumothorax and pleural effusion; D: CT scan indicates no abnormalities in the brain. CT: Computed tomography |
2.2.2 影像学检查结果
头颅CT检查示,爆炸伤后6 h各实验组比格犬胸部CT检查均可见肺纹理增粗紊乱、肺大泡及胸腔积液、气胸等(图 3C),对照组未见明显异常改变。实验组和对照组比格犬均未见明显颅内出血、骨折、挫裂伤等(图 3D)。
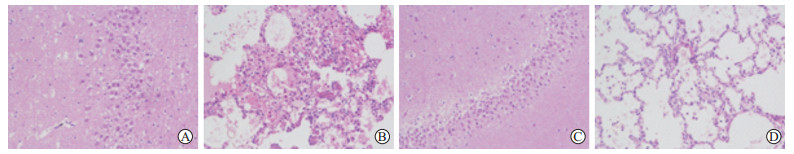
2.2.3 病理学检查结果实验组比格犬海马组织可见炎症细胞浸润,主要是淋巴细胞(图 4A);肺泡腔可见红细胞淤积、肺小血管充血(图 4B)。对照组比格犬海马组织和肺组织均未见明显异常改变(图 4C、4D)。
|
图 4 实验组与对照组比格犬海马组织和肺组织H-E染色结果 Fig 4 H-E staining of canine hippocampal and pulmonary tissues among experimental and control groups A: Inflammatory cell infiltration in hippocampus in experimental group; B: Intra-alveolar erythrocyte deposition in experimental group; C: Normal hippocampus in control group; D: Normal alveoli in control group. Original magnification: ×200 |
2.2.4 各组免疫组织化学结果比较
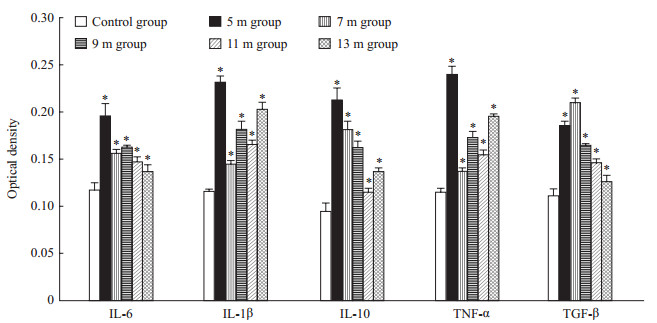
与对照组相比,距离爆源5 m、7 m、9 m、11 m、13 m组爆炸后比格犬海马组织中IL-6、IL-1β、IL-10、TNF-α、TGF-β光密度值均上升,差异均有统计学意义(IL-6:t=9.38、8.49、10.80、5.69、3.74;IL-1β:t=40.26、22.84、16.24、27.51、22.26;IL-10:t=13.92、12.22、12.31、3.77、7.18;TNF-α:t=22.61、8.51、23.37、11.84、37.68;TGF-β:t=22.80、23.10、16.53、7.86、2.99;P均<0.05),且随爆源距离缩短呈升高趋势,提示炎性因子水平可能与爆炸伤损伤程度有关。见图 5。
|
图 5 爆炸后对照组与各实验组比格犬海马组织中IL-6、IL-1β、IL-10、TNF-α、TGF-β表达水平 Fig 5 Expression levels of IL-6, IL-1β, IL-10, TNF-α and TGF-β in hippocampus of canines in control group and each experimental group after explosion IL: Interleukin; TNF-α: Tumor necrosis factor α; TGF-β: Transforming growth factor β. *P < 0.05 vs control group. n=3, x±s |
3 讨论
随着现代海战的发展及水下高爆性武器的大规模装备和使用,水下冲击伤成为主要的海战伤之一。在之前的一些陆上空气冲击波研究的文献报道中,国内外学者曾用雷管、激波管等爆炸或爆炸模拟装置产生冲击波,实验动物主要有犬、兔等。但是水的密度比空气大很多,在4 ℃时其密度约为空气的800倍。因此,与陆上空气冲击波相比,水下的冲击波传播速度更快、距离更远[2, 4-5]。由于水下爆炸实施困难,关于水下冲击波的致伤模型罕有报道。建立水下冲击波致伤动物模型的难点在于既要充分模拟现实海战状况,又要实现可控、精准致伤,实验动物模型还要具有一定的稳定性和可重复性。本研究中的水下爆炸装置可以开展不同爆炸距离、深度的水下爆炸实验。该装置由高强度钢制材料构成,可以承受强冲击、满足大当量水下爆炸实验需求。该装置配备了动物水下呼吸系统,使实验动物可以在水下长时间呼吸,使该爆炸模型更贴合海战实际情况。值得强调的是,本实验首次将水下高速摄像系统用于水下爆炸致水下动物损伤实验研究中,对分析爆炸的动态过程及其对动物造成的损伤具有重要意义。
水下爆炸对作战人员的损伤可以分4个战位展开,即舰艇舱室战位、水下战位、水面泅渡战位和水下潜艇战位[6]。位于水下战位的作战人员全身浸没于水中,如水下蛙人,其在遭受水下冲击之后全身各部位均会遭受直接损伤;水面泅渡战位人员则是身体的大部分浸没于水中,仅头部保持在水面上保证其正常呼吸,水下爆炸之后头部并不会遭受冲击波的直接损伤;水下潜艇战位是指作战人员位于水下潜艇内,水下冲击波通过潜艇传递之后对作战人员造成损伤,损伤机制较为复杂,既有直接的冲击损伤也有潜艇内的二次碰撞损伤。本实验首次建立了基于码头平台的水下爆炸致水下动物损伤实验模型,因该模型可以实现实验动物长时间完全浸没在水中,充分模拟了水下战位,对研究该战位人员损伤具有重要意义。通过动物实验验证,该模型成熟稳定、可重复性好,可以检测水下爆炸压力峰值,还可以根据不同实验要求调整爆炸距离和当量。研究结果显示水下冲击伤以肺部损伤多见,包括胸腔积液、气胸、充血及水肿等;而颅脑由于有颅骨的保护未发现明显骨折和出血等。
严重创伤后机体发生免疫功能障碍,继发炎症反应如全身炎症反应综合征等。炎症过程涉及炎性因子变化等病理生理学变化。细胞因子的本质是糖蛋白,由淋巴细胞等炎症细胞分泌。如何预防过度的炎症反应已成为现代创伤治疗的重要问题之一。多种细胞因子如IL-1、IL-6、TNF-α、TGF-β等参与创伤后炎症过程[7-9]。临床研究发现,IL-1β[10-11]和IL-6[12-13]等炎性因子与脑外伤预后明显相关,而关于水下冲击波致动物颅脑损伤后炎性因子的改变及其与预后的关系目前尚未见报道。
本实验结果显示比格犬在经受水下冲击波损伤后,颅内海马组织中常见的炎性因子IL-1、IL-6、TNF-α和TGF-β表达均会升高。一般而言,动物距离爆源越近、爆炸强度越大,其损伤程度越重,炎性因子表达水平越高,因而颅内炎性因子表达可以作为该动物模型评价的指标。本研究结果亦提示爆源距离与颅脑炎性因子表达水平之间有一定的相关性,但由于实验动物数少,该趋势无统计学意义。已有研究证实在空气冲击波致颅脑损伤后,有关炎性因子可以作为损伤预测及损伤程度划分的生物学指标[14-15]。类似的,在水下冲击波致颅脑损伤中,相关炎性因子也应可以作为类似的生物学指标,但本实验未对动物损伤程度进行定量研究,因此其可靠性有待进一步验证。
本研究存在样本量小、未深入研究水下冲击波致伤机制等不足,但研究结果仍提示冲击波对水下动物的损伤主要表现在肺部。脑组织虽然由于颅骨坚固的保护而无大体病理上的改变,但也会引发损伤后的炎症病变,其损伤来源可能是由于水下冲击波直接穿透颅骨造成损伤,或水下冲击波通过与大脑相连的结构如颈部血管、颈椎等传播至颅内而造成损伤。因此对于水下冲击伤的防护不仅要注意胸部保护,也应注意颅脑部位的保护。进一步探索水下冲击波致颅脑损伤的机制对于水下冲击伤的预防具有重要意义。
| [1] |
BELLAMY R F, ZAJTCHUK R. Conventional warfare: ballistic, blast and burn injuries[M]//Textbook of military medicine: warfare, weaponry, and the casualty.[S.l.]: Department of the Army, Office of The Surgeon General, Borden Institute, 1991: 231-232.
|
| [2] |
杨志焕, 朱佩芳, 蒋建新, 尹志勇, 周继红, 李晓炎, 等. 水下冲击波的生物效应[J]. 爆炸与冲击, 2003, 23: 134-139. DOI:10.3321/j.issn:1001-1455.2003.02.007 |
| [3] |
张丹枫, 张孝凤, 李雅, 侯立军, 王君玉, 陈吉钢, 等.一种动物水下试验装置: CN206315158U[P]. 2017-07-11.
|
| [4] |
王峰.特殊环境冲击伤的伤情特点和治疗研究[D].重庆: 第三军医大学, 2008. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1571629
|
| [5] |
张波, 刘大维, 蒋建新, 杨志焕, 朱佩芳, 王正国. 犬水下冲击伤后主要脏器的病理学变化[J]. 第三军医大学学报, 2003, 25: 938-940. DOI:10.3321/j.issn:1000-5404.2003.11.002 |
| [6] |
张丹枫, 陈吉钢, 王春晖, 李振兴, 侯立军. 水下爆炸损伤生物效应研究现状及展望[J]. 第二军医大学学报, 2016, 37: 1283-1286. ZHANG D F, CHEN J G, WANG C H, LI Z X, HOU L J. Biological effect of underwater explosion injury:research progress and prospective[J]. Acad J Sec Mil Med Univ, 2016, 37: 1283-1286. |
| [7] |
MCKEE C A, LUKENS J R. Emerging roles for the immune system in traumatic brain injury[J]. Front Immunol, 2016, 7: 556. DOI:10.3389/fimmu.2016.00556 |
| [8] |
GARCIA J M, STILLINGS S A, LECLERC J L, PHILLIPS H, EDWARDS N J, ROBICSEK S A, et al. Role of interleukin-10 in acute brain injuries[J]. Front Neurol, 2017, 8: 244. DOI:10.3389/fneur.2017.00244 |
| [9] |
ZEILER F A, THELIN E P, CZOSNYKA M, HUTCHINSON P J, MENON D K, HELMY A. Cerebrospinal fluid and microdialysis cytokines in severe traumatic brain injury:a scoping systematic review[J]. Front Neurol, 2017, 8: 331. DOI:10.3389/fneur.2017.00331 |
| [10] |
黄代新, 张林, 吴梅筠, 陈于波, 吴家. 大鼠液压冲击脑损伤后bFGF及其受体FGFR1的表达[J]. 法医学杂志, 2004, 20: 65-67. DOI:10.3969/j.issn.1004-5619.2004.02.001 |
| [11] |
KUMAR R G, BOLES J A, WAGNER A K. Chronic inflammation after severe traumatic brain injury:characterization and associations with outcome at 6 and 12 months postinjury[J]. J Head Trauma Rehabil, 2015, 30: 369-381. DOI:10.1097/HTR.0000000000000067 |
| [12] |
WINTER C D, PRINGLE A K, CLOUGH G F, CHURCH M K. Raised parenchymal interleukin-6 levels correlate with improved outcome after traumatic brain injury[J]. Brain, 2004, 127(Pt 2): 315-320. |
| [13] |
LIAO Y, LIU P, GUO F, ZHANG Z Y, ZHANG Z. Oxidative burst of circulating neutrophils following traumatic brain injury in human[J]. PLoS One, 2013, 8: e68963. DOI:10.1371/journal.pone.0068963 |
| [14] |
TOKLU H Z, YANG Z, OKTAY S, SAKARYA Y, KIRICHENKO N, MATHENY M K, et al. Overpressure blast injury-induced oxidative stress and neuroinflammation response in rat frontal cortex and cerebellum[J]. Behav Brain Res, 2018, 340: 14-22. DOI:10.1016/j.bbr.2017.04.025 |
| [15] |
KOCHANEK P M, DIXON C E, SHELLINGTON D K, SHIN S S, BAYIR H, JACKSON E K, et al. Screening of biochemical and molecular mechanisms of secondary injury and repair in the brain after experimental blast-induced traumatic brain injury in rats[J]. J Neurotrauma, 2013, 30: 920-937. DOI:10.1089/neu.2013.2862 |
 2019, Vol. 40
2019, Vol. 40


