细菌性肝脓肿是指化脓性细菌经多种途径侵入肝脏,造成肝组织局部炎症、液化坏死、脓液积聚而形成的脓肿[1]。近年来,细菌性肝脓肿发病率呈上升趋势,且耐药菌的比例明显增加[2-4]。本次调研回顾性分析我院安亭院区2015年10月至2017年4月收治的125例细菌性肝脓肿的病原学分布、抗菌药物敏感性特点及抗菌药物的使用情况,为临床抗菌药物合理使用提供依据。
1 资料和方法 1.1 一般资料选择我院安亭院区2015年10月至2017年4月收治的细菌性肝脓肿患者作为研究对象,回顾性分析其病例资料。共125例患者纳入本研究,其中男82例,平均年龄为(55.4±16.2)岁;女43例,平均年龄为(61.7±10.3)岁。125例患者中,单发脓肿72例(57.60%),多发脓肿53例(42.40%);病灶位于肝右叶92例(73.60%),肝左右叶均有脓肿形成33例(26.40%);≤5 cm者38例(30.40%),>5 cm且<10 cm者70例(56.00%),≥10 cm者17例(13.60%)。
125例患者的全身症状主要包括发热(102例,81.60%)、寒战(33例,26.40%)、乏力(19例,15.20%)、体质量减轻(10例,8.00%)、畏寒(9例,7.20%)、皮肤巩膜黄染(6例,4.80%)等,消化系统症状主要有腹痛(34例,27.20%)、腹部压痛(24例,19.20%)、肝区叩痛(15例,12.00%)、纳差(11例,8.80%)、腹胀(11例,8.80%)、呕吐(4例,3.20%)等,呼吸系统症状主要为咳嗽(13例,10.40%)。伴发疾病主要包括高血压45例(36.00%)、胆道疾病(胆管结石或胆囊结石)44例(35.20%)、糖尿病39例(31.20 %)、肺部疾病4例(3.20%);其余还包括腹部手术史37例(29.60%),胆道手术史31例(24.80%)。
1.2 细菌性肝脓肿诊断标准病例符合以下条件即诊断为细菌性肝脓肿:(1)患者有发热、寒战、肝区不适、肝区压痛等临床表现;(2)腹部超声、计算机断层扫描(computed tomography,CT)或磁共振成像(magnetic resonance imaging,MRI)等影像学检查发现肝脓肿;(3)临床细菌学检查结果阳性;(4)抗菌药物治疗后病灶消退;(5)经皮肝穿刺或外科手术治疗后证实;(6)排除阿米巴性、结核性肝脓肿[5]。
1.3 治疗方案与疗效判断标准本次调研大多数患者的脓肿直径>5 cm且<10 cm(70例,56.00%),单纯抗感染治疗仅适合于多发小脓肿和脓肿直径<3 cm的患者,对于脓肿直径>3 cm的单发脓肿需行超声引导下穿刺引流。疗效判断标准:(1)症状、体征消失且脓肿完全吸收为痊愈;(2)症状、体征消失但影像学提示脓肿呈吸收期改变为好转;(3)症状、体征无好转且脓肿大小无变化甚或加重为无效。痊愈、好转为治疗有效[5]。
1.4 观察指标及数据统计根据患者住院病历,记录患者性别、年龄、临床诊断、住院天数、病原学检验情况、体外药物敏感试验结果和抗菌药物使用情况等资料。以药物利用指数(drug utilization index,DUI)作为判断临床用药是否合理的标准。DUI=用药总量/[用药天数×限定日剂量(defined daily dose,DDD)],若DUI>1,说明医生日处方剂量>DDD,存在超剂量用药现象。同一通用名、不同商品名和规格的药品合并计算总消耗量,同一品种、不同给药途径的抗菌药则分别计算。
2 结果 2.1 病原菌分布情况125例患者中94例行病原菌检查,其中51例患者的62个样本检出病原菌。51例病原菌阳性患者中,5例患者获得2个生物样本,3例患者获得3个生物样本,43例患者获得1个生物样本;样本包括血培养10例、脓培养43例、胆汁培养6例、腹液培养3例。共检出62株细菌,43例(84.31%)检出单一细菌,5例(9.80%)检出2种细菌,3例(5.88%)检出3种细菌。检出3种细菌的3例患者中,1例为铜绿假单胞菌、弗氏柠檬酸杆菌和屎球肠菌,1例为肺炎克雷伯菌、大肠埃希菌和彭氏变形菌,1例为阴沟肠杆菌、肺炎克雷伯菌和草绿色链球菌。
由表 1可见,检出的62株细菌中,革兰阴性菌53株(85.48%),其中产超广谱β-内酰胺酶(extended-spectrum β-lactamase,ESBL)菌8株(包括肺炎克雷伯菌2株、大肠埃希菌6株)。革兰阴性菌最常见的为肺炎克雷伯菌33株(62.26%)、大肠埃希菌10例(18.87%),其次分别为铜绿假单胞菌3株(5.66%)、弗氏柠檬酸杆菌3株(5.66%)、摩氏摩根菌摩根亚种2株(3.77%)。革兰阳性菌9株(14.52%),最常见的是金黄色葡萄球菌、屎肠球菌和粪肠球菌(各2株)。39例伴糖尿病的患者中病原学检测阳性者17例,其中肺炎克雷伯菌感染13例(76.47%);44例胆道疾病患者病原学检测阳性者17例,其中肺炎克雷伯菌感染有7例(41.18%);45例高血压患者病原学检测阳性者21例,其中肺炎克雷伯菌感染13例(61.90%);31例有胆道手术史的患者中病原学检测阳性者17例,其中肺炎克雷伯杆菌感染8例(47.06%)。
|
|
表 1 51例细菌性肝脓肿患者病原菌种类及分布 |
2.2 主要病原菌的体外药物敏感试验结果
对主要分离菌革兰阴性杆菌中肺炎克雷伯菌和大肠埃希菌的药物敏感试验结果进行统计,结果见表 2。肺炎克雷伯菌对头孢唑啉敏感率为63.64%,对氨苄西林敏感率为0,对氨基糖苷类、第3代和第4代头孢菌素、β-内酰胺酶抑制剂复合制剂和碳青霉烯类抗菌药物敏感率高;大肠埃希菌对头孢曲松敏感率为40.00%,对环丙沙星、氨曲南、头孢他啶和头孢吡肟敏感率均为50.00%,对氨基糖苷类、β-内酰胺酶抑制剂复合制剂、碳青霉烯类和替加环素敏感率高。其余病原菌因菌株较少,未进行统计分析。
|
|
表 2 细菌性肝脓肿患者中分离的肺炎克雷伯菌和大肠埃希菌的药物敏感率 |
2.3 抗菌药物的使用情况
125例患者治病过程中共使用抗菌药物24种,其中用药频度较高的抗菌药物为注射用头孢哌酮/舒巴坦钠、注射用哌拉西林钠/他唑巴坦钠、注射用头孢曲松钠、盐酸莫西沙星注射液和注射用亚胺培南/西司他丁钠;DUI>1的抗菌药物为注射用头孢哌酮/舒巴坦钠、注射用亚胺培南/西司他丁钠、注射用头孢曲松钠和左氧氟沙星氯化钠注射液。详见表 3。
|
|
表 3 125例细菌性肝脓肿患者抗菌药物使用情况 |
51例病原菌阳性的细菌性肝脓肿患者经验用药及根据药物敏感试验结果调整抗菌药物情况如图 1所示。经验用药主要针对革兰阴性菌和厌氧菌进行治疗,使用最多的依次是酶抑制剂复合制剂、硝基咪唑类和喹诺酮类。调整用药中23例联合使用抗菌药治疗,其中硝基咪唑类+β-内酰胺类13例、喹诺酮类+β-内酰胺类7例、其他药物联合使用3例。33例(60.71%)患者在获得病原菌药物敏感试验结果后调整了抗菌药物,主要增加了硝基咪唑类、喹诺酮类、碳青霉烯类、第4代头孢菌素类、氨基糖苷类和糖肽类药物的使用。
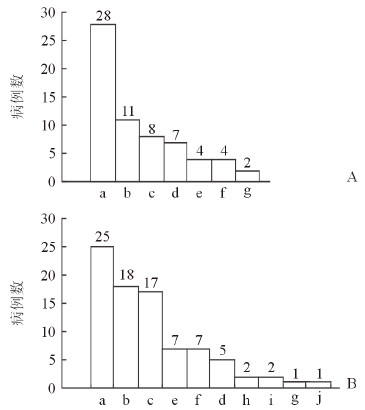
|
图 1 51例细菌性肝脓肿患者药物敏感试验前后抗菌药使用分布 A:经验用药; B:参照药物敏感试验结果给药. a:酶抑制剂复合制剂; b:硝基咪唑类; c:喹诺酮类; d:青霉素类; e:碳青霉烯类; f:第3代头孢菌素类; g:第2代头孢菌素类; h:第4代头孢菌素类; i:糖肽类; j:氨基糖苷类 |
2.4 治疗方案与疗效分析
125例患者平均住院天数为(17.16±10.14)d,最长住院天数为60 d。48例(38.40%)行单纯抗感染治疗,治疗有效46例、无效2例,平均住院天数为(14.75±9.67)d;77例(61.60%)行超声引导下穿刺引流联合抗感染治疗,治疗有效73例、无效4例,平均住院天数为(18.6±11.70)d。
3 讨论本调研结果显示,细菌性肝脓肿病原菌中肺炎克雷伯菌最常见(占53.23%,33/62),其次为大肠埃希菌(16.13%,10/62),基本与文献报道[4-6]相一致。产ESBL菌在革兰阴性菌中占15.09%(8/53),在肺炎克雷伯菌和大肠埃希菌中分别占6.06%(2/33)和60.00%(6/10)。中国细菌耐药监测网数据显示,2016年产ESBL克雷伯菌属和大肠埃希菌检出率分别为25.2%和45.2%[7]。碳青霉烯类对产ESBL菌株具有高度抗菌活性,是目前治疗产ESBL肠杆菌科细菌所致各种感染最有效和可靠的药物。对产ESBL菌株引起的重度脓毒症或脓毒性休克,可直接选用碳青霉烯类抗菌药物。β-内酰胺酶抑制剂复合制剂头孢哌酮/舒巴坦和哌拉西林/他唑巴坦对产ESBL菌株感染有较好的临床疗效,但主要用于轻、中度感染,且需适当增加给药剂量和次数;氟喹诺酮类抗菌药物不适用于产ESBL菌株的经验治疗,氨基糖苷类药物可作为产ESBL重症感染患者治疗的联合用药[8]。
细菌性肝脓肿患者经验用药主要针对革兰阴性菌和厌氧菌,《抗菌药物临床使用指导原则(2015年版)》[9]推荐腹腔感染经验治疗时对轻症感染可选用青霉素、第2代头孢菌素联合甲硝唑或喹诺酮类,对于重症感染可选用含β-内酰胺酶抑制剂、碳青霉烯类、第3代和第4代头孢菌素联合甲硝唑。《桑福德抗微生物治疗指南》2016版推荐治疗细菌性肝脓肿首选甲硝唑联合头孢曲松(或头孢西丁、哌拉西林/他唑巴坦、环丙沙星、左氧氟沙星),备选方案为甲硝唑联合亚胺培南(或美罗培南、多尼培南)[10]。美国传染病学会(Infectious Diseases Society of America,IDSA)复杂性腹腔内感染诊治指南推荐,对于轻中度感染多选用第3代头孢菌素、哌拉西林/他唑巴坦或氟喹诺酮类联合甲硝唑治疗,对于重度感染患者可直接选用碳青霉烯类药物治疗[11]。抗菌药物选择需综合考虑药物抗菌谱、感染的严重程度、患者的肝肾功能、近期使用抗菌药物史等。本研究结果显示,有个别病例存在亚胺培南/西司他丁钠用于轻中度感染经验治疗,且未及时进行降阶梯治疗方案调整。亚胺培南/西司他丁钠属特殊使用级抗菌药物,因此临床上仍需加强对碳青霉烯类抗菌药物等特殊使用级抗菌药物使用的管理,以减少耐药菌的产生。
目前对于细菌性肝脓肿抗感染总疗程没有确切标准,有报道提出至少需要6周,静脉抗感染治疗3周后口服用药1~2个月防止脓肿复发[4]。另有报道静脉用药3周后口服1~2周抗菌药物就可达到抗菌治疗的目的[11]。本次调研中患者住院时间均较短,且出院时绝大部分带有口服抗菌药物或转至当地医院继续抗感染治疗,细菌性肝脓肿的治疗时间较长,具体抗感染疗程需根据患者的临床表现及脓肿愈合情况决定。抗菌药物使用疗程不足可导致脓肿反复,但抗菌药物使用时间过长亦可导致继发感染、耐药等问题,故关于细菌性肝脓肿患者抗菌药物使用疗程有待进一步研究。
| [1] |
徐圣, 朱海东, 陈荔, 周海峰, 滕皋军. 经皮穿刺引流术在细菌性肝脓肿治疗中的作用[J]. 介入放射学杂志, 2018, 27: 181-185. DOI:10.3969/j.issn.1008-794X.2018.02.020 |
| [2] |
SHARMA A, MUKEWAR S, MARA K C, DIERKHISING R A, KAMATH P S, CUMMINS N. Epidemiologic factors, clinical presentation, causes, and outcomes of liver abscess:a 35-year olmsted county study[J]. Mayo Clin Proc Innov Qual Outcomes, 2018, 2: 16-25. DOI:10.1016/j.mayocpiqo.2018.01.002 |
| [3] |
WANG W J, TAO Z, WU H L. Etiology and clinical manifestations of bacterial liver abscess: a study of 102 cases[J/OL]. Medicine(Baltimore), 2018, 97: e12326. doi: 10.1097/MD.0000000000012326.
|
| [4] |
张婷婷, 袁喆. 细菌性肝脓肿病原学分布及耐药性分析[J]. 西部医学杂志, 2017, 29: 679-684. |
| [5] |
FOO N P, CHEN K T, LIN H J, GUO H R. Characteristics of pyogenic liver abscess patients with and without diabetes mellitus[J]. Am J Gastroenterol, 2010, 105: 328-335. DOI:10.1038/ajg.2009.586 |
| [6] |
路倩倩, 马承泰, 顾华丽, 石磊, 夏  . 细菌性肝脓肿的病原学及临床分析[J]. 中国感染与化疗杂志, 2016, 16: 722-725. . 细菌性肝脓肿的病原学及临床分析[J]. 中国感染与化疗杂志, 2016, 16: 722-725. |
| [7] |
胡付品, 郭燕, 朱德妹, 汪复, 蒋晓飞, 徐英春, 等. 2016年中国CHINET细菌耐药性监测[J]. 中国感染与化疗杂志, 2017, 17: 481-491. |
| [8] |
周华, 李光辉, 陈佰义, 卓超, 曹彬, 杨毅, 等. 中国产超广谱β-内酰胺类酶肠杆菌科细菌感染应对策略专家共识[J]. 中华医学杂志, 2014, 94: 1847-1856. DOI:10.3760/cma.j.issn.0376-2491.2014.24.003 |
| [9] |
《抗菌药物临床应用指导原则》修订工作组. 抗菌药物临床应用指导原则[M]. 2015年版. 北京: 人民卫生出版社, 2015: 66.
|
| [10] |
SANFORD J P. The Sanford guide to antimicrobial therapy 2016[M]. 46th ed. Sperryville: Antimicrobial Therapy Inc, 2016: 114-115.
|
| [11] |
NAZIR N T, PENFIELD J D, HAJJAR V. Pyogenic liver abscess[J]. Cleve Clin J Med, 2010, 77: 426-427. DOI:10.3949/ccjm.77a.09151 |
 2019, Vol. 40
2019, Vol. 40


