2. 福建医科大学附属泉州市第一医院肿瘤内科, 泉州 362000;
3. 上海交通大学医学院附属国际和平妇幼保健院乳腺科, 上海 200030
2. Department of Oncology, Quanzhou First Hospital Affiliated to Fujian Medical University, Quanzhou 362000, Fujian, China;
3. Department of Breast, International Peace Maternity & Child Health Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai 200030, China
恶性肿瘤是严重危害人类健康的疾病,而肿瘤转移是恶性肿瘤的重要生物学特性和主要死亡原因[1]。外周血循环肿瘤细胞(circulating tumor cell,CTC)可见于肺癌、乳腺癌等多种恶性肿瘤,与肿瘤的临床分期、药物疗效、复发、转移和预后密切相关,有望实现实时的“液体活组织检查”,成为肿瘤诊断、疗效评估和预后预测的良好指标[2-6]。相对于血液中的其他细胞,CTC数量极少,并且缺乏能够可靠识别这些细胞的标志物,对其捕获和检测手段的灵敏度要求极高[7-8],因此,开发高灵敏度和高特异度的CTC检测技术具有重要意义。
表面增强拉曼散色(surface-enhanced Raman scattering,SERS)技术检测具有快速、无损、抗荧光干扰、能在液体中检测等优点,当被检测物吸附在粗糙金属表面时其拉曼光谱强度会提高103~106倍[9]。在细胞研究中,SERS检测方法可归纳为直接检测和间接检测两类。直接检测主要是将待测的生物样品直接作用于SERS活性基底,获得该生物样品自身的分子振动信息[10-12];间接检测通常是将具有明确拉曼特征峰并且拉曼信号很强的信号分子标记在具有SERS效应的纳米粒子上,使粒子靶向到细胞特定位点后再进行检测[13]。本研究利用电荷原理使石墨烯纳米材料与肿瘤细胞特异性结合,通过石墨烯的特征拉曼峰间接检测肿瘤细胞,开发一种简单、快速的适用于检测多种肿瘤细胞的方法。
1 材料和方法 1.1 主要试剂、仪器与肿瘤细胞三水氯金酸(HAuCl4•3H2O,纯度≥99.9%)购自北京华威锐科化工有限公司,硼氢化钠(NaBH4,纯度为98%)、硝酸银(AgNO3,纯度≥99.0%)、L-抗坏血酸(纯度≥99.0%)、聚苯乙烯磺酸钠[poly(sodium-p-styrenesulfonate),PSS;重均分子质量7 000]等试剂均购自国药集团化学试剂有限公司;聚-二烯丙基二甲基氯化铵(poly dimethyl diallyl ammonium chloride,PDDAC)、十六烷基三甲基溴化铵(cetyltrimethylammonium bromide,CTAB)均购自西格玛(上海)有限公司,超纯水(电阻率为18.2 MΩ • cm)、高糖DMEM培养液、胰蛋白酶、双抗均购自美国Gibco公司,磷酸盐缓冲液(phosphate buffer saline,PBS)购自美国HyClone公司,Percoll细胞分离液、4’, 6-二脒基-2-苯基吲哚(4’, 6-diamidino-2-phenylindole,DAPI)染色液、异硫氰酸罗丹明B(Rhodamine B,RhB)等均购自阿法埃莎(中国)化学有限公司。
高速离心机(5424R,德国Eppendorf公司),显微共聚焦拉曼光谱仪(Renishaw in Via,英国Renishaw公司),透射电子显微镜(TecnaiTMG2 F30,美国FEI公司),扫描电子显微镜(S-4800,日本日立公司),紫外吸收光谱仪(UV-2501,日本岛津公司),磁力加热搅拌器(HS7,德国IKA公司),zeta电位分析仪(NANO ZS90,英国Malvern公司),激光共聚焦荧光显微镜(Leica TCS PS5 Ⅱ,德国Leica公司),超声波清洗器(KQ-5200,昆山市超声仪器有限公司),酶标仪(MK3,上海赛默生物科技发展有限公司)。
人宫颈癌细胞系HeLa和人乳腺癌细胞系MCF-7均购自中国科学院上海细胞库,用含10%胎牛血清和1%青链霉素混合液(100×)的DMEM培养液培养于含5% CO2的标准培养箱中。
1.2 材料制备过程在课题组前期研究[14]的基础上进行微小调整,合成氧化石墨烯(graphene oxide,GO)/金纳米棒(gold nanorod,GNR)复合材料。
1.2.1 GO的修饰称量10 mg GO,研磨后溶于10 mL去离子水中,超声分散;称取0.8 g PSS,超声搅拌使其溶于50 mL去离子水;使用细胞破碎仪(880 W,10 min)将GO水溶液和PSS水溶液混匀;通过高速离心(21 130×g,10 min)纯化GO,并除去多余的PSS,分散于10 mL去离子水中。
1.2.2 GNR的合成采用经典的NaBH4还原法合成金种子。称取182 mg CTAB粉末,使其溶于2.5 mL去离子水中,加入1.5 mL HAuCl4水溶液(1 mmol/L),然后加入600 μL NaBH4水溶液(10 mmol/L),轻轻混匀,溶液颜色快速变为浅棕色,在25 ℃水浴中静置2 h,放入4 ℃冰箱备用。合成的GNR通过紫外吸收光谱检测,具有2个明显的紫外吸收峰。
1.2.3 GO/GNR复合材料的制备称取3.64 g CTAB,置于圆底烧杯中,加入72 mL去离子水,超声加热溶解后冷却至室温,依次加入5 mL GO(0.1 mg/mL)、5 mL HAuCl4水溶液(15 mmol/L)和3.1 mL硝酸银(4 mmol/L),在室温下超声混合,再加入1 mL L-抗坏血酸(88 mmol/L)并摇匀混合,最后将1 mL GNR快速加入其中并轻轻摇匀30 s,在恒温28 ℃水浴中静置8 h。通过扫描电子显微镜观测其形貌。
1.2.4 GO/GNR复合材料和GNR的表面修饰(1)分别将合成的GO/GNR复合材料和GNR通过2次高速离心(21 330×g,20 min)除去多余的CTAB,并分别溶于20 mL去离子水中;(2)分别取600 mg PSS溶于30 mL去离子水中,加入合成的GO/GNR复合材料和GNR,进行超声反应(880 W,2 h),通过2次离心纯化除去多余的PSS,再分别溶于20 mL去离子水中;(3)取5 mL PDDAC溶于20 mL水中,然后缓慢加入步骤(2)制备的溶液中,继续超声反应2 h,通过离心纯化除去多余的PDDAC。
1.2.5 Zeta电位检测(1)分别取适量纳米材料分散在1 mL超纯水中;(2)置于超声波清洗器中超声清洗2 min;(3)将分散后的各种纳米材料用移液器转移到电位测量池中;(4)使用zeta电位分析仪测量不同材料的电位。
1.2.6 稳定性检测1、10、100、1 000 μg/mL的GO/GNR复合材料分散在PBS(0.1 mol/L,pH 7.4)中24 h,1 500×g离心10 min,通过测定每组上清的紫外吸收光谱对比纳米探针离心前和离心后的差异,以及纳米探针在PBS和水中的差异。
1.2.7 毒性检测使用CCK-8试剂盒(日本同仁化学研究所)评价GO/GNR复合材料的细胞毒性。将HeLa细胞和MCF-7细胞分别接种于96孔板中,每孔8 000个细胞,置于细胞培养箱中;分别加入100 μL不同浓度纳米材料的细胞培养液(0、1、5、25、125、225 μg/mL)置于细胞培养箱24 h;加入10 μL CCK-8试剂与细胞共培养2 h;使用多功能酶标仪测定450 nm处光密度(D)值,计算细胞活力。细胞活力(%)=[D(加材料)-D(空白)]/[D(不加材料)-D(空白)]×100%,其中D(加材料)为有细胞、CCK-8试剂和材料的孔的光密度,D(空白)为有培养液和CCK-8试剂而没有细胞的孔的光密度;D(不加材料)为有细胞、CCK-8试剂而没有材料的孔的光密度。
1.2.8 GO、GO/GNR复合材料和GNR负载RhB及透析过程(1)取经PDDAC修饰过的GO、GO/GNR复合材料和GNR各1 mL,加入9 mL去离子水超声分散,各加入500 μL RhB(1 mg/mL),放入垂直混合仪混匀5 h;(2)离心(21 130×g,20 min)去上清,加入双蒸水中超声分散;(3)重复步骤(2)2次,最终溶液分散在1 mL双蒸水中。透析过程:(1)将与RhB结合的GO和GO/GNR复合材料加入截留相对分子质量为10 000的透析袋,置于装满5 L的超纯水中透析24 h;(2)每隔4 h换1次水。尽可能除去游离的小分子RhB。
1.3 细胞靶向实验在24孔板的每孔中接种1×104个HeLa细胞,置于培养箱中孵育24 h;移去全部细胞培养液,用PBS洗去细胞表面多余的培养液,分别加入配制的GO/GNR复合材料、GNR和RhB,4 ℃孵育15 min;弃上清液,用PBS洗3次;加入500 μL 4%多聚甲醛溶液固定细胞;加入500 mL DAPI,静置10 min,用PBS洗去多余的染色液,用激光共聚焦荧光显微镜观测各组细胞。
1.4 SERS探针标记HeLa细胞与拉曼光谱检测(1)将生长状态正常的HeLa细胞用胰蛋白酶消化处理,然后重悬分散在PBS中并计数备用;(2)将超声分散均匀的一定量的GO/GNR复合材料分别与10 000、5 000、1 250、250、50个细胞轻轻混匀,4 ℃条件下孵育10 min,每隔一定时间轻轻混匀,15 min后离心弃上清,再用PBS洗2次;(3)用100 μL PBS重悬细胞,转移至直径为1 cm的培养皿中,静置待细胞铺平;(4)使用显微共聚焦激光拉曼光谱仪和10倍激光拉曼显微镜头进行SERS光谱检测,以633 nm激光作为激发光源。
1.5 血细胞的分离经同济大学伦理委员会审批后,获取健康志愿者(25岁,男性)的血液标本。配制5层Percoll细胞分离液,各层分别含75%、62.5%、50%、37.5%、25% Percoll试剂。将配制好的细胞分离液加入血液标本中,通过密度梯度离心法[15-16]获取各层细胞备用。
1.6 肿瘤细胞的拉曼光谱检测(1)肿瘤细胞和血细胞的拉曼光谱检测:将分离的血细胞加入PBS混匀,离心除去多余的细胞分离液,稀释分散在PBS中,通过细胞计数仪计数后稀释至100 000/mL,分为5组,每组分别加入100 000个血细胞及10 000、5 000、1 250、250、50个HeLa细胞,进行SERS光谱检测。(2)模拟血样的拉曼光谱检测:将不同密度的肿瘤细胞(10 000、5 000、1 250、250、50个MCF-7细胞)加入血液标本中制成模拟血样,分别加入配制好的细胞分离液,通过密度梯度离心法获取上层低密度细胞,进行SERS光谱检测。
1.7 统计学处理使用Origin、Graphpad Prism和Excel软件处理数据,计量资料以x±s表示,使用线性回归分析探究肿瘤细胞数量与纳米探针特殊拉曼光谱特征峰强度之间的关系。
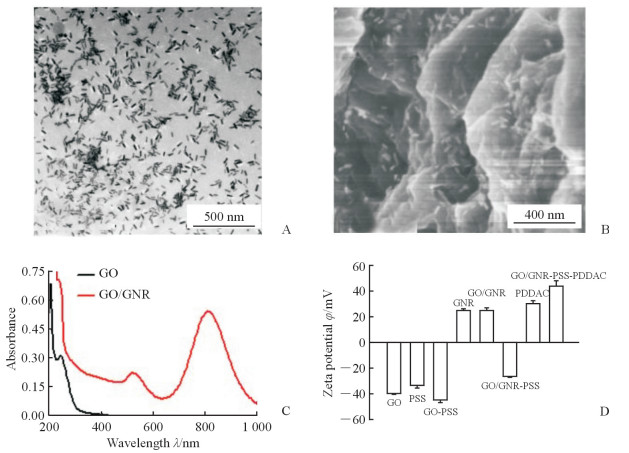
2 结果 2.1 材料表征 2.1.1 材料形貌表征透射电子显微镜下可见合成的GNR大小均一,平均大小约为31 nm×8 nm,长径和短径比约为3.9(图 1A);扫描电子显微镜下可见大量的GNR均匀地分布于GO表面(图 1B),紫外-可见光吸收光谱检测显示GNR与GO结合稳定(图 1C);经过PDDAC修饰后,合成的表面带有正电荷的GO/GNR复合材料表面zeta电位约40 mV(图 1D)。
|
图 1 GNR和GO/GNR复合材料的表征 Fig 1 Characterization of GNR and GO/GNR hybrids A: GNR morphology under transmission electron microscope; B: GO/GNR morphology under scanning electron microscope; C: Ultraviolet-visible spectroscopy of GO/GNR hybrids and GO; D: The zeta potential of GO/GNR hybrids during modification. GNR: Gold nanorod; GO: Graphene oxide; PSS: Poly(sodium-p-styrenesulfonate); PDDAC: Poly dimethyl diallyl ammonium chloride. n=3, x±s |
2.1.2 材料稳定性和毒性表征
合成的GO/GNR复合材料在水中和PBS中的3个等离子共振吸收峰并没有明显偏移(图 2A);GO/GNR复合材料在PBS中和在水中同样相对稳定,分散性良好,在低转速下不会有沉淀(图 2B);GO/GNR复合材料表面zeta电位在4 d内相对稳定,之后由于高分子脱落zeta电位逐渐降低(图 2C);GO/GNR复合材料对HeLa和MCF-7两种肿瘤细胞的毒性很小,在高浓度GO/GNR复合材料孵育下,肿瘤细胞活性均在90%以上(图 2D)。

|
图 2 GO/GNR复合材料的稳定性和细胞毒性 Fig 2 Stability and cytotoxicity of GO/GNR hybrids A: Ultraviolet-visible spetroscopy of GO/GNR hybrids dispersed in water and PBS; B: Different concentrations of GO/GNR hybrids (from right to left 1, 10, 100, 1 000 μg/mL) dispersed in PBS; C: The change of zeta potential of GO/GNR hybrids with time; D: Cytotoxicity of HeLa cells and MCF-7 cells. GO: Graphene oxide; GNR: Gold nanorod; PBS: Phosphate buffer solution. n=3, x±s |
2.2 表面带正电的GO/GNR复合材料靶向肿瘤细胞 2.2.1 GO/GNR复合材料吸附RhB的表征
RhB是实验室中常用的荧光染料小分子,在溶液中具有强烈的荧光,易被金属和石墨烯吸附。合成的GNR具有吸附小分子RhB的能力,其吸附RhB后的荧光光谱峰位与RhB重合,而吸附RhB后的GO/GNR复合材料的荧光光谱图在580 nm处的峰发生红移,红移10 nm左右(图 3A)。将RhB透析祛除后,GNR荧光强度变弱,而GO/GNR复合材料的荧光强度不仅变弱而且发生了蓝移,并且荧光特征峰强度高于GNR(图 3B、3C)。上述结果表明GO具有淬灭荧光的能力,而表面负载的RhB的荧光并没有完全被淬灭,仍然具有荧光特性,因此负载RhB的GO/GNR复合材料能用于验证材料靶向细胞的效果。

|
图 3 负载RhB的GO/GNR复合材料和GNR的荧光光谱图及透析前后荧光光谱图的变化 Fig 3 Fluorescence spectrum of GO/GNR hybrids and GNR modified with RhB and the changes before and after dialysis A: Fluorescence spectrum of GO/GNR hybrids and GNR modified with RhB; B: Fluorescence spectrum of GNR modified with RhB before and after dialysis; C: Fluorescence spectrum of GO/GNR hybrids modified with RhB before and after dialysis. RhB: Rhodamine B; GO: Graphene oxide; GNR: Gold nanorod |
2.2.2 表面带有正电荷的GO/GNR复合材料更易与肿瘤细胞结合
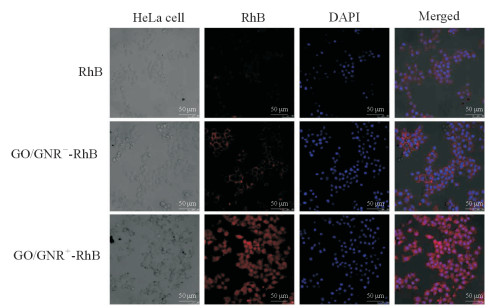
如图 4所示,表面带正电荷的GO/GNR复合材料与肿瘤细胞共同孵育后,肿瘤细胞表面结合材料更多,荧光显微镜下带正电荷的GO/GNR复合材料与肿瘤细胞结合后其荧光强度比表面带负电荷的GO/GNR复合材料与肿瘤细胞结合后的荧光强度更强,表明表面带正电荷的GO/GNR复合材料更易于与肿瘤细胞结合。
|
图 4 表面带有正、负电荷的GO/GNR复合材料靶向HeLa细胞在共聚焦荧光显微镜下对比图 Fig 4 Confocal fluorescence microscope images of treated HeLa cells with GO/GNR+ and GO/GNR- DAPI is used to stain the cell nucleus, RhB is labeled in GO/GNR+ and GO/GNR-. RhB: Rhodamine B; GO: Graphene oxide; GNR: Gold nanorod; DAPI: 4', 6-diamidino-2-phenylindole; GO/GNR+: Positively charged GO/GNR hybrid; GO/GNR-: Negatively charged GO/GNR hybrid |
2.3 GO/GNR复合材料、血细胞和肿瘤细胞的拉曼光谱检测
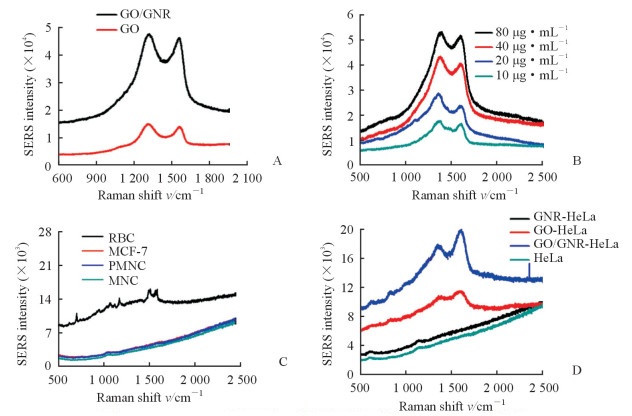
与GO相比,GO/GNR复合材料拉曼特征光谱增强,增强倍数约5倍(图 5A);在10~80 μg/mL范围内,随着浓度的增加,GO/GNR复合材料的拉曼光谱增强(图 5B)。除了红细胞中的血红蛋白在1 546 cm-1和1 617 cm-1处的拉曼特征峰,多核细胞、单个核细胞及MCF-7细胞的特征拉曼光谱并不明显(图 5C)。直接检测HeLa细胞的拉曼光谱未见明显的特征峰,GNR与HeLa细胞结合后也没有明显增强的拉曼光谱峰,GO与HeLa细胞结合后可检测到明显的拉曼光谱峰,而GO/GNR复合材料与肿瘤细胞结合后GO的特征拉曼光谱峰更强(图 5D)。实验结果表明GO/GNR复合材料与肿瘤细胞结合后可通过SERS光谱间接检测。
|
图 5 GO/GNR复合材料、血细胞和肿瘤细胞的拉曼光谱检测 Fig 5 Raman spectroscopy measurement of GO/GNR hybrids, blood cells and tumor cells A: SERS spectra of GO and GO/GNR hybrids; B: SERS spectra of GO/GNR hybrids with different concentrations; C: SERS spectra of blood cells; D: SERS spectra of HeLa cells incubated with GNR, GO and GO/GNR hybrids. GO: Graphene oxide; GNR: Gold nanorod; SERS: Surface-enhanced Raman scattering; RBC: Red blood cell; PMNC: Polymorphonuclear cell; MNC: Mononuclear cell |
2.4 模拟血样中肿瘤细胞的拉曼光谱检测
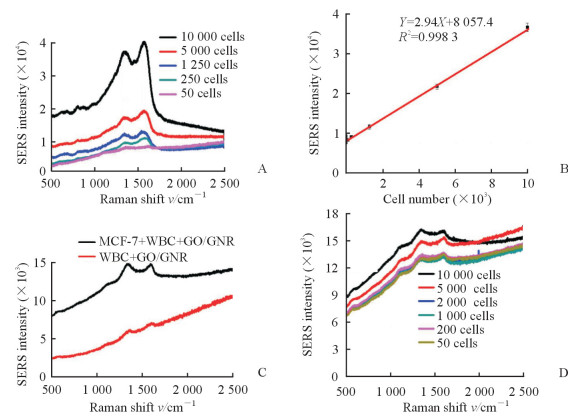
肿瘤细胞数量在50~10 000范围内时,肿瘤细胞与表面带正电荷的GO/GNR复合材料共同孵育后可测得拉曼光谱特征峰(图 6A),1 350 cm-1处的拉曼光谱特征峰强度与肿瘤细胞的数量之间存在线性关系(图 6B)。白细胞与表面带正电荷的GO/GNR复合材料共同孵育后也出现了明显的GO特征峰,说明GO/GNR复合材料与白细胞有非特异性的吸附(图 6C)。从模拟临床血样中获取的低密度层细胞与表面带正电荷的GO/GNR复合材料共同孵育后,可检测到明显石墨烯的拉曼光谱特征峰,但拉曼光谱特征峰的强度与细胞数量之间没有明显相关性。说明白细胞对肿瘤细胞的检测有一定的干扰。
|
图 6 模拟血样中肿瘤细胞的拉曼光谱检测 Fig 6 Raman spectroscopy measurement of tumor cells in simulated blood samples A: SERS spectra of tumor cells in the range of 50-10 000 HeLa cells after incubated with GO/GNR hybrids; B: Plot of the SERS intensity at 1 350 cm-1 as a function of the concentration of HeLa cells stock solution; C: SERS spectra of WBC mixed with MCF-7 cells and single WBC incubated with GO/GNR hybrids; D: SERS spectra of simulated blood samples. GO: Graphene oxide; GNR: Gold nanorod; SERS: Surface-enhanced Raman scattering; WBC: White blood cell |
3 讨论
SERS技术已经被开发成一种可应用于多种领域的微量分析技术,可检测范围甚至可以降低到单个分子水平[17-18]。因此,基于SERS方法的分析工具为CTC提供了一种新的检测手段[19]。本实验引入SERS技术用于CTC的检测,依据GO具有拉曼光谱特征峰[20]、GNR作为基底能增强拉曼光谱特征峰[21]、肿瘤细胞表面带有不同于正常细胞的负电荷[22]而设计,因此实验具有理论可行性。
本研究采用表面带正电荷的GO/GNR复合纳米材料为探针,通过静电吸附作用靶向肿瘤细胞,使用显微共聚焦拉曼光谱仪进行间接检测。测试结果表明在一定数量范围内,HeLa细胞在1 350 cm-1处的SERS光谱峰强度与细胞数量存在线性关系。而在健康志愿者血液标本中加入肿瘤细胞模拟肿瘤患者血样中,不同分组都测出了GO的拉曼光谱峰,但其强度与细胞数量之间无明显的关系。其原因可能为:(1)密度梯度离心液可能会破坏肿瘤细胞表面的电荷,影响GO/GNR复合材料与肿瘤细胞有效结合;(2)显微共聚焦拉曼光谱仪激光束的光斑覆盖范围是0.2 mm左右,实验中测试选点位置对信号强度有一定影响,可能存在检测误差;(3)本研究发现白细胞与表面带正电荷的GO/GNR复合材料共同孵育后也出现了明显的GO特征峰,说明白细胞的存在也会影响肿瘤细胞的拉曼光谱检测。
本研究结果表明GO/GNR复合材料可作为SERS探针实现对CTC的拉曼光谱检测。但该方法仍需从以下几方面进一步改进:(1)筛选出最适合的密度梯度离心液,尽可能除去白细胞;(2)改进合成方法,使材料大小均一,并调整与细胞结合的GO/GNR复合材料的含量,摸索出合适的比例以尽可能减少非特异性吸附;(3)实验中增加PBS洗涤次数,以减少非特异性吸附;(4)通过调节样品的测试选点位置减少测试误差。此外,本研究采用的模拟血样中肿瘤细胞数≥50,但肿瘤患者体内CTC数量极少[7-8],且多数依靠抗原抗体相结合的方式捕获,因此仍需进一步提高拉曼光谱检测的灵敏度,改进捕获和富集CTC的技术,真正实现对CTC的快速检测和定量分析。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, SIEGEL R L, TORRE L A, JEMAL A. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68: 394-424. DOI:10.3322/caac.v68.6 |
| [2] |
KHOO B L, GRENCI G, JING T, LIM Y B, LEE S C, THIERY J P, et al. Liquid biopsy and therapeutic response: circulating tumor cell cultures for evaluation of anticancer treatment[J/OL]. Sci Adv, 2016, 2: e1600274. doi: 10.1126/sciadv.1600274.
|
| [3] |
YU M, BARDIA A, WITTNER B S, STOTT S L, SMAS M E, TING D T, et al. Circulating breast tumor cells exhibit dynamic changes in epithelial and mesenchymal composition[J]. Science, 2013, 339: 580-584. DOI:10.1126/science.1228522 |
| [4] |
田晓坤, 李玉明, 胡宝光, 张明凯, 李燕彬. 胃癌患者外周血Cyttel循环肿瘤细胞检测及临床意义[J]. 中华实验外科杂志, 2017, 34: 208-210. DOI:10.3760/cma.j.issn.1001-9030.2017.02.010 |
| [5] |
DE BONO J S, SCHER H I, MONTGOMERY R B, PARKER C, MILLER M C, TISSING H, et al. Circulating tumor cells predict survival benefit from treatment in metastatic castration-resistant prostate cancer[J]. Clin Cancer Res, 2008, 14: 6302-6309. DOI:10.1158/1078-0432.CCR-08-0872 |
| [6] |
WONG M P. Circulating tumor cells as lung cancer biomarkers[J]. J Thorac Dis, 2012, 4: 631-634. |
| [7] |
HAROUAKA R, KANG Z, ZHENG S Y, CAO L. Circulating tumor cells:advances in isolation and analysis, and challenges for clinical applications[J]. Pharmacol Ther, 2014, 141: 209-221. DOI:10.1016/j.pharmthera.2013.10.004 |
| [8] |
ESMAEILSABZALI H, BEISCHLAG T V, COX M E, PARAMESWARAN A M, PARK E J. Detection and isolation of circulating tumor cells:principles and methods[J]. Biotechnol Adv, 2013, 31: 1063-1684. DOI:10.1016/j.biotechadv.2013.08.016 |
| [9] |
BELL S E, SIRIMUTHU N M. Surface-enhanced Raman spectroscopy (SERS) for sub-micromolar detection of DNA/RNA mononucleotides[J]. J Am Chem Soc, 2006, 128: 15580-15581. DOI:10.1021/ja066263w |
| [10] |
XU X, KIM K, LIU C, FAN D. Fabrication and robotization of ultrasensitive plasmonic nanosensors for molecule detection with Raman scattering[J]. Sensors (Basel), 2015, 15: 10422-10451. DOI:10.3390/s150510422 |
| [11] |
JIANG Z, SUN S, LIANG A, HUANG W, QIN A. Gold-labeled nanoparticle-based immunoresonance scattering spectral assay for trace apolipoprotein AI and apolipoprotein B[J]. Clin Chem, 2006, 52: 1389-1394. DOI:10.1373/clinchem.2005.061176 |
| [12] |
TANWAR S, HALDAR K K, SEN T. DNA origami directed Au nanostar dimers for single-molecule surface-enhanced Raman scattering[J]. J Am Chem Soc, 2017, 139: 17639-17648. DOI:10.1021/jacs.7b10410 |
| [13] |
OTTO C, SIJTSEMA N M, GREVE J. Confocal Raman microspectroscopy of the activation of single neutrophilic granulocytes[J]. Eur Biophys J, 1998, 27: 582-589. DOI:10.1007/s002490050169 |
| [14] |
SUN B, WU J, CUI S, ZHU H, AN W, FU Q, et al. In situ synthesis of graphene oxide/gold nanorods theranostic hybrids for efficient tumor computed tomography imaging and photothermal therapy[J]. Nano Res, 2017, 10: 37-48. DOI:10.1007/s12274-016-1264-x |
| [15] |
FEOFANOV A V, GRICHINE A I, SHITOVA L A, KARMAKOVA T A, YAKUBOVSKAYA R I, EGRET-CHARLIER M, et al. Confocal Raman microspectroscopy and imaging study of theraphthal in living cancer cells[J]. Biophys J, 2000, 78: 499-512. DOI:10.1016/S0006-3495(00)76612-4 |
| [16] |
WANG X, QIAN X, BEITLER J J, CHEN Z G, KHURI F R, LEWIS M M, et al. Detection of circulating tumor cells in human peripheral blood using surface-enhanced Raman scattering nanoparticles[J]. Cancer Res, 2011, 71: 1526-1532. DOI:10.1158/0008-5472.CAN-10-3069 |
| [17] |
LLEVOT A, ASTRUC D. Applications of vectorized gold nanoparticles to the diagnosis and therapy of cancer[J]. Chem Soc Rev, 2012, 41: 242-257. DOI:10.1039/C1CS15080D |
| [18] |
WU W, LIU L, DAI Z, LIU J, YANG S, ZHOU L, et al. Low-cost, disposable, flexible and highly reproducible screen printed SERS substrates for the detection of various chemicals[J/OL]. Sci Rep, 2015, 5: 10208. doi: 10.1038/srep10208.
|
| [19] |
FENG J, CHEN L, XIA Y, XING J, LI Z, QIAN Q, et al. Bioconjugation of gold nanobipyramids for SERS detection and targeted photothermal therapy in breast cancer[J]. ACS Biomater Sci Eng, 2017, 3: 608-618. DOI:10.1021/acsbiomaterials.7b00021 |
| [20] |
吴娟霞, 徐华, 张锦. 拉曼光谱在石墨烯结构表征中的应用[J]. 化学学报, 2014, 72: 301-318. |
| [21] |
WU X, XIA Y, HUANG Y, LI J, RUAN H, CHEN T, et al. Improved SERS-active nanoparticles with various shapes for CTC detection without enrichment process with supersensitivity and high specificity[J]. ACS Appl Mater Interfaces, 2016, 8: 19928-19938. DOI:10.1021/acsami.6b07205 |
| [22] |
PEI Y, WANG Z, ZONG S, CUI Y. Highly sensitive SERS-based immunoassay with simultaneous utilization of self-assembled substrates of gold nanostars and aggregates of gold nanostars[J]. J Mater Chem B, 2013, 32: 3992-3998. |
 2019, Vol. 40
2019, Vol. 40


