天冬酰胺酶(L-asparaginase,L-ASN)是治疗急性淋巴白血病和淋巴瘤的有效药物[1]。天冬酰胺是癌变淋巴母细胞生长所必需的氨基酸,L-ASN通过消耗天冬酰胺发挥抗癌作用[2]。L-ASN是蛋白多肽类药物,与传统合成药物相比,其对正常细胞和组织的毒副作用较轻,但在体内易失活、稳定性差、生物利用度低,限制了其临床应用[3]。羟丙基-β-环糊精脂质体是一类新型药物载体,药物被羟丙基-β-环糊精包合后再制备成脂质体能提高药物包封率,增强药物稳定性,并能提高药物的生物利用度,具有良好的应用前景[4-5]。目前,国内尚未见羟丙基-β-环糊精脂质体载治疗酶的研究报道,本研究首次将L-ASN制备成载天冬酰胺酶羟丙基-β-环糊精脂质体(L-asparaginase loaded hydroxypropyl-β-cyclodextrin liposome,AHL),以期提高L-ASN的稳定性和生物利用度。
1 材料和方法 1.1 药品、试剂与仪器L-ASN(以色列Prospec公司,纯度>96%,批号:312PLASP11),天冬酰胺、胆固醇(美国Sigma公司),三羟甲基氨基甲烷(Tris,国药集团化学试剂有限公司),磷脂(德国Lipoid公司),乙醚、二氯甲烷[重庆川东化工(集团)有限公司]。A200S型精密电子天平(德国赛多利斯公司),G16型医用离心机(北京白洋医疗器械有限公司),PHS-25型酸度计(上海雷磁仪器厂),HWCL-3型集热式恒温磁力搅拌器(郑州长城科工贸有限公司),Zetasizer Nano型激光粒度仪(英国马尔文仪器有限公司),JEM-1400Plus型透射电子显微镜(日本电子株式会社)。
1.2 实验动物清洁级SD大鼠,体质量(200±20)g,雄性,由重庆医科大学实验动物中心提供,使用许可证号:SYXK(渝)2014-0001。
1.3 AHL的制备采用逆相蒸发法制备AHL[5-6]。称取适量胆固醇、卵磷脂,加15 mL二氯甲烷溶解,减压蒸发至形成均匀透明薄膜,加15 mL乙醚溶解已形成的薄膜,然后加入L-ASN羟丙基-β-环糊精包合物溶液10 mL,冰浴中超声后,旋转蒸发至形成乳白色均匀混悬液,即得AHL。将L-ASN及AHL置于4 ℃环境下,于第0、1、5、10、15、20、25、30天分别测定各溶液中L-ASN的活性,考察其稳定性。
1.4 AHL包封率的测定采用葡聚糖凝胶柱法测定AHL的包封率[6]。取AHL混悬液上葡聚糖凝胶G-200柱,Tris-盐酸缓冲液(pH 7.3)洗脱,流速为1.0 mL/min,分离AHL与游离酶,接取AHL部分,乙醚破乳后离心。取上清液加入考马斯亮蓝G-250溶液显色,于波长595 nm处测定其光密度值,计算过柱后的AHL中L-ASN的含量(W1)。另取相同体积未过柱的AHL同法测定,计算出其中L-ASN的含量(W2)。包封率=(W1/W2)×100%。
1.5 AHL粒径、zeta电位与形态的测定[3]取AHL混悬液,用pH为7.3的Tris-盐酸缓冲液稀释20倍,混合均匀后使用马尔文激光粒度仪测定其粒径与zeta电位;同时取部分稀释液滴加在铜网上,用1%的磷钨酸染色,晾干后在透射电子显微镜下观察其形态。
1.6 AHL药代动力学的测定取12只SD大鼠随机分为两组,每组6只,分别静脉注射AHL和L-ASN,剂量均为2 U/g,给药后5 min、10 min、15 min、30 min、45 min、1 h、1.5 h、2 h、3 h、4 h、6 h、8 h、10 h、12 h、24 h、48 h眼眶下静脉丛取血,置于肝素化的离心管中,1 006×g离心10 min,取上层血浆样品,采用奈斯勒试剂显色法测定L-ASN的活性[3, 7]。L-ASN活性单位定义为:在37 ℃、pH 7.3的条件下,每分钟催化天冬酰胺水解释放1 μmol氨所需的酶量。根据所测结果绘制活性-时间曲线,采用DAS 2.1.1软件计算主要的药代动力学参数[8]。
1.7 统计学处理采用SPSS 17.0软件对数据进行统计学分析。数据以x±s表示,两组间比较采用t检验。检验水准(α)为0.05。
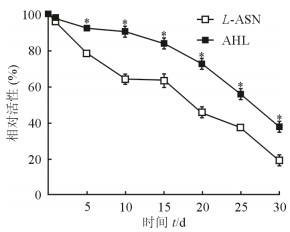
2 结果 2.1 AHL的制备成功制备得到AHL。如图 1所示,4 ℃环境下30 d内AHL的稳定性优于L-ASN(P<0.05)。
|
图 1 L-ASN和AHL稳定性考察 L-ASN:天冬酰胺酶; AHL:载天冬酰胺酶羟丙基-β-环糊精脂质体. *P<0.05与L-ASN比较. n=3, x±s |
2.2 AHL的包封率、粒径、zeta电位与形态
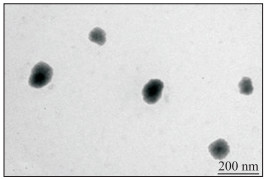
测得AHL的平均包封率为(53.53±0.58)%,平均粒径为(388.99±2.02)nm,平均zeta电位为(-8.56±0.75)mV。由图 2可见,制备得到的AHL呈类球形,大小分布较均匀。
|
图 2 载天冬酰胺酶羟丙基-β-环糊精脂质体的透射电子显微镜图 |
2.3 AHL的活性-时间曲线
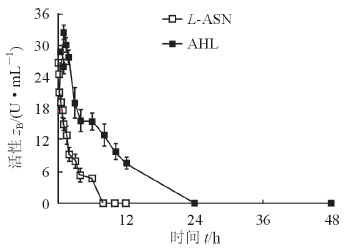
SD大鼠分别静脉注射AHL和L-ASN后定时采血,测定不同时间点血浆中L-ASN的活性(AHL组中L-ASN的活性是包载与游离L-ASN活性的总和)。如图 3所示,AHL的活性-时间曲线下面积大于L-ASN(P<0.05)。在大鼠体内,注射L-ASN后大鼠血浆中L-ASN的活性迅速下降,8 h时已接近于0 U/mL;而注射AHL后大鼠血浆中L-ASN的活性下降趋势缓慢,12 h时仍能检测到较高活性。这表明AHL能提高L-ASN在大鼠体内的血药浓度水平,延长其作用时间。
|
图 3 L-ASN和AHL的活性-时间曲线 L-ASN:天冬酰胺酶; AHL:载天冬酰胺酶羟丙基-β-环糊精脂质体. n=6, x±s |
2.4 AHL的主要药代动力学参数
L-ASN和AHL的主要药动学参数见表 1。与L-ASN相比,AHL的相对生物利用度为344.05%,说明AHL能提高L-ASN的生物利用度。AHL的0~48 h平均滞留时间约为L-ASN的2.21倍,表明AHL能延长L-ASN在生物体内的作用时间。AHL的峰浓度(Cmax)约为L-ASN的1.2倍,表明AHL能提高L-ASN在生物体内的活性。AHL的达峰时间(Tmax)约为L-ASN的10.8倍,表明AHL具有缓释作用。
|
|
表 1 L-ASN和AHL的主要药代动力学参数 |
3 讨论
本研究采用逆相蒸发法制备AHL。制备脂质体的方法很多,如薄膜分散法、乙醇注入法、冷冻干燥法及逆相蒸发法等[3-4, 9-10]。薄膜分散法用于难溶性,尤其是挥发油类药物的制备;乙醇注入法制备速度慢,不适合大规模生产,用于醇溶性及挥发油类药物的制备;冷冻干燥法制备的脂质体稳定性好,但是需要加入保护剂,用于热不稳定性药物的制备;逆相蒸发法应用广、包封率高,适合制备水溶性的大分子类药物,通常采用逆相蒸发法制备酶类脂质体[3, 6]。酶类脂质体的包封率普遍不高,有些甚至低至10%,本研究中AHL的平均包封率为(53.53±0.58)%,高于L-ASN脂质体[11],远高于抗自由基复酶脂质体[12],表明AHL的包封较好。粒径和zeta电位是评价脂质体的重要指标。脂质体的粒径一般为50~1 000 nm[13],而酶类药物脂质体的粒径一般为250~850 nm[13-16],本研究中AHL的平均粒径为(388.99±2.02)nm,与文献报道一致。
有文献报道,大鼠静脉注射L-ASN纳米囊后峰浓度为29.95 U/mL,0~48 h曲线下面积为137.34 U/(mL • h)[7]。本研究中AHL的给药剂量与L-ASN纳米囊[7]一致,其峰浓度较天冬酰胺酶纳米囊提高了8%,且其相对L-ASN纳米囊的生物利用度为144.32%,而AHL相对L-ASN的生物利用度为344.05%,可见AHL能有效提高药物的生物利用度。分析AHL生物利用度提高的原因可能有:(1)羟丙基-β-环糊精脂质体对药物有保护作用,能提高L-ASN抗吞噬细胞清除和抗蛋白酶水解的能力[17-19];(2)羟丙基-β-环糊精脂质体能增强药物的稳定性,使L-ASN长时间保持较高活性[18, 20]。本研究中静脉注射AHL 1 h后大鼠血浆中L-ASN的活性最高,这与尿酸酶多囊脂质体静脉注射1 h后出现最大活性[15]类似。
综上所述,AHL能有效改善L-ASN的药代动力学特性,提高其生物利用度。本研究成功制备了AHL,为L-ASN及其他蛋白多肽类药物的临床应用奠定了基础。
| [1] |
BAHREINI E, AGHAIYPOUR K, ABBASALIPOURKABIR R, MOKARRAM A R, GOODARZI M T, SAIDIJAM M. Preparation and nanoencapsulation of L-asparaginase Ⅱ in chitosan-tripolyphosphate nanoparticles and in vitro release study[J/OL]. Nanoscale Res Lett, 2014, 9: 340. doi: 10.1186/1536-276x-9-340.
|
| [2] |
KARAMITROS C S, YASHCHENOK A M, MÖHWALD H, SKIRTACH A G, KONRAD M. Preserving catalytic activity and enhancing biochemical stability of the therapeutic enzyme asparaginase by biocompatible multilayered polyelectrolyte microcapsules[J]. Biomacromolecules, 2013, 14: 4398-4406. DOI:10.1021/bm401341k |
| [3] |
WAN S L, HE D, YUAN Y M, YAN Z, ZHANG X, ZHANG J. Chitosan-modified lipid nanovesicles for efficient systemic delivery of L-asparaginase[J]. Colloids Surf B Biointerfaces, 2016, 143: 278-284. DOI:10.1016/j.colsurfb.2016.03.046 |
| [4] |
CHEN J, LU S, GU W, PENG P, DONG J, XU F, et al. Characterization of 9-nitrocamptothecin-in-cyclodextrin-in-liposomes modified with transferrin for the treating of tumor[J]. Int J Pharm, 2015, 490: 219-228. DOI:10.1016/j.ijpharm.2015.05.047 |
| [5] |
ZHANG L, ZHANG Q, WANG X, ZHANG W, LIN C, CHEN F, et al. Drug-in-cyclodextrin-in-liposomes:a novel drug delivery system for flurbiprofen[J]. Int J Pharm, 2015, 492: 40-45. DOI:10.1016/j.ijpharm.2015.07.011 |
| [6] |
ZHOU Y, ZHANG M, HE D, HU X, XIONG H, WU J, et al. Uricase alkaline enzymosomes with enhanced stabilities and anti-hyperuricemia effects induced by favorable microenvironmental changes[J/OL]. Sci Rep, 2017, 7: 46390. doi: 10.1038/srep46390.
|
| [7] |
谢江川, 胡雪原, 晏子俊, 周云莉, 张景勍. 载天冬酰胺酶自组装纳米囊的药动学及生物等效性[J]. 第二军医大学学报, 2016, 37: 690-693. XIE J C, HU X Y, YAN Z J, ZHOU Y L, ZHANG J Q. Pharmacokinetics and bioequivalence of self-assembly nanocapsules loaded with asparaginase[J]. Acad J Sec Mil Med Univ, 2016, 37: 690-693. |
| [8] |
邓雪, 何丹, 熊华蓉, 周云莉, 张景勍. 静脉注射尿酸酶多囊脂质体的药代动力学和药效学研究[J]. 四川大学学报(医学版), 2015, 46: 688-691. |
| [9] |
张冬青, 程怡, 白丛林, 吴琼, 庞盖豪. 苦参素空间稳定脂质体的制备及其药剂学性质考察[J]. 中药材, 2011, 34: 786-789. |
| [10] |
CHEN H, WU J, SUN M, GUO C, YU A, CAO F, et al. N-trimethyl chitosan chloride-coated liposomes for the oral delivery of curcumin[J]. J Liposome Res, 2012, 22: 100-109. DOI:10.3109/08982104.2011.621127 |
| [11] |
王弘, 吴梧桐, 顾学裘. 重组L-门冬酰胺酶空前体脂质体的研制及其包封率的测定[J]. 沈阳药科大学学报, 1999, 16: 235-238. DOI:10.3969/j.issn.1006-2858.1999.04.001 |
| [12] |
晋可, 李颖, 尹宗宁, 吴冰玉. 抗自由基复酶脂质体的制备及其性质的初步研究[J]. 华西药学杂志, 2009, 24: 452-454. |
| [13] |
SOLARO R, CHIELLINI F, BATTISTI A. Targeted delivery of protein drugs by nanocarriers[J]. Materials, 2010, 3: 1928-1980. DOI:10.3390/ma3031928 |
| [14] |
陈焱, 黄健花, 蔡春明, 王兴国. 过氧化氢酶固体脂质纳米粒的制备[J]. 食品与生物技术学报, 2011, 30: 489-495. |
| [15] |
XIONG H, ZHOU Y, ZHOU Q, HE D, WAN S, TAN Q, et al. Nanosomal microassemblies for highly efficient and safe delivery of therapeutic enzymes[J]. ACS Appl Mater Interfaces, 2015, 7: 20255-20263. DOI:10.1021/acsami.5b05758 |
| [16] |
谢江川, 何丹, 胡雪原, 周云莉, 晏子俊, 陈薇. 透明质酸修饰的尿酸酶脂质体的制备及特性[J]. 第二军医大学学报, 2016, 37: 1076-1081. XIE J C, HE D, HU X Y, ZHOU Y L, YAN Z J, CHEN W, et al. Preparation and characterization of hyaluronic acid-uricase liposomes[J]. Acad J Sec Mil Med Univ, 2016, 37: 1076-1081. |
| [17] |
HAYASHIDA K, HIGASHI T, KONO D, MOTOYAMA K, WADA K, ARIMA H. Preparation and evaluation of cyclodextrin polypseudorotaxane with PEGylated liposome as a sustained release drug carrier[J]. Beilstein J Org Chem, 2014, 10: 2756-2764. DOI:10.3762/bjoc.10.292 |
| [18] |
MATLOOB A H, MOURTAS S, KLEPETSANIS P, ANTIMISIARIS S G. Increasing the stability of curcumin in serum with liposomes or hybrid drug-in-cyclodextrin-in-liposome systems:a comparative study[J]. Int J Pharm, 2014, 476: 108-115. DOI:10.1016/j.ijpharm.2014.09.041 |
| [19] |
GHARIB R, GREIGE-GERGES H, FOURMENTIN S, CHARCOSSET C, AUEZOVA L. Liposomes incorporating cyclodextrin-drug inclusion complexes:current state of knowledge[J]. Carbohydr Polym, 2015, 129: 175-186. DOI:10.1016/j.carbpol.2015.04.048 |
| [20] |
ALOMRANI A H, SHAZLY G A, AMARA A A, BADRAN M M. Itraconazole-hydroxypropyl-β-cyclodextrin loaded deformable liposomes:in vitro skin penetration studies and antifungal efficacy using Candida albicans as model[J]. Colloids Surf B Biointerfaces, 2014, 121: 74-81. DOI:10.1016/j.colsurfb.2014.05.030 |
 2019, Vol. 40
2019, Vol. 40


