恶性肿瘤严重危害人类健康。全球肿瘤流行病统计数据显示,2018年全球估计有大约1 810万癌症新发病例和960万癌症死亡病例[1]。据我国国家癌症登记中心报告,2014年全国癌症新发病例数为380.4万例,占全球的20%以上,死亡病例数为229.6万例[2]。恶性肿瘤的早期诊断和精准治疗是提高患者生存率和减轻社会负担的关键。病理诊断是确诊恶性肿瘤的金标准,病理学和分子生物学特征对肿瘤治疗方案的选择起着决定性作用[3-4]。海量的病理切片和分子生物学数据需要及时、准确地判读,这给病理医师带来巨大的挑战。
数字化病理玻片扫描技术结合人工智能(artificial intelligence,AI)算法识别肿瘤组织和细胞为病理学带来新的发展空间[5-7]。AI可协助病理医师快速、精准地识别肿瘤细胞,提高工作效率,减少漏诊和误诊发生率,同时可以实现肿瘤细胞与肿瘤内部特征的定量化和可视化[8-11]。目前AI算法主要以监督学习和弱监督学习为基础,需要高标准的大量数据和高质量的标注数据来训练。然而,病理取材和制片还未实现完全自动化,仍主要依靠病理医师和技术人员手工取材、切片和染色,由此产生的数据质量差异较大[12]。同时,由于肿瘤类型的复杂性和肿瘤细胞的异质性[13],肿瘤病理数据标注需要病理医师具有极高的临床水平和极强的耐心,但因病理医师短缺、繁忙,数据标注常由低年资医师或短时间培训后上岗的非业内人员承担,易产生错误的标注和错误的算法,导致一个机构研发的病理AI产品在其他机构出现“水土不服”。
基于病理AI的上述困局,制订肿瘤病理数据集建设和数据标注质量控制的标准规范势在必行。我们组建了《实体瘤病理数据集建设和数据标注质量控制专家共识》筹备组,根据长期的肿瘤病理标注实践经验,经过反复讨论,在实体瘤病理数据集的建设和数据标注质量控制方面达成初步意见,以期统一对病理AI专用数据标注规则和方法的理解与应用,促进病理AI产业全链条协同发展,加速病理AI产品的完善。
1 数据集适用范围和标本来源我国现阶段病理AI产品离注册申报阶段尚有很长一段距离。目前,实体瘤病理数据集主要用于病理AI产品的研发、雏形AI产品的验证、病理从业人员的再教育[14]、政府部门人员的决策、多组学和可视化模型的基础研究等。基于实体瘤病理数据集,AI产品可以实现以下多种功能:(1)对肿瘤组织和细胞进行检出、分类和分割;(2)对肿瘤细胞进行定量分析,如细胞数量、核分裂数、核质比等;(3)对肿瘤内部特征进行提取,如肿瘤浸润淋巴细胞(tumor-infiltrating lymphocyte,TIL)、肿瘤间质比(tumor-stroma ratio,TSR)、外周神经侵犯(perineural invasion,PNI)和免疫组织化学特征等;(4)预警非肿瘤性病变。
数据集来源于各种实体瘤病理标本,包括内镜活组织检查标本、穿刺活组织检查标本、手术切除标本、术中冰冻组织标本、转移淋巴结切除标本和远隔脏器转移组织标本等。由于细胞学标注特点的差异,胸腹水细胞学标本未被纳入。
1.1 活组织检查标本活组织检查标本包括内镜下钳取的病变组织和穿刺取得的组织标本。内镜下活组织检查主要用于空腔脏器病变,如食管癌、胃癌、肠癌、膀胱癌、支气管病变等;穿刺活组织检查主要用于非空腔脏器病变,如甲状腺癌、肝癌、胰腺癌、肺癌、前列腺癌、淋巴结转移灶等。活组织检查的目的在于明确诊断,以便临床实施择期手术或采取其他治疗措施。活组织检查标本的特点是组织块小,而且在钳夹过程中组织因受到挤压细胞学形态有可能发生变异,增加了诊断难度。
1.2 手术切除标本主要指用10%中性甲醛溶液固定的经手术切除的肿瘤原发灶标本,按病理学操作常规取材[15],包括癌旁组织、肿瘤中心病变和肿瘤边缘交界处组织。对于具有结构层次的器官,需包含组织的各个层面,如消化道肿瘤的取材需含有黏膜层、黏膜下层、肌层和浆膜层。
1.3 术中冰冻组织标本冰冻病理切片指手术中切取一小块组织,不经过常规的固定、脱水和石蜡包埋等繁冗的制片程序,而是以特制的冰冻切片包埋剂(tissue freezing medium,OCT)为介质将组织冻结于-20 ℃左右,然后用冰冻切片机切片。
1.4 转移淋巴结切除标本主要指区域转移淋巴结,根据临床要求,术中清扫各站淋巴结,用10%中性甲醛溶液固定,按病理学操作常规取材。取材时尽量去除淋巴结周围脂肪组织,完整切取淋巴结后制备成蜡块,并对每一站淋巴结进行标记。
1.5 远隔脏器转移组织标本包括同时性和异时性手术切除转移灶,如结肠癌肝脏转移灶标本。脏器转移标本的取材要求同原发灶。
2 数据要求 2.1 伦理批准与患者隐私保护实体瘤病理数据集的来源有2个:(1)已公开的病理图片数据,如肿瘤基因组图谱(The Cancer Genome Atlas,TCGA)数据库;(2)来自于医疗系统或第三方检验中心的病理图片数据。前者不再需要伦理批复;后者则必须是已获得医院伦理委员会批准或豁免的临床脱敏数据,须根据法律法规的要求保证患者隐私安全和患者利益[16]。
2.2 数据质量要求 2.2.1 标本固定、包埋离体标本应使用10%中性缓冲甲醛溶液及时固定(离体后30 min内)。活组织检查标本的固定时间一般是24 h,对于穿刺等活组织检查样本,固定时间控制在6~24 h为佳。大手术标本固定时间不超过48 h。组织标本的脱水、透明和浸蜡需根据教科书、文献和既往的经验合理设置程序、选择合适试剂,使用全自动化仪器自动完成,减少人为因素导致的误差[17-18]。组织标本的包埋可由技术人员手工完成,或使用自动化仪器完成。
2.2.2 组织切片石蜡包埋组织切片需由经验丰富的病理技术人员完成。石蜡切片厚度为3~5 μm,取无刀痕和破损的切片置于42 ℃温水中完全展开,去除褶皱,贴附于载玻片上,使组织位于载玻片中央,与边缘留有一定距离。将载玻片在烤台上或65~75 ℃温箱内稍加烘烤,待组织切片上的石蜡全部融化(一般30~60 min)、水分彻底烘干,备用。载玻片的大小为75 mm×25 mm,厚度为(1.10±0.04)mm。
2.2.3 H-E染色H-E染色建议使用自动染色机完成,或由经验丰富的病理技师完成。染色时脱蜡必须彻底、苏木精染液无杂质、分化得当、去除污渍,封片时避免产生气泡或覆盖不全。建议染色时使用显微镜观察染色程度以调整染色时间,并使用规范化、具有资质的H-E染色试剂。染色结果必须保证胞核呈蓝色、胞质呈红色,红细胞呈桔红色,其他成分呈深浅不同的红色。理想的染色图片应颜色鲜艳、透明、层次感分明。
2.2.4 切片数字化数据集应使用转换成TIFF格式的原始数据,采用金字塔型多页、多块存储模式,不同倍率的图像存储于不同的图像页中,不同倍率按照1/2或1/4降采样存储。图像块像素不低于256×256,有条件的单位可采用1 024×1 024。图像扫描过程中,每个图像需保持连续完整,不得出现模糊、错层、缺失等情况。采用JPEG、JPEG2000或LWZ等压缩标准压缩图像,压缩因子不低于80%;同时也须支持未经压缩的原始数据的存储。成像过程使用的扫描仪必须是符合质控要求、处于产品有效期内的合格产品。
2.3 数据多样性要求为减少偏倚,保证数据集的临床代表性、病理AI产品研发的全面性和实践性,数据集应当尽可能覆盖多个维度、适合多个应用场景。(1)地域维度:产品的预期使用人群必须是全国性的,必须考虑沿海与内陆、南部与北部、三级医院与二级医院的技术水平差异。该数据集应该包括不同地理区域来源的病理切片。图 1显示的是不同地域来源的胃癌淋巴结转移切片,染色差异较大。具体数据量应参考流行病学和统计学要求。(2)场景维度:产品的应用场景包括早期筛查、辅助诊断与分期、指导治疗与评估预后,因此纳入的标本应当涵盖活组织检查标本、手术切除标本和转移标本,同时纳入患者的临床信息和分子生物学信息,便于后续的多组学研究。(3)肿瘤组织维度:产品的研发必须考虑到肿瘤异质性。同一种肿瘤有多个类型,同一个类型又有多种表现形式,如胃癌有10余个类型,其中腺癌又可分为高、中、低分化腺癌[19]。数据集应该包含其中所有类型,具体数量应参考算法和统计学要求。此外,肿瘤组织中的微环境成分,如间质、邻近细胞、血管、淋巴细胞等也应该考虑在内。(4)设备与配置维度:病理切片数字化设备硬件和软件差异较大,可影响到图像的对比度、分辨率、细胞核型分析和肿瘤内部特征提取。根据AI算法实践,推荐扫描分辨率在0.5 μm/pixel以内,保证肿瘤细胞在放大400倍时不失真、不模糊。(5)时间维度:H-E染色极易褪色,褪色后肿瘤组织将难以辨认,因此在进行回顾性研究时,建议涵盖不同年份的病理切片,必要时需重新染色。
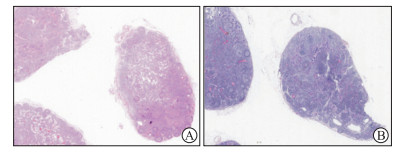
|
图 1 不同地域来源的胃癌淋巴结转移切片 Fig 1 Representative lymph node sections of gastric cancer from different geographical sources A: The picture is from an upper first-class hospital in Shanghai (Changhai Hospital, Naval Medical University [Second Military Medical University]), which is provided by CHEN Ying; B: The picture is from an upper second-class hospital in Jiangsu Province, which is provided by a cooperative unit of YU Guan-zhen. H-E staining. Original magnification: ×40 |
3 标注规范 3.1 标注团队
标注团队必须极具专业性,由标注医师、病理专家、权威专家和技术人员组成。建议标注医师应具有在三级甲等医院病理科从事阅片工作5年以上的资质,职称为资深住院医师或主治医师,能够独立出具病理诊断报告。此外还需1名本专业领域的资深专家(副主任医师及以上职称)负责审核和把关,适时修正遗漏或错误的标注。如果遇到疑难问题,应与权威专家(主任医师)讨论和确认。如果仍无法解决,建议由病理技术人员行免疫组织化学染色或特殊染色后再确定。
标注团队的标注医师和专家事先需接受培训和考核,熟悉标注软件操作,建立标注规则,统一对标注规则的认识。
3.2 标注规则肿瘤类型复杂,且同一类型的肿瘤也具有异质性,为减少反复标注,在确定做某类肿瘤的病理AI识别后,团队成员必须先讨论项目的宏观情况,明确研究目的和识别内容。
3.2.1 确立研究目的明确是研究全玻片还是局部选定区域,只是研究肿瘤细胞本身还是包括肿瘤微环境,根据研究目的决定标注范围、标注内容及研究算法。
3.2.2 明确标注内容根据研究目的确定标注内容,通常为肿瘤细胞和(或)肿瘤微环境成分,肿瘤微环境成分包括脂肪、肌肉、正常组织、坏死组织、TIL、癌栓、PNI、血管等成分[20]。
3.2.3 确定研究算法主要包含分类算法与分割算法。分割算法可以得到更精细的结果,适合对局部选定区域的分析。分类算法相对简单,但效率高,适合对全片分析使用。
3.2.4 注意细节考虑数据细节,防止因数据偏倚出现算法偏差,比如应涵盖每个肿瘤类型,且每一类数量均衡,不可出现一个类型多于另一个类型几倍的现象。
3.3 标注流程肿瘤细胞标注考验标注医师的耐心,一张像素为2 048×2 048的图片可能需要上百个至上千个标记。为提高标注效率,避免返工,标注前须建立规范化的标注流程。
3.3.1 确定标注内容根据算法效率和识别精细度要求,确定是区域标注,还是细胞或癌巢标注。
3.3.2 确立标注模式设定每一类内容标注点的大小和线条粗细、颜色,并作备注。
3.3.3 合理安排标注时间交叉标注简单图像和复杂图像,减少标注的疲劳感。
3.4 标注质量控制由资深病理专家独立对标注结果进行审核与修改,纠正漏诊、误诊和误判。如果遇到疑难问题,应及时汇报,由权威专家共同讨论与确认。
以胃癌淋巴结转移为例,AI的目的有2个:一是识别出肿瘤组织;二是准确判断肿瘤组织占整个淋巴结的比例。为实现该目的,我们按如下流程进行标注:(1)首先用红色线条将淋巴结轮廓完整勾画出来(图 2A);(2)用蓝色线条勾勒出容易与肿瘤细胞和组织混淆的结构,如生发中心(图 2B)和淋巴窦组织(图 2C);(3)用黄色线条重点标记肿瘤组织(图 2D),直到完整地标记整个转移淋巴结(图 2E)。通过学习淋巴结内正常组织和肿瘤组织,AI既能识别淋巴结轮廓又能识别轮廓内的肿瘤组织,最终得出准确的转移面积(图 2F)。

|
图 2 胃癌转移淋巴结的标注流程 Fig 2 Annotated lymph node metastases of gastric cancer The pictures come from the YU Guan-zhen Research Group. A: The outline of lymph nodes is delineated with red lines; B, C: Germinal centers (B) and lymphoid sinus tissues (C) are delineated with blue lines, which are easily confused with tumor cells; D: Tumor tissues are highlighted with yellow lines; E: The entire metastatic lymph nodes are completely labeled; F: By learning the normal tissues and tumor tissues in lymph nodes, artificial intelligence can identify both the contour of lymph nodes and the tumor tissues in the contour, and finally obtain the accurate metastatic area (88.255 7%). H-E staining. Original magnification: ×40 (A, E, F), ×100 (B-D) |
3.5 疑难病例
病理结果是肿瘤诊断的最后关卡,不存在假阴性或假阳性问题,一旦漏诊或误诊将造成深远影响,因此标注过程中需标注出所有的肿瘤细胞,避免被认为是非肿瘤组织。而在肿瘤组织中,有些细胞很难确定是否为肿瘤细胞,尤其是侵袭到间质或淋巴结内的微小转移灶,以及活组织检查标本中被挤压变形的肿瘤细胞。遇到此类问题时,除由专家团队讨论决定外,可借助免疫组织化学技术准确显示组织内散在分布的肿瘤细胞[21]。测序技术,尤其是单细胞测序技术,也能够更加精准地区分细胞类型。
4 部分争议问题讨论 4.1 肿瘤组织和细胞标注的区域性问题肿瘤病理标注到底是标注单个肿瘤细胞或单个腺体,还是肿瘤区域,需要根据应用场景和研究目的灵活调整。对肿瘤活组织检查标本,建议标注肿瘤腺体或者肿瘤细胞;对淋巴结转移灶,建议标注肿瘤区域;对肿瘤原发灶需根据肿瘤类型决定标注内容,如肝癌和肺癌建议区域标注,消化道肿瘤和乳腺癌建议对肿瘤腺体、癌巢和浸润到间质内的散在癌细胞进行精准标注。
4.2 对于形成腺腔的肿瘤标注方式部分消化道来源肿瘤会形成腺腔,既往标注方式是腺体外圈标记一种颜色,腺体内圈标记另一种颜色。然而在实践中我们发现,只标记腺体外圈就能得出理想的算法模型。
4.3 标注过程涉及的主观判断部分病理技术人员在行H-E染色时,对于苏木精和伊红染色的对比认识较为主观,建议设计一套标准病理切片,能够清晰显示蓝色和红色部分,由病理专家和算法人员共同讨论通过,用软件算出各项参数,设置标准。不同医疗机构根据这个标准设置自动H-E染色参数,直至符合要求。
由于肿瘤细胞的确定性原则,肿瘤组织和细胞的标注重复性强,涉及病理医师主观判断的成分较少,绝大多数肿瘤组织和细胞都能被有经验的病理标注医师识别,这些病例的标注仅需1位标注医师即可满足要求。对于很难确定是否为肿瘤细胞的疑难病例,建议至少由2位病理医师同时标注,不一致的地方需根据疑难病例的标注原则进行标注。
执笔者:
于观贞(上海中医药大学附属龙华医院肿瘤科),陈颖[海军军医大学(第二军医大学)长海医院消化内科]
筹备组成员(按汉语拼音顺序排列):
陈颖[海军军医大学(第二军医大学)长海医院消化内科],褚君浩(华东师范大学多维度信息处理上海市重点实验室),樊嘉(复旦大学附属中山医院肝外科,复旦大学肝癌研究所),高强(复旦大学附属中山医院肝外科,复旦大学肝癌研究所),高云姝(解放军总医院肿瘤内科),李郁(西北工业大学生命学院),李庆利(华东师范大学多维度信息处理上海市重点实验室),刘西洋(西安电子科技大学计算机科学与技术学院),倪灿荣[海军军医大学(第二军医大学)长海医院病理科],宋志刚(解放军总医院病理科),于观贞(上海中医药大学附属龙华医院肿瘤科),朱明华[海军军医大学(第二军医大学)长海医院病理科]
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, SIEGEL R L, TORRE L A, JEMAL A. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68: 394-424. DOI:10.3322/caac.v68.6 |
| [2] |
CHEN W, SUN K, ZHENG R, ZENG H, ZHANG S, XIA C, et al. Cancer incidence and mortality in China, 2014[J]. Chin J Cancer Res, 2018, 30: 1-12. DOI:10.21147/j.issn.1000-9604.2018.01.01 |
| [3] |
中国抗癌协会肝癌专业委员会, 中华医学会肝病学分会肝癌学组, 中国抗癌协会病理专业委员会, 中华医学会病理学分会消化病学组, 中华医学会外科学分会肝脏外科学组, 中国抗癌协会临床肿瘤学协作专业委员会, 等. 原发性肝癌规范化病理诊断指南(2015版)[J]. 临床与实验病理学杂志, 2015, 31: 241-246. |
| [4] |
李忠武. 胃癌规范化病理诊断流程及相关问题[J]. 中国实用外科杂志, 2014, 34: 600-604. DOI:10.7504/CJPS.ISSN1005-2208.2014.07.05 |
| [5] |
VOLYNSKAYA Z, EVANS A J, ASA S L. Clinical applications of whole-slide imaging in anatomic pathology[J]. Adv Anat Pathol, 2017, 24: 215-221. DOI:10.1097/PAP.0000000000000153 |
| [6] |
NIAZI M K K, PARWANI A V, GURCAN M N. Digital pathology and artificial intelligence[J/OL]. Lancet Oncol, 2019, 20: e253-e261. doi: 10.1016/S1470-2045(19)30154-8.
|
| [7] |
TIZHOOSH H R, PANTANOWITZ L. Artificial intelligence and digital pathology: challenges and opportunities[J/OL]. J Pathol Inform, 2018, 9: 38. doi: 10.4103/jpi.jpi_53_18.
|
| [8] |
陈颖, 魏培莲, 潘军, 周洁, 董昌盛, 于观贞. 数字化全玻片助力人工智能病理图像决策[J]. 第二军医大学学报, 2018, 39: 840-845. CHEN Y, WEI P L, PAN J, ZHOU J, DONG C S, YU G Z. Digital whole slide helps artificial intelligence in pathological imaging strategies[J]. Acad J Sec Mil Med Univ, 2018, 39: 840-845. |
| [9] |
CHANG H Y, JUNG C K, WOO J I, LEE S, CHO J, KIM S W, et al. Artificial intelligence in pathology[J]. J Pathol Transl Med, 2019, 53: 1-12. DOI:10.4132/jptm.2018.12.16 |
| [10] |
SALTZ J, GUPTA R, HOU L, KURC T, SINGH P, NGUYEN V, et al. Spatial organization and molecular correlation of tumor-infiltrating lymphocytes using deep learning on pathology images[J/OL]. Cell Rep, 2018, 23: 181-193.e7. doi: 10.1016/j.celrep.2018.03.086.
|
| [11] |
QAISER T, MUKHERJEE A, REDDY Pb C, MUNUGOTI S D, TALLAM V, PITKÄAHO T, et al. HER2 challenge contest:a detailed assessment of automated HER2 scoring algorithms in whole slide images of breast cancer tissues[J]. Histopathology, 2018, 72: 227-238. DOI:10.1111/his.2018.72.issue-2 |
| [12] |
张伟, 居红格, 王丽珍, 王欣欣. 外科病理取材相关问题及影响因素分析、总结[J]. 世界最新医学信息文摘, 2015, 15: 148-149. |
| [13] |
CORTÉS J M, DE PETRIS G, LÓPEZ J I. Detection of intratumor heterogeneity in modern pathology: a multisite tumor sampling perspective[J/OL]. Front Med (Lausanne), 2017, 4: 25. doi: 10.3389/fmed.2017.00025.
|
| [14] |
孟艳, 宫丽平. 数字化病理切片数据库在病理学教学应用的思考[J]. 基础医学教育, 2017, 19: 304-306. |
| [15] |
帅智峰, 吴淑琴. 外科病理肿瘤标本的取材方法体会[J]. 齐齐哈尔医学院学报, 2012, 33: 2216-2217. DOI:10.3969/j.issn.1002-1256.2012.16.049 |
| [16] |
PRICE W N 2nd, COHEN I G. Privacy in the age of medical big data[J]. Nat Med, 2019, 25: 37-43. DOI:10.1038/s41591-018-0272-7 |
| [17] |
杨元发, 李秀娟. 病理技术工作的质量控制[J]. 实用医技杂志, 2008, 15: 1053-1055. DOI:10.3969/j.issn.1671-5098.2008.08.070 |
| [18] |
蔡文. 在自动化组织病理制片中, 包埋和切片的质量控制[J]. 解剖科学进展, 2012, 18: 498-499. |
| [19] |
国家"863"重大项目"胃癌分子分型与个体化诊疗"课题组. 胃癌病理分型和诊断标准的建议[J]. 中华病理学杂志, 2010, 39: 266-269. DOI:10.3760/cma.j.issn.0529-5807.2010.04.013 |
| [20] |
KATHER J N, KRISAM J, CHAROENTONG P, LUEDDE T, HERPEL E, WEIS C A, et al. Predicting survival from colorectal cancer histology slides using deep learning: a retrospective multicenter study[J/OL]. PLoS Med, 2019, 16: e1002730. doi: 10.1371/journal.pmed.1002730.
|
| [21] |
于观贞, 魏培莲, 陈颖, 朱明华. 人工智能在肿瘤病理诊断和评估中的应用与思考[J]. 第二军医大学学报, 2017, 38: 1349-1354. YU G Z, WEI P L, CHEN Y, ZHU M H. Artificial intelligence in pathological diagnosis and assessment of human solid tumor:application and thinking[J]. Acad J Sec Mil Med Univ, 2017, 38: 1349-1354. |
 2019, Vol. 40
2019, Vol. 40


