2. 上海药物转化工程技术研究中心, 上海 201203
2. Shanghai Engineering Research Center of Pharmaceutical Translation & Shanghai Industrial Technology Institute, Shanghai 201203, China
肝细胞癌(hepatocellular carcinoma,HCC)是世界上最常见的恶性肿瘤之一,预后不良,是全球癌症死亡的第二大原因[1],据统计,2018年因HCC死亡的人数约占癌症总死亡人数的9.1%[1-2]。尽管医疗技术发展迅速,但HCC仍然没有可治愈的策略。因此,探寻评估HCC进展和预后的特异性标志物具有重要的临床意义。C型凝集素结构域家族1成员B(C-type lectin domain family 1 member B,CLEC1B)又称C型凝集素样受体2(C-type lectin-like receptor 2,CLEC-2),是一种血小板相关分子,该分子由肿瘤周围的活化血小板分泌,并对血小板聚集和肿瘤转移具有抑制作用[3-4]。近年研究发现CLEC1B在HCC中表达下调并能预测患者的临床结局,其可能是程序性细胞死亡蛋白1及其配体(programmed cell death 1/programmed cell death ligand 1,PD-1/PD-L1)免疫疗法的潜在治疗靶标[5-6]。本研究通过生物信息学方法和临床病例资料评估CLEC1B在HCC中的表达变化,分析CLEC1B表达与HCC患者临床病理特征之间的关系,并探讨CLEC1B对HCC的潜在预后意义。
1 材料和方法 1.1 生物信息学分析 1.1.1 基因表达差异分析利用基因表达汇编(Gene Expression Omnibus,GEO)数据库(https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE49515, https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE115018)检索HCC组织芯片数据(GSE49515、GSE115018),对癌组织及正常对照样本中的基因进行差异表达分析。在肿瘤基因组图谱(The Cancer Genome Atlas,TCGA)数据库(http://ualcan.path.uab.edu/cgi-bin/TCGAExResultNew2.pl?genenam=CLEC1B&ctype=LIHC)筛选HCC转录组数据集,以获得来自50个非肿瘤肝组织和371个HCC癌组织的RNA测序数据,获取CLEC1B的表达水平和HCC患者的随访信息。
1.1.2 信号通路富集分析使用基因集富集分析(Gene Set Enrichment Analysis,GSEA)软件(http://software.broadinstitute.org/gsea/index.jsp)探寻HCC中与CLEC1B相关的信号通路。通过排列分析1 000次获得归一化富集分数(normalized enrichment score,NES)。GSEA中显著富集基因组的标准为P<0.05,错误发现率(false discovery rate,FDR)<0.25。
1.2 临床研究 1.2.1 临床资料收集海军军医大学(第二军医大学)东方肝胆外科医院2014年1月至2015年12月经手术切除治疗的37例HCC患者的癌组织和相应的癌旁组织(距癌组织边缘至少2 cm),保存于液氮中;获取患者外周静脉血样本,分离血浆后置于EP管,保存于-80 ℃冰箱。37例HCC患者中,男28例、女9例,年龄为32~78岁(中位年龄为55岁)。所有入选患者术前均未接受放射治疗或化学治疗。收集患者年龄、性别、甲胎蛋白、乙型肝炎表面抗原、肿瘤大小、肿瘤数量、肿瘤分化程度、TNM分期、血管侵犯和肿瘤出血等资料。以海军军医大学(第二军医大学)东方肝胆外科医院同期37例健康体检者为健康对照组,其中男22例、女15例,年龄为28~77岁(中位年龄为51岁),获取外周静脉血样本并分离血浆。本研究通过海军军医大学(第二军医大学)东方肝胆外科医院临床试验伦理委员会批准,所有研究对象均对研究知情同意,并签署知情同意书。
1.2.2 CLEC1B mRNA检测采用TRIzol试剂盒(美国Invitrogen公司)提取样本组织的总RNA,使用反转录试剂盒(日本TaKaRa公司)将RNA反转录成cDNA。使用SYBR Premix EX Taq试剂盒(日本TaKaRa公司)进行加样,样品在实时荧光定量PCR仪(美国ABI公司)中进行扩增反应。反应体系为25 µL:SYBR Mix 12.5 µL,上游和下游引物各0.5 µL,cDNA 2.5 µL,RNase Free ddH2O 9 µL。反应条件:95 ℃ 10 min,95 ℃ 15 s,60 ℃ 1 min,连续进行40个循环。引物序列:CLEC1B上游5'-AGC GCA ATT ACC TAC AAG GTG-3',下游5'-CTT CCC ATG TTA AGT TGT GCC T-3';甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)上游5'-GGA GCG AGA TCC CTC CAA AAT-3',下游5'-GGC TGT TGT CAT ACT TCT CAT GG-3'。以GAPDH为内参照,采用2-ΔΔCt法计算产物相对表达量。
1.2.3 CLEC1B蛋白检测使用总蛋白提取试剂盒(美国Bio-Rad公司)提取组织切片总蛋白,用BCA法测蛋白水平。取50 μg总蛋白,变性后进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,用半干法将电泳产物转移到聚偏氟乙烯膜上,以5%脱脂奶粉封闭(4 ℃封闭2 h),滴加CLEC1B抗体(英国Abcam公司)4 ℃过夜;用TBST洗膜4次,每次10 min,滴加辣根过氧化物酶标记的山羊抗兔IgG(英国Abcam公司),37 ℃孵育2 h;用TBST洗膜4次,每次10 min。使用化学发光试剂盒(北京科美东雅生物技术有限公司)进行显色,用凝胶电泳成像分析系统(南京驰顺科技发展有限公司,型号:GIS300)自动成像。以GAPDH为内参照分析CLEC1B蛋白的相对含量。
1.2.4 CLEC1B蛋白水平检测采用酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测血浆中CLEC1B蛋白水平,试剂盒购自南京赛泓瑞生物科技有限公司。在各孔中加入受试者血浆样本、标准品及反应液,应用多功能酶标分析仪(深圳汇松科技发展有限公司,型号:MB-580)检测450 nm波长处光密度值。利用空白孔及标准孔拟合logistic曲线,计算HCC患者血浆中CLEC1B蛋白水平。
1.2.5 随访采用电话随访的方式对所有患者及家属进行随访,采用门诊随访方式对仍存活患者进行随访。随访截止日期为2019年1月。所有患者均完成随访。
1.3 统计学处理应用SPSS 22.0软件对数据进行统计分析。服从正态分布的计量资料以x±s表示,两组间的比较采用独立样本t检验或配对t检验;不服从正态分布的计量资料以中位数(下四分位数,上四分位数)表示,两组间的比较采用非参数检验。计数资料的组间比较采用χ2检验。采用受试者工作特征(receiver operating characteristic,ROC)曲线评估CLEC1B诊断HCC的价值,以约登指数(约登指数=灵敏度+特异度-1)最大值为截断值。采用Kaplan-Meier法进行生存分析,组间差异的比较采用log-rank检验。检验水准(α)为0.05。
2 结果 2.1 CLEC1B在HCC癌组织中低表达利用GEO数据库HCC组织芯片数据(GSE49515、GSE115018)获得癌组织和正常对照样本中的差异表达基因,图 1A和1B所示分别为来自2个芯片的前20个差异表达基因,可见CLEC1B在HCC癌组织中表达下调。将2个芯片的差异表达基因取交集,结果如图 1C所示。在TCGA数据库中对CLEC1B的表达水平进行检索,结果(图 1D)亦显示CLEC1B在HCC癌组织中的表达下调。为了进一步证明CLEC1B在HCC癌组织中的差异表达,利用实时荧光定量PCR和蛋白质印迹法检测37例HCC患者临床配对样本中CLEC1B的表达,结果(图 1E、1F)显示癌组织中CLEC1B mRNA和蛋白表达水平均低于癌旁组织,差异均有统计学意义(P均<0.05)。
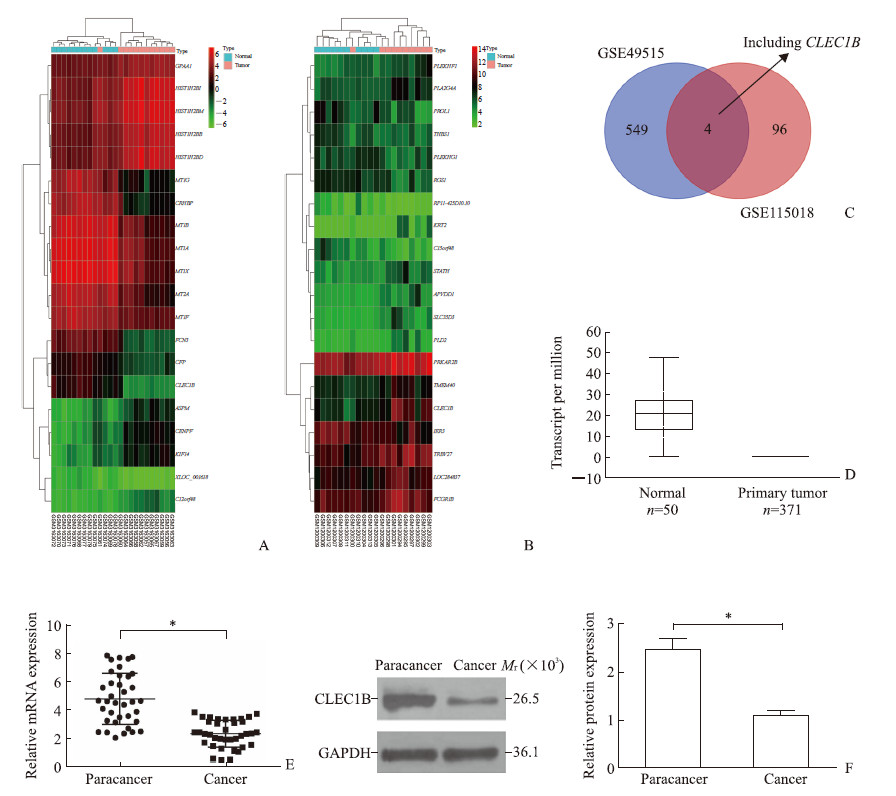
|
图 1 CLEC1B在HCC癌组织中的差异表达 Fig 1 Differential expression of CLEC1B in cancer tissues of HCC patients A: GSE49515 chip analysis of differential expression clustering heat map of HCC in GEO database; B: GSE115018 chip analysis of differential expression clustering heat map of HCC in GEO database; C: Wayne map of chip differential gene results; D: Expression of CLEC1B gene in HCC in TCGA database; E: Quantitative real-time PCR detection of CLEC1B mRNA expression level of 37 HCC patients; F: CLEC1B protein expression of 37 HCC patients by Western blotting. CLEC1B: C-type lectin domain family 1 member B; HCC: Hepatocellular carcinoma; GEO: Gene Expression Omnibus; TCGA: The Cancer Genome Atlas. *P < 0.05 |
2.2 CLEC1B表达与HCC患者临床病理特征的关系
37例HCC患者中,利用mRNA检测结果取均值,以高于均值为高表达,低于均值为低表达。其中,CLEC1B高表达者16例,低表达者21例。经χ2检验发现,CLEC1B低表达组中存在肿瘤出血的患者比例高于CLEC1B高表达组,差异有统计学意义(P<0.01)。CLEC1B与HCC患者临床病理特征的关系见表 1。
|
|
表 1 CLEC1B表达与HCC患者临床病理特征的关系 Tab 1 Relationship between CLEC1B expression and clinicopathological characteristics of HCC patients |
2.3 CLEC1B诊断HCC的价值
对37例HCC患者血浆中CLEC1B蛋白水平进行ROC曲线分析,见图 2,得出CLEC1B诊断HCC的最佳截断值为62.44 ng/mL(曲线下面积为0.966,95%置信区间:0.957~0.975,P<0.01)。以62.44 ng/mL作为CLEC1B诊断HCC的标准,可达到最佳诊断效能(灵敏度为92.7%,特异度为91.3%)。
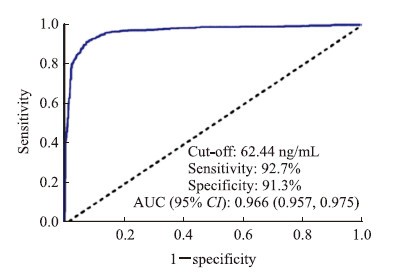
|
图 2 CLEC1B诊断HCC的ROC曲线分析 Fig 2 ROC curve analysis of CLEC1B in diagnosis of HCC CLEC1B: C-type lectin domain family 1 member B; HCC: Hepatocellular carcinoma; ROC: Receiver operating characteristic; AUC: Area under curve; CI: Confidence interval |
2.4 CLEC1B与HCC患者预后的关系
采用Kaplan-Meier法分析HCC患者的生存情况,通过log-rank检验分析CLEC1B mRNA表达与HCC患者预后的关系,结果显示CLEC1B高表达组患者的总生存期延长,与CLEC1B低表达组相比差异有统计学意义(P<0.01,图 3)。

|
图 3 CLEC1B表达与HCC患者预后的关系 Fig 3 Relationship between CLEC1B and prognosis of HCC patients CLEC1B: C-type lectin domain family 1 member B; HCC: Hepatocellular carcinoma |
2.5 HCC中与CLEC1B相关的信号通路
通过对CLEC1B低表达和高表达数据集进行GSEA分析,探寻在HCC中与CLEC1B基因相关的信号通路,结果(图 4)显示,在HCC中CLEC1B基因与ATR信号通路(ATM and Rad3-related pathway)、细胞周期通路、DNA修复通路、myc信号通路呈现出一致的表达差异趋势。
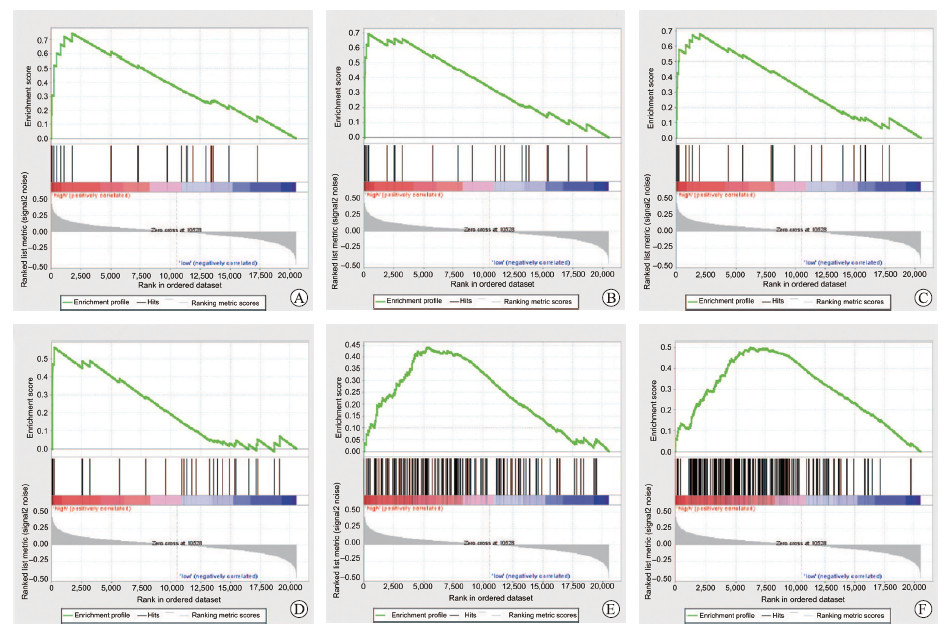
|
图 4 GSEA鉴定HCC中与CLEC1B基因相关的信号通路 Fig 4 GSEA identifying signaling pathways associated with CLEC1B gene A: ATR pathway; B: Cell cycle pathway; C: G2 pathway; D: G1 pathway; E: DNA repair pathway; F: Myc signaling pathway. GSEA: Gene Set Enrichment Analysis; HCC: Hepatocellular carcinoma; CLEC1B: C-type lectin domain family 1 member B; ATR: ATM and Rad3-related |
3 讨论
HCC往往进展快速、预后不良,对大多数常规抗肿瘤药耐药,其已成为世界性的难题[7]。在临床实践中,分子生物标志物是预测患者疾病进展和预后的重要工具。CLEC1B是诱导血小板聚集的蛇毒毒素的活化受体,能够抑制血小板聚集[8],对于维持整体血管完整性必不可少[9],可调节Toll样受体激动剂并促进白细胞介素10的产生[10]。CLEC1B具有内源性配体,即在淋巴内皮、次级淋巴器官基质和一些肿瘤细胞上发现的黏蛋白样糖蛋白podoplanin[3]。CLEC1B与podoplanin结合后可引发强烈的血小板活化,从而促进肿瘤转移[11]。在动物模型中使用药物抑制CLEC1B与podoplanin结合后,可抑制肿瘤转移,并增强顺铂的治疗效果[12]。上述证据表明CLEC1B在肿瘤免疫调节和转移中具有潜在作用,可能通过抑制性免疫调节和血小板活化2种方式介导肿瘤进展,并有望成为肿瘤治疗的靶标。目前有关HCC中CLEC1B表达及作用的研究不多,Hu等[6]研究发现CLEC1B可能是PD-1/PD-L1免疫疗法的潜在靶标,并且其低表达可能是存在肿瘤出血的HCC的一个有价值的预后因素。
本研究利用生物信息学分析和临床样本资料证实CLEC1B在HCC中低表达,并且CLEC1B低表达与肿瘤出血有关,与既往研究结果[6]一致。本研究还分析了血浆中CLEC1B水平对HCC的诊断价值,结果显示,以62.44 ng/mL作为截断值时,CLEC1B的诊断效能最佳(ROC曲线下面积为0.966,灵敏度为92.7%,特异度为91.3%),提示血浆中CLEC1B水平可作为诊断HCC的生物标志物。此外,本研究还通过GSEA鉴定了HCC中与CLEC1B基因相关的信号通路,结果发现在HCC中,CLEC1B基因与ATR通路、细胞周期通路、DNA修复通路、myc信号通路呈现出一致的表达差异趋势,提示这些通路可能与HCC中CLEC1B的作用机制有关,但今后仍需开展相关分子细胞生物学实验加以验证。
综上所述,本研究发现HCC中CLEC1B呈低表达状态并与肿瘤出血有关,血浆中CLEC1B水平可作为诊断HCC的生物标志物;ATR通路、细胞周期通路、DNA修复通路、myc信号通路可能与HCC中CLEC1B的作用机制有关,但仍需进一步验证。CLEC1B有望成为HCC诊断和预后评估的生物标志物,也为HCC治疗提供了潜在分子靶点。
| [1] |
YANG J D, NAKAMURA I, ROBERTS L R. The tumor microenvironment in hepatocellular carcinoma:current status and therapeutic targets[J]. Semin Cancer Biol, 2011, 21: 35-43. DOI:10.1016/j.semcancer.2010.10.007 |
| [2] |
BRAY F, FERLAY J, SOERJOMATARAM I, SIEGEL R L, TORRE L A, JEMAL A. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68: 394-424. DOI:10.3322/caac.v68.6 |
| [3] |
SUZUKI-INOUE K, KATO Y, INOUE O, KANEKO M K, MISHIMA K, YATOMI Y, et al. Involvement of the snake toxin receptor CLEC-2, in podoplanin-mediated platelet activation, by cancer cells[J]. J Biol Chem, 2007, 282: 25993-26001. DOI:10.1074/jbc.M702327200 |
| [4] |
COLONNA M, SAMARIDIS J, ANGMAN L. Molecular characterization of two novel C-type lectin-like receptors, one of which is selectively expressed in human dendritic cells[J]. Eur J Immunol, 2000, 30: 697-704. DOI:10.1002/(ISSN)1521-4141 |
| [5] |
CRITELLI R, MILOSA F, FAILLACI F, CONDELLO R, TUROLA E, MARZI L, et al. Microenvironment inflammatory infiltrate drives growth speed and outcome of hepatocellular carcinoma: a prospective clinical study[J/OL]. Cell Death Dis, 2017, 8: e3017. doi: 10.1038/cddis.2017.395.
|
| [6] |
HU K, WANG Z M, LI J N, ZHANG S, XIAO Z F, TAO Y M. CLEC1B expression and PD-L1 expression predict clinical outcome in hepatocellular carcinoma with tumor hemorrhage[J]. Transl Oncol, 2018, 11: 552-558. DOI:10.1016/j.tranon.2018.02.010 |
| [7] |
SUN Y L, CAI J Q, LIU F, BI X Y, ZHOU L P, ZHAO X H. Aberrant expression of peroxiredoxin 1 and its clinical implications in liver cancer[J]. World J Gastroenterol, 2015, 21: 10840-10852. DOI:10.3748/wjg.v21.i38.10840 |
| [8] |
MAY F, HAGEDORN I, PLEINES I, BENDER M, VÖGTLE T, EBLE J, et al. CLEC-2 is an essential platelet-activating receptor in hemostasis and thrombosis[J]. Blood, 2009, 114: 3464-3472. DOI:10.1182/blood-2009-05-222273 |
| [9] |
HERZOG B H, FU J, WILSON S J, HESS P R, SEN A, MCDANIEL J M, et al. Podoplanin maintains high endothelial venule integrity by interacting with platelet CLEC-2[J]. Nature, 2013, 502: 105-109. DOI:10.1038/nature12501 |
| [10] |
MOURÃO-SÁ D, ROBINSON M J, ZELENAY S, SANCHO D, CHAKRAVARTY P, LARSEN R, et al. CLEC-2 signaling via Syk in myeloid cells can regulate inflammatory responses[J]. Eur J Immunol, 2011, 41: 3040-3053. DOI:10.1002/eji.201141641 |
| [11] |
LOWE K L, NAVARRO-NUNEZ L, WATSON S P. Platelet CLEC-2 and podoplanin in cancer metastasis[J]. Thromb Res, 2012, 129(Suppl 1): S30-S37. |
| [12] |
CHANG Y W, HSIEH P W, CHANG Y T, LU M H, HUANG T F, CHONG K Y, et al. Identification of a novel platelet antagonist that binds to CLEC-2 and suppresses podoplanin-induced platelet aggregation and cancer metastasis[J]. Oncotarget, 2015, 6: 42733-42748. |
 2019, Vol. 40
2019, Vol. 40


