2. 上海交通大学医学院附属第九人民医院辅助生殖科, 上海 200011
2. Department of Assisted Reproduction, Ninth People's Hospital of Shanghai, Shanghai Jiao Tong University School of Medicine, Shanghai 200011, China
子宫内膜异位症(endometriosis,EM)是一种雌激素依赖性疾病,是导致不孕的重要原因。20%~50%的不孕女性患有EM,而30%~50%的EM女性存在生殖能力低下或者不孕[1-2]。EM的传统药物治疗方法是通过降低体内雌激素水平抑制异位子宫内膜组织的生长,并使异位子宫内膜萎缩、退化、坏死,但这种传统药物治疗方法对改善EM不孕症患者的生育状况帮助不大[3]。保守性手术可提高EM不孕症患者术后妊娠率,但治疗效果取决于病变程度,且术后复发率高[3];卵巢子宫内膜异位囊肿剔除术在一定程度上影响卵巢储备功能和卵巢对促排卵药物的反应性[4]。而体外受精-胚胎移植(in vitro fertilization-embryo transfer,IVF-ET)因获卵数少、卵子质量低下导致累积妊娠率不高[5-6]。因此,改善EM不孕症患者卵子及胚胎质量、减少流产率、提高EM不孕症患者的临床妊娠率是亟待解决的问题。内异方是治疗EM的有效经验复方,在改善EM患者卵巢功能方面已取得较好的临床疗效[7]。本研究通过动物实验观察内异方对EM小鼠异位灶、盆腔粘连、盆腔微环境的影响,以及对卵泡发育、EM小鼠的生殖能力的改善作用。
1 材料和方法 1.1 实验动物140只雌性C57BL/6小鼠体质量为(20±2)g、20只雄性C57BL/6小鼠体质量为(23±2)g,均为7~8周龄,无特定病原体(specific pathogen free,SPF)级,由上海灵畅生物科技有限公司提供[实验动物生产许可证号:SCXK(沪)2013-0018]。饲养条件:常规小鼠饲料喂养,自由摄水和饮食,室内温度控制在22 ℃,湿度控制在50%,光照周期为12 h光照/12 h黑暗。
1.2 主要仪器与试剂51119100型酶标仪购自美国Thermo公司,1X71型荧光倒置相差显微镜购自日本Olympus公司,BS224s型电子分析天平购自德国Sartorius公司。小鼠IL-2、IL-6、IL-10酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒购自美国eBioscience公司,货号分别为88-7024、88-7064、88-7105。
1.3 药物及处理孕三烯酮胶囊(商品名:言昌,北京紫竹药业有限公司,2.5 mg/粒)购自复旦大学附属妇产科医院。去除胶囊外壳,将粉末溶于蒸馏水中,充分混匀,配置成质量浓度为0.032 mg/mL的孕三烯酮混悬液。内异方(由黄芪、升麻、水蛭、生蒲黄、大血藤、淫羊藿、巴戟天、菟丝子等16味中药组成,共276 g生药)由海军军医大学(第二军医大学)长海医院中药房提供。用蒸馏水煎煮中药,过滤,合并2次滤液,浓缩成生药含量为3.58 g/mL的药液,冷却后装入药瓶,置于4 ℃冰箱中备用。
1.4 动物模型的制备参照文献[8]的造模方法,模拟供体小鼠的经期内膜,将经期内膜碎片注射于受体小鼠腹腔,建立EM小鼠模型;腹腔注射脂肪组织建立假手术小鼠模型。由于造模过程中操作不当,1只EM模型小鼠死亡,2只假手术小鼠死亡,最终获得EM模型小鼠77只和假手术小鼠24只。
1.5 实验分组及给药方式采用随机数字表法将EM模型小鼠随机分为3组:内异方组(n=26)、孕三烯酮组(n=25)和EM模型组(n=26),假手术组24只。按照剂量换算表[9],将成人每天剂量换算成小鼠每天的等效剂量(20 g小鼠剂量=70 kg体质量成人剂量×0.002 6),每次灌胃量为0.2 mL。内异方组予以内异方浓缩汤剂灌胃(35.88 g/kg),每天1次;孕三烯酮组予以孕三烯酮混悬液灌胃(0.325 mg/kg),每周2次,其余5 d每天予等量的蒸馏水灌胃1次;EM模型组和假手术组均予以蒸馏水0.2 mL灌胃,每天1次。以上4组小鼠均同时连续灌胃15 d(约3个动情周期)。
1.6 药物干预后小鼠体质量及脏器湿质量变化各组小鼠药物干预结束后用电子秤称体质量;小鼠处死并取材后,使用电子分析天平对小鼠的肝、肾、脾的湿质量进行称量。
1.7 组织形态学观察卵巢:连续灌胃15 d后每组随机选择6只动情前期小鼠,取其卵巢组织,肉眼观察其外形、色泽、质地及有无先天畸形。每只小鼠随机选一侧卵巢组织行H-E染色,荧光倒置相差显微镜下观察各组小鼠卵泡发育各阶段情况和卵巢组织病理学的变化。
内异灶:在处死上述小鼠取卵巢后,迅速观察EM模型小鼠腹腔内异灶的种植情况,记录病灶的位置、性状、数量、大小。剪下病灶,制备石蜡标本及病理切片,H-E染色后于荧光倒置相差显微镜下观察,以验证模型是否制备成功。雌雄比例1:4行交配实验后,对不同妊娠结局的模型小鼠予以处死,采取同样方法对病灶组织进行观察,进一步确定模型制备是否成功。
脏器:处死小鼠验证妊娠情况后,切除4组小鼠脏器组织(肝、肾、脾),肉眼观察其位置、色泽、质地及有无先天畸形,用电子分析天平称其湿质量,有典型异常者拍照记录。对脏器组织进行石蜡标本及病理切片的制备、H-E染色后于荧光倒置相差显微镜下观察比较各组组织病理学改变。
1.8 小鼠交配实验药物灌胃结束后即开始进行交配实验:在灌胃第15天的17:00,将剩余4组小鼠按雌雄比4︰1连续合笼15 d,观察并统计小鼠体质量变化。若小鼠体质量增加≥3 g为疑似妊娠小鼠,继续观察3 d后颈椎脱臼处死,解剖验证妊娠情况;体质量增加<2 g或减轻的小鼠则为疑似不孕小鼠,再观察10 d后脱颈处死,解剖验证妊娠情况。
1.9 小鼠妊娠结局观察并记录各组妊娠小鼠胚胎种植数、活胎数,根据不同妊娠天数的孕鼠胚胎存活的判断标准[10],计算各组小鼠的妊娠率和胚胎存活率。妊娠率(%)=妊娠小鼠只数/小鼠总只数×100%,胚胎存活率(%)=存活的胚胎数/胚胎种植位点数×100%。
1.10 EM模型小鼠内异灶及盆腔粘连情况评估小鼠处死后,观察比较3组EM模型小鼠内异灶数目、体积及盆腔粘连情况。内异灶体积(V)用公式计算:V=(4/3)πd2l(l为长,r为宽)[1]。小鼠盆腔粘连程度评定方法参照加拿大粘连评分组和北京协和医院的盆腔粘连评分系统:(1)粘连范围。粘连面积<25%为1分,粘连面积26%~50%为2分,粘连面积>50%为3分。(2)粘连程度。疏松粘连和(或)无血管性粘连为1分,致密粘连和(或)血管性粘连为2分,无组织界面的粘连为3分。(3)卵巢粘连。无卵巢粘连为0分,单侧卵巢粘连为1分,双侧卵巢粘连为2分[11]。
1.11 小鼠腹腔液炎性因子的检测各组小鼠处死后迅速剖腹,收集生理盐水腹腔冲洗液静置2 h,300×g离心5 min[1],置入-80 ℃冰箱中保存。采用ELISA检测小鼠腹腔液中细胞因子IL-2、IL-6、IL-10的浓度。
1.12 统计学处理应用SPSS 22.0软件进行统计学分析。计数资料采用χ2检验,多个样本率的比较采用R×C列联表的χ2检验。计量资料用x±s表示,多个样本均数间的比较采用方差分析,符合方差齐性资料的多重比较采用SNK-q检验。检验水准(α)为0.05。
2 结果 2.1 小鼠EM模型建立情况随机选择18只EM模型小鼠,大体解剖均可见腹腔异位灶种植,病灶呈透明、半透明,白色、淡红色或红褐色,囊状或水泡状,病灶周围可见粘连形成和血管生成。病理切片镜下可见子宫内膜腺体和间质成分,伴有炎症反应及纤维化,符合EM病理诊断标准[12]。本次实验共造模77只,成功75只,成功率达97.4%。
2.2 各组小鼠体质量变化药物干预15 d后,因灌胃至气道致死小鼠3只(内异方组2只、孕三烯酮组1只),每组已随机处死6只动情前期小鼠行卵巢组织形态学分析,剩余小鼠内异方组18只,体质量为(21.48±1.31)g;孕三烯酮组18只,体质量为(20.58±1.03)g;EM模型组20只,体质量为(21.39±0.83)g;假手术组18只,体质量为(21.47±1.04)g。孕三烯酮组小鼠体质量低于假手术组,差异有统计学意义(P<0.05)。
2.3 小鼠卵巢组织形态学观察肉眼观察可见小鼠卵巢形态、色泽、大小均无异常。卵巢组织病理切片的观察结果(表 1)显示,在始基卵泡、窦前卵泡、窦状卵泡构成比方面,内异方组、假手术组高于EM模型组,但差异均无统计学意义(P均>0.05);在闭锁卵泡构成比方面,内异方组、假手术组低于EM模型组,差异均有统计学意义(P均<0.05)。各组卵泡构成比两两比较结果显示,内异方组、假手术组与孕三烯酮组比较差异有统计学意义(P<0.05,P<0.01)。卵巢组织切片显示颗粒细胞间有炎症细胞浸润病变的小鼠:内异方组2例,构成比为33.33%(2/6);孕三烯酮组4例,构成比为66.67%(4/6);EM模型组5例,构成比为83.33%(5/6);假手术组1例,构成比为16.67%(1/6),因各组小鼠例数较少,未行统计学分析。
|
|
表 1 各组小鼠各级卵泡构成情况 Tab 1 Composition of follicles at all levels of mice in 4 groups |
2.4 小鼠生殖能力
在妊娠率方面,4组小鼠妊娠率总体比较差异有统计学意义:内异方组妊娠率与孕三烯酮组、EM模型组比较,差异均有统计学意义(P均<0.05),与假手术组比较差异无统计学意义(P>0.05);孕三烯酮组妊娠率与假手术组比较差异有统计学意义(P<0.05),与EM模型组比较差异无统计学意义(P>0.05);假手术组妊娠率高于EM模型组,但差异无统计学意义(P>0.05)。在胚胎存活率和胚胎种植数方面,组间比较差异均无统计学意义(P均>0.05)。见表 2。
|
|
表 2 各组小鼠生殖能力比较 Tab 2 Comparison of reproductive ability of mice in 4 groups |
2.5 小鼠脏器组织形态学观察 2.5.1 大体形态
除孕三烯酮组有1只小鼠右肾稍缩小,其余小鼠肝、脾、肾形态肉眼观察色泽、质地、分叶、大小均未见明显异常。
2.5.2 脏器湿质量孕三烯酮组小鼠肝脏湿质量低于EM模型组(P<0.05),双肾湿质量低于内异方组(P<0.01)、EM模型组(P<0.05)、假手术组(P<0.01)。内异方组小鼠肝脏湿质量、双肾湿质量与假手术组比较差异均无统计学意义(P均>0.05)。4组小鼠脾脏湿质量差异无统计学意义(P>0.05)。见表 3。
|
|
表 3 4组小鼠肝、脾、肾湿质量比较 Tab 3 Wet mass of liver, spleen and kidney of mice in 4 groups |
2.5.3 病理形态
H-E染色结果显示,内异方组、EM模型组和假手术组小鼠的肝脏组织结构大致正常,肝小叶结构完好,肝细胞排列整齐,呈放射状排列,大小均匀,细胞核染色正常,无核裂解,胞浆比正常,无脂肪样变性,肝血窦清晰。孕三烯酮组出现1例轻度肝淤血标本,个别肝细胞出现细胞质透明度增加、细胞质染色不清、细胞核崩解的现象。4组小鼠肾脏、脾脏组织形态均无异常。
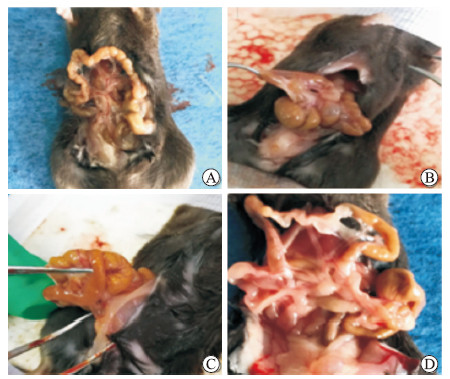
2.6 EM模型小鼠内异灶及盆腔粘连情况内异方组小鼠的内异灶病灶数目、体积、盆腔粘连评分均低于EM模型组,差异均有统计学意义(P均<0.01),孕三烯酮组与EM模型组比较差异无统计学意义(P>0.05),见表 4。各组小鼠的盆腔情况图 1。
|
|
表 4 EM模型小鼠内异灶的变化及盆腔粘连评分比较 Tab 4 Development of endometriotic lesions and pelvic adhesion scores of EM mice after intragastric administration |
|
图 1 各组小鼠的盆腔情况 Fig 1 Pelvic cavity conditions of mice in 4 groups A: Neiyi recipe group; B: Gestrinone group; C: EM model group; D: Sham operation group. EM: Endometriosis |
2.7 小鼠腹腔液中炎性因子检测结果
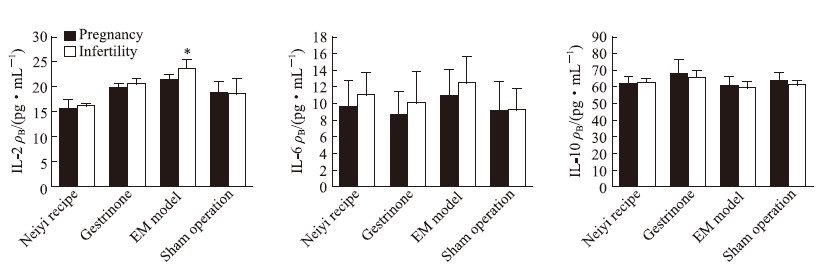
EM模型组小鼠腹腔液中IL-2水平为(22.94±1.80)pg/mL,高于内异方组[(15.81±1.63)pg/mL]、孕三烯酮组[(20.35±0.87)pg/mL]、假手术组[(18.45±4.05)pg/mL],差异均有统计学意义(P均<0.01);内异方组小鼠腹腔液中IL-2水平低于孕三烯酮组(P<0.01)。EM模型组中不孕鼠IL-2水平高于孕鼠(P<0.05),其他3组孕鼠与不孕鼠组内比较差异均无统计学意义(P均>0.05,图 2)。
|
图 2 孕鼠与不孕鼠腹腔液中炎性因子IL-2、IL-6和IL-10水平的ELISA检测结果 Fig 2 Levels of inflammatory factors IL-2, IL-6 and IL-10 in peritoneal fluid of pregnancy and infertility mice as detected by ELISA IL: Interleukin; ELISA: Enzyme-linked immunosorbent assay. n=15 in Neiyi recipe group (pregnancy), n=3 in Neiyi recipe group (infertility); n=7 in gestrinone group (pregnancy), n=11 in gestrinone group (infertility); n=10 in EM model group (pregnancy), n=10 in EM model group (infertility); n=14 in sham operation group (pregnancy), n=4 in sham operation group (infertility). *P < 0.05 vs pregnancy mice in the same group. x±s |
EM模型组小鼠腹腔液中IL-6水平为(11.70±3.27)pg/mL,高于内异方组[(9.94±3.05)pg/mL,P=0.050 4]、孕三烯酮组[(9.42±3.47)pg/mL,P<0.05]、假手术组[(8.89±3.08)pg/mL,P<0.01]。内异方组小鼠腹腔液中IL-6水平和孕三烯酮组比较差异无统计学意义(P>0.05)。4组小鼠孕鼠与不孕鼠组内比较差异均无统计学意义(P均>0.05,图 2)。
EM模型组小鼠腹腔液中IL-10水平为(59.60±4.47)pg/mL,低于假手术组[(63.95±3.98)pg/mL,P<0.05];内异方组小鼠腹腔液中IL-10水平[(61.95±3.20)pg/mL]高于EM模型组,但差异无统计学意义(P>0.05);孕三烯酮组小鼠腹腔液中IL-10水平[(66.93±6.22)pg/mL]高于内异方组、EM模型组和假手术组,差异均有统计学意义(P均<0.01)。4组小鼠孕鼠与不孕鼠组内比较差异均无统计学意义(P均>0.05,图 2)。
3 讨论EM是雌激素依赖性疾病,临床上药物治疗主要以性激素抑制治疗为主,通过造成体内低雌激素环境阻止异位子宫内膜的生长,使异位子宫内膜萎缩、退化、坏死。代表药物有口服避孕药、高效孕激素、雄激素衍生物及促性腺激素释放激素激动剂(gonadotropin releasing hormone agonist,GnRHa)等[3]。这些药物的疗效基本相同,但不良反应有所不同,因此临床选药要考虑患者的意愿、药物不良反应及经济能力[12]。本研究选择孕三烯酮作为阳性对照,主要考虑其是临床常用药物之一,属于雄激素衍生物,有抗孕激素、中度抗雌激素和抗性腺的功效,能通过降低体内雌激素水平使异位子宫内膜萎缩,达到治疗效果;其半衰期长达28 h,临床治疗EM的症状缓解率高达95%以上[3];口服用量小,实验易操作。
中医认为血瘀是贯穿EM发生、发展过程的中心环节,也是EM最基本的病理基础。肾藏精,主生殖。卵泡发育依赖于肾中精气的充盛,若肾阴不足、精血乏源,可致卵泡生长缺乏物质基础,不能发育成熟;阴损及阳,肾阳虚弱,排卵缺乏内在动力[13]。故现代医家认为,EM不孕症的基本病机是血瘀和肾虚,补肾活血是EM不孕症常用的治疗方法。已有研究表明内异方具有调节生殖内分泌、抑制异位子宫内膜侵袭等作用[14-19]。但内异方是否能通过抑制内异灶生长减少盆腔粘连、调节盆腔微环境、改善卵泡发育,从而提高EM小鼠的生殖能力有待研究。
本实验延续前期的模型研究[8],采用目前国内外较新的“同种异体移植法”[20-21],以腹腔注射方式建立EM模型。较传统大鼠自体移植法相比,此方法创伤小、不损伤模型一侧子宫,可以避免开腹手术造成的粘连、感染等干扰因素,较适合后续生殖能力的研究。本实验随机选择的18只小鼠异位子宫内膜均成功种植,证明该法是较为可靠的造模方法。
为了探讨内异方对EM小鼠生殖能力的影响,本研究观察了各组小鼠妊娠率、胚胎种植数、胚胎存活率,结果发现内异方能提高EM模型小鼠的妊娠率,而孕三烯酮在提高EM模型小鼠的妊娠率方面效果不佳。考虑到孕三烯酮药物对性腺的抑制作用,为了达到合笼效果的一致,采用同步停药、同步合笼的交配方式。该组小鼠停药后立即合笼,没有药物清除时间,虽然合笼时间较长,达3个动情周期,仍有部分小鼠可能没有恢复正常的性周期,导致该组妊娠率的低下。
为进一步探究内异方对小鼠卵巢功能和盆腔微环境的影响,本实验观察了各组小鼠卵巢组织病理切片、模型内异灶、盆腔粘连情况等,并检测了腹腔液中炎性因子的浓度。结果显示,与孕三烯酮组相比,内异方组小鼠始基卵泡、窦前卵泡和窦状卵泡的构成比增加,闭锁卵泡构成比降低;内异方组小鼠内异灶体积缩小、数量减少、盆腔粘连评分降低;内异方组和孕三烯酮组小鼠腹腔液中IL-2、IL-6、IL-10水平得到改善。本研究结果表明,内异方和孕三烯酮均可改善EM模型小鼠的盆腔微环境;此外内异方还可以改善卵泡发育,提高卵巢功能,有效抑制内异灶生长,缓解盆腔粘连,恢复盆腔正常的生理结构。
实验中通过对小鼠肝、肾、脾组织形态学观察,证实孕三烯酮药物有影响脂蛋白代谢、肝功能损害、影响体质量的不良反应[3, 12]。与孕三烯酮比较,内异方毒性极小,在成人等效剂量的作用下不会引起小鼠脏器组织形态学改变,不会导致小鼠体质量的明显变化。
综上所述,内异方通过抑制内异灶生长、减少盆腔粘连、调节盆腔微环境、改善卵泡发育提高了EM小鼠的生殖能力。内异方对改善EM小鼠的生殖能力的具体机制如何,究竟是通过何种干预作用逆转了卵巢功能,还有待进一步研究。
| [1] |
BILOTAS M A, OLIVARES C N, RICCI A G, BASTON J I, BENGOCHEA T S, MERESMAN G F, et al. Interplay between endometriosis and pregnancy in a mouse model[J/OL]. PLoS One, 2015, 10: e0124900. doi: 10.1371/journal.pone.0124900.
|
| [2] |
BURNEY R O, GIUDICE L C. Pathogenesis and pathophysiology of endometriosis[J]. Fertil Steril, 2012, 98: 511-519. DOI:10.1016/j.fertnstert.2012.06.029 |
| [3] |
沈铿, 马丁. 妇产科学[M]. 3版. 北京: 人民卫生出版社, 2016: 355-363.
|
| [4] |
唐妍, 陈士岭, 何于夏, 郭薇, 陈薪, 叶德盛, 等.应用腹腔镜手术治疗卵巢子宫内膜异位囊肿对卵巢储备功能和卵巢反应性的影响[C]//中华医学会第十次全国妇产科学术会议妇科内分泌会场(妇科内分泌学组、绝经学组、计划生育学组)论文汇编.厦门: 中华医学会妇产科分会, 2012: 140.
|
| [5] |
马文敏, 司徒艳球, 吴雅琴, 谭晓慧. 不同盆腔条件体外受精-胚胎移植结局的分析[J]. 广东医学, 2016, 37(z2): 91-92. |
| [6] |
周莉, 葛军, 梁莹, 吴炜, 胡雄, 吴晓茜, 等. 中药疏肝化瘀方对子宫内膜异位症患者卵巢颗粒细胞GDF-9的影响[J]. 生殖与避孕, 2013, 33: 524-528. DOI:10.7669/j.issn.0253-357X.2013.08.0524 |
| [7] |
沈慰, 俞超芹. 从肾论治卵巢早衰[J]. 中西医结合学报, 2006, 4: 653-656. |
| [8] |
王汝倩, 张洁, 刘璐茜, 翟东霞, 张丹英, 姚睿嫔, 等. 用模拟经期内膜组织建立子宫内膜异位症小鼠模型及其生殖能力的研究[J]. 生殖医学杂志, 2017, 26: 592-598. DOI:10.3969/j.issn.1004-3845.2017.06.016 |
| [9] |
秦川, 魏泓. 实验动物学[M]. 2版. 北京: 人民卫生出版社, 2014: 289-299.
|
| [10] |
刘光芒, 吴德, 张明, 周东胜, 王延忠, 郑爱荣. 铁与维生素A水平对小鼠子宫分泌蛋白及胚胎存活率影响[J]. 动物营养学报, 2007, 19: 392-400. DOI:10.3969/j.issn.1006-267X.2007.04.013 |
| [11] |
王培莉. 内异症患者疼痛与盆腔粘连的相关性分析[J]. 安徽医学, 2011, 32: 1140-1141. DOI:10.3969/j.issn.1000-0399.2011.08.042 |
| [12] |
中华医学会妇产科学分会子宫内膜异位症协作组. 子宫内膜异位症的诊治指南[J]. 中华妇产科杂志, 2015, 50: 161-169. DOI:10.3760/cma.j.issn.0529-567x.2015.03.001 |
| [13] |
赵志梅. 子宫内膜异位症合并不孕之肾虚血瘀病机分析[J]. 天津中医, 2002, 19: 35-36. |
| [14] |
YU C Q, CAI Z L, LIU Y H, WANG D Z, WANG Z Q. Study on therapeutic mechanism of Neiyifang in treating endometriosis[J]. Chin J Integr Tradit Western Med, 2003, 9: 88-92. |
| [15] |
俞超芹, 俞瑾, 宋艳华. 俞氏内异方组治疗子宫内膜异位症临床研究[J]. 生殖医学杂志, 2005, 14: 143-147. DOI:10.3969/j.issn.1004-3845.2005.03.004 |
| [16] |
俞超芹, 石书芳, 刘玉环, 王瑞霞, 宋艳华, 俞瑾. 人子宫内膜异位症在位和异位内膜细胞原代培养及形态学观察[J]. 中西医结合学报, 2006, 4: 189-193. |
| [17] |
孙帅, 沈慰, 翟东霞, 张丹英, 王针织, 白玲玲, 等. 化瘀解毒组方治疗子宫内膜异位症58例疗效观察[J]. 中医杂志, 2014, 55: 1668-1671. |
| [18] |
俞超芹, 刘玉环, 彭新萍, 李瑾, 潘瑞萍, 凌昌全. 子宫内膜异位症白细胞介素-8与白细胞介素-10水平及内异方对其调节作用[J]. 中国中西医结合杂志, 2000, 20: 603-605. DOI:10.3321/j.issn:1003-5370.2000.08.015 |
| [19] |
徐玲, 周巧玲, 韩洁, 张丹英, 董惠娟, 蔡在龙, 等. 内异方药物血清对子宫内膜异位症血管生成的影响[J]. 中西医结合学报, 2012, 10: 800-806. |
| [20] |
陈琼华, 邱娜璇, 颜晓红, 丁峰, 洪虬英, 高海杰, 等. BALB/c小鼠子宫内膜异位症模型的建立及其形态学的动态观察[J]. 中国微创外科杂志, 2010, 10: 238-242. DOI:10.3969/j.issn.1009-6604.2010.03.017 |
| [21] |
GREAVES E, COUSINS F L, MURRAY A, ESNALZUFIAURRE A, FASSBENDER A, HORNE A W, et al. A novel mouse model of endometriosis mimics human phenotype and reveals insights into the inflammatory contribution of shed endometrium[J]. Am J Pathol, 2014, 184: 1930-1939. DOI:10.1016/j.ajpath.2014.03.011 |
 2019, Vol. 40
2019, Vol. 40


