2. 上海大学机电工程与自动化学院, 上海 200444;
3. 上海交通大学医学院附属上海儿童医学中心皮肤科, 上海 200127
2. School of Mechatronic Engineering and Automation, Shanghai University, Shanghai 200444, China;
3. Department of Dermatology, Shanghai Children's Medical Center, Shanghai Jiao Tong University School of Medicine, Shanghai 200127, China
皮肤病种类繁多,相当一部分可以由医师结合自身的临床经验,通过医学图像采集建立初步诊断或提出鉴别诊断,必要时借助一些实验室辅助检查提供诊断依据。对于皮肤肿瘤的诊断,通常依据临床表现结合病理做出最终正确的诊断。随着人工智能(artificial intelligence,AI)技术的发展,利用机器视觉对图像进行自动识别与分析成为近年国内外学者关注的热点,并在医学领域对组织细胞图像自动分析的研究中取得重要进展[1-2]。计算机辅助诊断系统通过对大量临床、皮肤镜、组织病理图片资源的深度学习,建立人工神经网络,辅助专业医师对疑难病症做出分析判断,有助于提高皮肤肿瘤的早期诊断水平、增强基层医师的诊治能力、减轻病理专科医师的工作负担。本文以皮肤基底细胞癌(basal cell carcinoma,BCC)为例,对AI领域BCC的诊治研究进展作一综述。
1 AI对BCC临床图像的识别训练AI识别临床皮损的过程犹如培养一个皮肤科住院医师的过程,需要对大量皮肤病的典型和不典型损害进行特征提取与识别。目前已有团队在该领域做了大量工作。Esteva等[3]采用深度卷积神经网络对皮肤肿瘤进行识别诊断,利用包含129 450幅临床图像的数据集(包括2 032种皮肤病)进行算法训练,并用病理活组织检查证实的临床图像测试了其对表皮恶性病变与脂溢性角化病、色素痣与恶性黑素瘤的鉴别分类能力,结果显示计算机的诊断准确率达到了皮肤科医师的水平。AI对于BCC的识别诊断,Moss等[4]早在1989年就进行了相关报道,他们在AI/DERM皮肤肿瘤诊断系统中利用傅里叶变换的频率分析、Sun-Wee纹理分析算法等图像分析技术,对BCC的毛细血管扩张、溃疡、结痂和肿瘤边界等几个临床特征进行了自动检测识别,取得一定的研究成果。
临床上BCC通常分为结节型、浅表型、色素型、巨大型、Pinkus纤维上皮瘤等,还可表现为线状、息肉状等少见临床表型[5],通过训练机器识别BCC多样的临床表现形式并准确诊断有一定难度。皮肤镜的普及应用使得更小的BCC能够被发现,也为AI提供了“放大”的镜下特征。肿瘤表面扩张的毛细血管是皮肤镜下BCC的关键表现之一,但要注意与晒伤等其他皮损中毛细血管扩张相鉴别。Cheng等[6]应用优化的局部彩色分辨技术,将血管的形状、大小进行标准化处理,结果显示其对59例BCC和152例良性皮肤损害的正确诊断率达96.7%。蓝灰色卵圆体(blue-gray ovoid,B-GO)是BCC的另一重要皮肤镜下结构,为BCC的自动检测提供了依据。但由于大小和颜色等变化,B-GO易被误认为是良性病变中的相似结构。Guvenc等[7]采用一种新的分割方法区分B-GO及其他良性模拟结构,用此方法对68例病理证实的BCC和131例良性病变进行皮肤镜下对比研究,通过logistic回归模型分析确定蓝色是BCC中B-GO与良性模拟结构的鉴别点之一,另外BCC的B-GO边界最佳拟合近似椭圆,根据上述两点将恶性结构与相似良性结构区分开的诊断率达96.5%。国内报道根据BCC经典皮肤镜下改变如B-GO、血管模式、色素改变、溃疡等特征,可将临床诊断与病理诊断的符合率提高至95%左右[8]。将BCC临床和皮肤镜特征结合进行神经网络分类分析可进一步提高诊断准确度,有研究采集患者的个人资料(年龄、性别等)、一般检查(病变大小和部位)、常见皮肤镜改变(B-GO、叶状结构等)情况,对350个BCC和350个良性病变数据集分析上述组合特征,并基于进化人工神经网络(evolutionary artificial neural network,EANN)进行训练和病灶识别,测试结果显示结合临床和图像数据信息有更高的皮损鉴别能力[9]。
2 AI对BCC组织病理图像的识别组织病理依旧是诊断BCC的金标准,目前AI与组织病理检查已达到深度融合,运用计算机辅助诊断系统对乳腺癌[10]、肺癌[11-12]、胃癌[13]病理图像进行处理和分析取得了显著进展,实现了集AI、模式识别与医学专家经验于一体,根据肿瘤细胞外形、细胞质、细胞核、染色质等图像特征制定识别分类规则,完成组织图像识别。BCC组织病理的共同特征为与表皮相连的基底样细胞构成的瘤团、周边细胞栅栏状排列、肿瘤与基质间裂隙,黏液炎性基质显示不同比例的黏蛋白、淋巴细胞浸润;肿瘤细胞核大、细长,不同程度的细胞异型、单个细胞凋亡和有丝分裂活性。相比临床表现,BCC具有结节囊肿型、结节型、微小结节型、腺样型、浸润型、硬斑病型、角化型、基底鳞状型、色素型、浅表型、溃疡型、透明细胞型、印戒细胞型、颗粒型、基底膜增厚型和Pinkus纤维上皮瘤等20多种组织病理分型[14](图 1),各型肿瘤组织构型、细胞形态、间质等特征存在一定差异。比如,Pinkus纤维上皮瘤黏液样基质中吻合的上皮条索和基底样芽蕾构成界限清楚的结节,与其他各型BCC的组织构型区别较大,但是免疫表型标记与其他BCC重叠[15]。AI需要在图像识别系统中对各型组织病理的个性和共性特征进行分析。
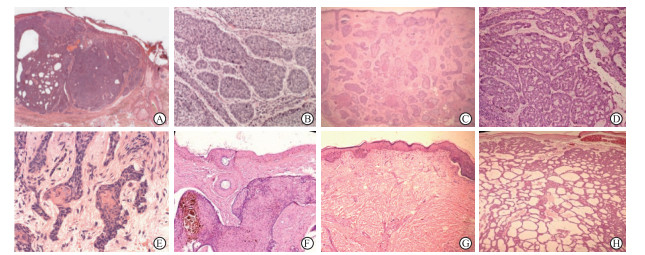
|
图 1 BCC的组织病理分型 Fig 1 Histopathologic types of basal cell carcinoma (BCC) The pictures come from Department of Dermatology, Changhai Hospital, Naval Medical Univesity (Second Military Medical Univesity). A: Nodular and cystic type; B: Nodular type; C: Micro-nodular type; D: Adenoid type; E: Infiltrative type; F: Pigmented type; G: Superficial type; H: Pinkus fibroepithelioma. H-E staining. Original magnification: ×200 |
近年AI领域对BCC组织病理识别的研究广泛开展。BCC多样的组织病理表现即使对经验丰富的皮肤病理医师也形成了挑战,实现对病理切片的快速、准确、客观地判断,要求有相应的阅片信息量。AI同样需要采集多样病理图像进行处理、分析。Cruz-Roa等[16]利用深度学习体系构架,对从308个皮肤组织病理切片感兴趣区(region of interest,ROI)采集的1 417幅图像进行BCC识别,针对特征包(bag of feature,BOF)、标准离散余弦变换(discrete cosine transform,DCT)等进行分析,结果表明组织学图像数据集显示出良好的总体性能。AI可以通过对比BCC和正常皮肤组织的显微图像,确定BCC的识别特征,从而进行数字化病理诊断。首先对比不同色彩模式,确定选用HSV(hue,saturation,value)图像模式进行BCC癌变组织的色彩识别;然后根据图片色彩特点,通过概率分布情况进行阈值区间确定,并基于该阈值进行HSV图像的阈值分割,去除非肿瘤区域,保留肿瘤疑似区域,进一步对阈值分割后的细胞图像进行分析,选取适当的处理方法(包括中值滤波、膨胀、腐蚀、开操作与闭操作运算,以及二次滤波)将非肿瘤区域去除;最后显示去除非肿瘤区域后获得的清晰肿瘤组织轮廓和位置,通过数字化病理诊断系统人机交互界面可以更直观地操作并看到组织图像的处理结果[17]。
AI不仅要识别BCC的各型组织病理特征,还要对BCC相似的组织病理模式进行识别,完成鉴别诊断过程。多种毛胚源性的基底样细胞反应、毛源性肿瘤或其他基底样细胞特征的皮肤癌模式与BCC十分相似,甚至在组织起源上存在重叠,相关鉴别诊断由机器自动化系统识别十分困难,包括皮肤纤维瘤的毛囊诱导(follicular induction,FI)现象、毛母细胞瘤(trichoblastoma,TB)、毛发上皮瘤(trichoepithelioma,TE)、小汗腺螺旋腺瘤和其他恶性肿瘤等[18],典型的BCC组织病理改变见图 2。如果活组织检查标本表浅,皮肤纤维瘤不能够全面显现,AI将很容易把FI识别为BCC。因为二者外周均可显示栅栏状细胞,有芽蕾状生长模式,均可见收缩裂隙。与BCC相比,FI有毛囊分化证据,但细胞没有核浓染、异型、有丝分裂数目增加或凋亡小体等表现[19]。良性毛胚肿瘤包括TB和TE,常见于头颈部,二者与BCC鉴别对病理医师有一定难度,同样也是AI识别的难点。组织学上TB与表皮不相连,由小基底样细胞组成大小不一的结节。TE是在真皮和基底样肿瘤小叶中有角囊肿,注意与角化型、漏斗部囊肿型BCC相鉴别,但TE肿瘤小叶周围的结缔组织鞘明显。TE和TB均显示周边栅栏状细胞,乳头间质体对于良性毛胚肿瘤具有特异性,有人认为TE代表TB的一个亚型。与BCC不同,TE/TB缺乏明显的收缩间隙、黏液炎性基质、显著有丝分裂、细胞学非典型性或肿瘤坏死[20]。结缔组织增生性毛发上皮瘤(desmoplastic trichoepithelioma,DTE)好发于面部,表现为较硬的中央凹陷斑块或结节,组织学为致密硬化基质中有小的基底样细胞构成的细条索,注意与硬斑病样基底细胞癌(morphea-like basal cell carcinoma,MCC)区分,这对机器识别来说是一种挑战。DTE结构对称有角囊肿、钙化,伴巨细胞反应和附属器分化,缺乏有丝分裂象、细胞异型性和收缩间隙[20-21]。另外基底细胞样毛囊错构瘤(basaloid follicular hamartoma,BFH)、毛囊漏斗部肿瘤(tumor of the follicular infundibulum,TFI)也容易错误识别,后者应注意与浅表BCC相鉴别[22]。小汗腺螺旋腺瘤位于真皮深层,瘤内可见小汗腺导管结构,低倍镜下似BCC。圆柱瘤的瘤团呈岛屿状排列紧密,周围厚膜将瘤体分隔成特征性拼板状。鳞状细胞癌、微囊肿附属器癌、皮脂腺癌、Merkel细胞癌均需与BCC相鉴别,不同种类肿瘤的预后有明显差别[23]。
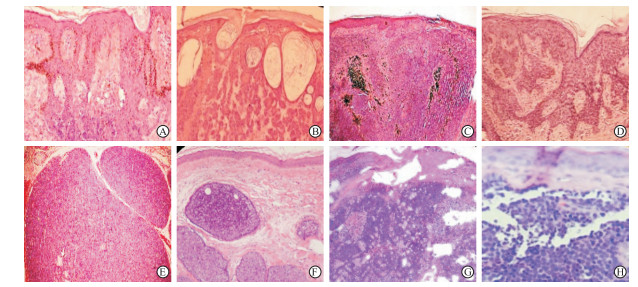
|
图 2 BCC组织病理鉴别诊断 Fig 2 Histopathologic differential diagnosis of basal cell carcinoma (BCC) The pictures come from Department of Dermatology, Changhai Hospital, Naval Medical Univesity (Second Military Medical Univesity). A: Follicular induction; B: Trichoepithelioma; C: Trichoblastoma; D: Tumor of the follicular infundibulum; E: Eccrine spiradenoma; F: Cylindroma; G: Sebaceous carcinoma; H: Merkel cell carcinoma. H-E staining. Original magnification: ×200 |
在鉴别诊断过程中,免疫组织化学染色图像具有重要的辅助诊断价值。当根据皮肤镜特征、普通H-E切片组织学特征对特殊表现BCC鉴别诊断仍有一定困难时,常借助免疫组织化学标记染色进一步区分。AI能够完成相关免疫组织化学染色图像的识别,深度学习也适用于机器在任意选定区域对免疫组织化学标记自动定位和量化。通过完全卷积网络输入组织RGB彩色图像、输出显示每个生物标记的热图,研究者还可以根据p16、Ki-67等核标记图像进一步训练核染色网络(nuclei-Net)[24]。BCC的细胞角蛋白(cytokeratin,CK)表达标记与毛囊生发细胞相似,以CK5/6和CK14阳性表达、CK20缺失为特征,上皮细胞黏附分子(epithelial cell adhesion molecule,Ep-CAM;克隆号Ber-EP4)呈强表达,p63呈弥漫核表达,上皮膜抗原(epithelial membrane antigen,EMA)和癌胚抗原(carcinoembryonic antigen,CEA)通常不表达[25]。毛胚肿瘤和BCC存在谱系关系,前者常定植CK20阳性的Merkel细胞,染色缺失时支持BCC诊断,反之支持良性诊断;CK20可与雄激素受体(androgen receptor,AR)联合使用,肿瘤AR染色阳性。β细胞淋巴瘤/白血病2(β-cell lymphoma/leukemia 2,BCL-2)在BCC弥漫染色和TE/TB外周染色。CD10在BCC的肿瘤组织中表达,TE/TB更倾向基质表达[20]。Ber-EP4在BCC中强表达,常用作与鳞状细胞癌、皮脂腺癌等相鉴别[25]。Merkel细胞癌细胞具有上皮和神经内分泌细胞的抗原,表达上皮标志物如低分子质量角蛋白和EMA,以及神经内分泌标志物嗜铬粒蛋白和突触素;Ber-EP4在BCC和Merkel细胞癌中均有表达,大多数Merkel细胞癌表达CK20,而BCC染色阴性;Merkel细胞多瘤病毒大T抗原蛋白在70%~80% Merkel细胞癌中表达,是鉴别Merkel细胞癌和BCC的高度特异性标志物[26]。
3 临床和组织病理密切结合,提高AI对BCC的正确诊断率在BCC的诊断和鉴别诊断过程中,必要时为AI提供临床信息训练,可以减少恶性侵袭性肿瘤的漏诊、误诊,也可避免将良性肿瘤或低度恶性肿瘤误诊为侵袭性肿瘤而导致过度治疗。存在典型组织病理改变的BCC容易识别,实际工作中AI对BCC和TB/TE难以鉴别,结合其他手段鉴别困难时,对于老年患者需结合临床形态按BCC处理。当有些附属器肿瘤如漏斗部肿瘤、毛囊错构瘤依据病理特征难以诊断时,临床信息常可以提供重要依据。其他诊断陷阱如腺样BCC可能与腺样囊性癌混淆;透明细胞BCC需与毛鞘癌、透明细胞黑素瘤和其他透明细胞肿瘤相鉴别。Merkel细胞癌的转移率和死亡率高,应避免AI将其误诊为侵袭性较弱的BCC,从而失去及时治疗的时机。
AI诊断多发的BCC更应结合临床信息,因为BCC可作为一些综合征的皮肤表现,如痣样BCC综合征(Gorlin综合征)、Bazex-Dupré-Christol综合征和Rombo综合征。Gorlin综合征为常染色体显性遗传疾病,影响皮肤、骨、中枢神经系统、内分泌系统和泌尿生殖系统等[27]。Bazex-Dupré-Christol综合征表现为毛囊性皮肤萎缩、毛发稀少、粟丘疹和早发的BCC[28]。其他需要鉴别诊断的重要疾病如TE可有家族性,如果患者或其他亲属合并圆柱瘤或螺旋腺瘤时可能为Brooke-Spiegler综合征的表现[29]。因此,临床信息对准确诊断BCC非常重要。
4 AI在指导治疗和评估预后方面的应用黑素瘤早期切除效果良好,延迟手术直接导致预后不良。Yu等[30]对亚洲人最常见的肢端黑素瘤皮肤镜图像进行检测,将卷积神经网络应用于手足肢端黑素瘤和良性痣的皮肤镜检查图像评价,结果显示卷积神经网络的准确度(图像的真阳性率和真阴性率)分别达83.51%和80.23%,高于非专家的评估(分别为67.84%和62.71%),接近专家的评估(分别为81.08%和81.64%)。说明AI在准确诊断方面具有优势,有助于治疗方法的合理选择及手术的及时开展。
虽然BCC以引起局部组织破坏为主,转移率低,总体预后好,但发生在颜面等曝光部位的肿瘤采用常规手术难以完全切除,复发率高。若有条件可采用莫氏显微描记手术(Mohs micrographic surgery,MMS)切除肿瘤,在术中对切除部分进行组织学评估以确定切缘[31]。Larraona-Puy等[32]用拉曼显微分光镜对BCC进行自动化检测和成像,选取BCC与皮肤正常区域光谱差异最大的拉曼波段,采用线性判别分析(linear discriminant analysis,LDA)建立多变量分类模型,对20例患者进行拉曼光谱测量并分割交叉验证,结果显示对BCC的灵敏度、特异度分别为(90±9)%、(85±9)%,与组织病理切片金标准有很好的相关性。该技术和标准的MMS方法相似,在术中不断对切除组织、切除效果进行评判,从而提高肿瘤组织的完全切除率和降低复发。
目前通过AI可以识别BCC组织病理图像,区分微结节、浸润性、硬斑病样和浅表型等侵袭性生长模式,为手术扩大切除提供合理组织学依据。进一步通过收集BCC的位置、大小、是否复发等临床信息,结合组织病理特点将其分为低风险性和高风险性BCC,能够正确评估其复发率和潜在转移率。
5 小结随着机器视觉、医学图像、数字病理等技术水平的提高,AI对图像的自动识别和分类有望代替传统人工分类并促进肿瘤病理学的发展[33]。以BCC为例,AI可以在多个层次辅助诊断,如帮助患者、基层全科医师进行临床图像识别;帮助皮肤科医师结合皮肤镜等无创检查手段进行图像分析;加快皮肤病理医师进行组织图像的识别诊断等。然而正确的诊断应建立在多层次图像组合和临床信息结合的基础上,目前国内外已经研究出多种细胞图像处理算法,我国拥有充足的临床和病理资源,相信通过不断深度学习,不仅能够逐步实现AI对BCC的准确、快速识别,对其治疗和预后评估也具有重要应用价值。
| [1] |
YU K H, ZHANG C, BERRY G J, ALTMAN R B, RE C, RUBIN D L, et al. Predicting non-small cell lung cancer prognosis by fully automated microscopic pathology image features[J/OL]. Nat Commun, 2016, 7: 12474. doi: 10.1038/ncomms12474.
|
| [2] |
HAN S S, KIM M S, LIM W, PARK G H, PARK I, CHANG S E. Classification of the clinical images for benign and malignant cutaneous tumors using a deep learning algorithm[J]. J Invest Dermatol, 2018, 138: 1529-1538. DOI:10.1016/j.jid.2018.01.028 |
| [3] |
ESTEVA A, KUPREL B, NOVOA R A, KO J, SWETTER S M, BLAU H M, et al. Dermatologist-level classification of skin cancer with deep neural networks[J]. Nature, 2017, 542: 115-118. DOI:10.1038/nature21056 |
| [4] |
MOSS R H, STOECKER W V, LIN S J, MURUGANANDHAN S, CHU K F, PONELEIT K M, et al. Skin cancer recognition by computer vision[J]. Comput Med Imaging Graph, 1989, 13: 31-36. DOI:10.1016/0895-6111(89)90076-1 |
| [5] |
GOLDENBERG G, KARAGIANNIS T, PALMER J B, LOTYA J, O'NEILL C, KISA R, et al. Incidence and prevalence of basal cell carcinoma (BCC) and locally advanced BCC (LABCC) in a large commercially insured population in the United States: a retrospective cohort study[J/OL]. J Am Acad Dermatol, 2016, 75: 957-966.e2. doi: 10.1016/j.jaad.2016.06.020.
|
| [6] |
CHENG B, ERDOS D, STANLEY R J, STOECKER W V, CALCARA D A, GÓMEZ D D. Automatic detection of basal cell carcinoma using telangiectasia analysis in dermoscopy skin lesion images[J]. Skin Res Technol, 2011, 17: 278-287. DOI:10.1111/srt.2011.17.issue-3 |
| [7] |
GUVENC P, LEANDER R W, KEFEL S, STOECKER W V, RADER R K, HINTON K A, et al. Sector expansion and elliptical modeling of blue-gray ovoids for basal cell carcinoma discrimination in dermoscopy images[J/OL]. Skin Res Technol, 2013, 19: e532-e536. doi: 10.1111/srt.12006.
|
| [8] |
李薇薇, 涂平, 杨淑霞, 李航, 汪旸. 皮肤镜对基底细胞癌鉴别诊断价值的初步研究[J]. 中华皮肤科杂志, 2013, 46: 480-484. DOI:10.3760/cma.j.issn.0412-4030.2013.07.009 |
| [9] |
CHENG B, JOE STANLEY R, STOECKER W V, STRICKLIN S M, HINTON K A, NGUYEN T K, et al. Analysis of clinical and dermoscopic features for basal cell carcinoma neural network classification[J/OL]. Skin Res Technol, 2013, 19: e217-e222. doi: 10.1111/j.1600-0846.2012.00630.x.
|
| [10] |
GOLI S, MAHJUB H, FARADMAL J, MASHAYEKHI H, SOLTANIAN A R. Survival prediction and feature selection in patients with breast cancer using support vector regression[J/OL]. Comput Math Methods Med, 2016, 2016: 2157984. doi: 10.1155/2016/2157984.
|
| [11] |
VAN GINNEKEN B. Fifty years of computer analysis in chest imaging:rule-based, machine learning, deep learning[J]. Radiol Phys Technol, 2017, 10: 23-32. DOI:10.1007/s12194-017-0394-5 |
| [12] |
高云姝, 周洁, 潘军, 于观贞, 梁军. 人工智能技术在肺部肿瘤中的研究现状和应用前景[J]. 第二军医大学学报, 2018, 39: 834-839. GAO Y S, ZHOU J, PAN J, YU G Z, LIANG J. Research status and application prospect of artificial intelligence technology in lung tumors[J]. Acad J Sec Mil Med Univ, 2018, 39: 834-839. |
| [13] |
梁桥康, 南洋, 项韶, 梅丽, 孙炜, 于观贞. 深度学习图像分割算法在胃癌病理切片中的可行性分析[J]. 第二军医大学学报, 2018, 39: 903-908. LIANG Q K, NAN Y, XIANG S, MEI L, SUN W, YU G Z. Feasibility of deep learning image-based segmentation algorithm in pathological section of gastric cancer[J]. Acad J Sec Mil Med Univ, 2018, 39: 903-908. |
| [14] |
PRANTEDA G, GRIMALDI M, LOMBARDI M, PRANTEDA G, ARCESE A, CORTESI G, et al. Basal cell carcinoma:differences according to anatomic location and clinical-pathological subtypes[J]. G Ital Dermatol Venereol, 2014, 149: 423-426. |
| [15] |
TARALLO M, CIGNA E, FINO P, LO TORTO F, CORRIAS F, SCUDERI N. Fibroepithelioma of Pinkus:variant of basal cell carcinoma or trichoblastoma? Case report[J]. G Chir, 2011, 32(6/7): 326-328. |
| [16] |
CRUZ-ROA A A, AREVALO OVALLE J E, MADABHUSHI A, GONZÁLEZ OSORIO F A. A deep learning architecture for image representation, visual interpretability and automated basal-cell carcinoma cancer detection[J]. Med Image Comput Comput Assist Interv, 2013, 16(Pt 2): 403-410. |
| [17] |
ZHANG S, HUANG J, LI H, METAXAS D N. Automatic image annotation and retrieval using group sparsity[J]. IEEE Trans Syst Man Cybern B Cybern, 2012, 42: 838-849. |
| [18] |
STANOSZEK L M, WANG G Y, HARMS P W. Histologic mimics of basal cell carcinoma[J]. Arch Pathol Lab Med, 2017, 141: 1490-1502. DOI:10.5858/arpa.2017-0222-RA |
| [19] |
ALSAAD K O, OBAIDAT N A, GHAZARIAN D. Skin adnexal neoplasms-part 1:an approach to tumours of the pilosebaceous unit[J]. J Clin Pathol, 2007, 60: 129-144. |
| [20] |
PINA A, SAUTHIER P, RAHIMI K. Vulvar trichoblastoma: case report and literature review[J/OL]. J Low Genit Tract Dis, 2015, 19: e10-e12. doi: 10.1097/LGT.0000000000000010.
|
| [21] |
WANG Q, GHIMIRE D, WANG J, LUO S, LI Z, WANG H, et al. Desmoplastic trichoepithelioma:a clinicopathological study of three cases and a review of the literature[J]. Oncol Lett, 2015, 10: 2468-2476. DOI:10.3892/ol.2015.3517 |
| [22] |
MILLS O, THOMAS L B. Basaloid follicular hamartoma[J]. Arch Pathol Lab Med, 2010, 134: 1215-1219. |
| [23] |
CARDOSO J C, CALONJE E. Malignant sweat gland tumours:an update[J]. Histopathology, 2015, 67: 589-606. DOI:10.1111/his.2015.67.issue-5 |
| [24] |
SHEIKHZADEH F, WARD R K, VAN NIEKERK D, GUILLAUD M. Automatic labeling of molecular biomarkers of immunohistochemistry images using fully convolutional networks[J/OL]. PLoS One, 2018, 13: e0190783. doi: 10.1371/journal.pone.0190783.
|
| [25] |
OBAIDAT N A, ALSAAD K O, GHAZARIAN D. Skin adnexal neoplasms-part 2:an approach to tumours of cutaneous sweat glands[J]. J Clin Pathol, 2007, 60: 145-159. |
| [26] |
PULITZER M P, AMIN B D, BUSAM K J. Merkel cell carcinoma:review[J]. Adv Anat Pathol, 2009, 16: 135-144. DOI:10.1097/PAP.0b013e3181a12f5a |
| [27] |
FUJⅡ K, MIYASHITA T. Gorlin syndrome (nevoid basal cell carcinoma syndrome):update and literature review[J]. Pediatr Int, 2014, 56: 667-674. DOI:10.1111/ped.2014.56.issue-5 |
| [28] |
ABUZAHRA F, PARREN L J, FRANK J. Multiple familial and pigmented basal cell carcinomas in early childhood-Bazex-Dupré-Christol syndrome[J]. J Eur Acad Dermatol Venereol, 2012, 26: 117-121. DOI:10.1111/jdv.2011.26.issue-1 |
| [29] |
CÜRE K, KOCATÜRK E, KOKU AKSU A E, YÜKSEL T, LEBLEBICI C, ÖZEKINCI S, et al. Brooke-Spiegler syndrome:focus on reflectance confocal microscopy findings of trichoepithelioma and flat cylindroma[J]. Clin Exp Dermatol, 2017, 42: 906-909. DOI:10.1111/ced.2017.42.issue-8 |
| [30] |
YU C, YANG S, KIM W, JUNG J, CHUNG K Y, LEE S W, et al. Acral melanoma detection using a convolutional neural network for dermoscopy images[J/OL]. PLoS One, 2018, 13: e0193321. doi: 10.1371/journal.pone.0193321.
|
| [31] |
KUIJPERS D I, THISSEN M R, NEUMANN M H. Basal cell carcinoma:treatment options and prognosis, a scientific approach to a common malignancy[J]. Am J Clin Dermatol, 2002, 3: 247-259. DOI:10.2165/00128071-200203040-00003 |
| [32] |
LARRAONA-PUY M, GHITA A, ZOLADEK A, PERKINS W, VARMA S, LEACH I H, et al. Development of Raman microspectroscopy for automated detection and imaging of basal cell carcinoma[J/OL]. J Biomed Opt, 2009, 14: 054031. doi: 10.1117/1.3251053.
|
| [33] |
于观贞, 魏培莲, 陈颖, 朱明华. 人工智能在肿瘤病理诊断和评估中的应用与思考[J]. 第二军医大学学报, 2017, 38: 1349-1354. YU G Z, WEI P L, CHEN Y, ZHU M H. Artificial intelligence in pathological diagnosis and assessment of human solid tumor:application and thinking[J]. Acad J Sec Mil Med Univ, 2017, 38: 1349-1354. |
 2019, Vol. 40
2019, Vol. 40


