2. 海军军医大学(第二军医大学)长征医院病理科, 上海 200003
2. Department of Pathology, Changzheng Hospital, Naval Medical University(Second Military Medical University), Shanghai 200003, China
肾细胞癌(renal cell carcinoma,RCC)发病率近年来呈持续性上升趋势,世界卫生组织预测2018年全球新发RCC 403 262例,死亡175 098例,发病人数占所有恶性肿瘤患者人数的2.2%[1]。RCC早期临床表现隐匿,20%~50%的患者最终会发展为转移性RCC(metastatic RCC,mRCC)[2]。RCC远处转移时具有明显的趋骨性[3],骨是RCC第2常见的转移部位,20%~35%的mRCC患者会出现骨转移[4-5]。骨转移会导致顽固性骨痛、病理性骨折、脊髓压迫等骨相关事件(skeletal-related event,SRE),85%的骨转移患者在生存期内至少经历2项SRE相关并发症,严重影响患者的生活质量,加大治疗难度,并消耗大量医疗资源[6]。既往研究表明RCC骨转移患者中位生存期仅为8个月,1年和5年的总体生存率仅为47%和11%[7]。
近年来随着手术技术的进步以及分子靶向药物与新型免疫药物的应用,mRCC患者生存期不断延长,出现骨转移等并发症的概率也逐渐升高[8]。本研究对2012年1月至2017年12月海军军医大学(第二军医大学)长征医院收治的未发生骨转移RCC患者与RCC骨转移患者的病理资料进行回顾性分析,并对25例先后或同时于长征医院切除肾癌原发灶和骨转移灶的患者进行配对分析,探讨RCC骨转移病理特点与转移高危因素,以提高泌尿外科医师对RCC骨转移病理特点的认识,为临床实践提供参考。
1 资料和方法 1.1 病例资料对2012年1月至2017年12月在海军军医大学(第二军医大学)长征医院接受手术治疗的肾肿瘤患者进行回顾性分析,共纳入1 694例经病理检查确诊为RCC并排除骨转移的患者,其中891例患者接受肾根治性切除术(radical nephrectomy,RN),803例患者接受肾部分切除术(partial nephrectomy,PN)。病理类型包括肾透明细胞癌(clear cell RCC,CCRCC)1 412例(83.4%),肾非透明细胞癌(non-clear cell RCC,nCCRCC)中肾乳头状细胞癌(papillary RCC,pRCC)78例(4.6%)、肾嫌色细胞癌(chromophobe RCC,chRCC)79例(4.7%)、XP11.2基因转位肾癌(XP11.2 translocation RCC,XP11.2 tRCC)28例(1.7%),其他及未分类肾癌97例(5.7%)。
同期共有133例患者接受骨病灶切除术后经病理证实为RCC骨转移,其中33例以SRE为首诊表现(28例通过术前影像学检查发现肾脏病变)。所有骨转移患者中110例可通过病史、骨转移灶组织病理与免疫组织化学结果确定RCC亚型,其中CCRCC骨转移103例(93.6%),pRCC骨转移4例(3.6%),chRCC骨转移1例(0.9%),XP11.2 tRCC骨转移1例(0.9%),未分类RCC(肉瘤样变)骨转移1例(0.9%)。133例患者中,25例患者于长征医院先后或同时行肾脏原发灶与骨转移灶切除术。
1.2 研究方法根据手术部位与转移情况,将肾脏肿瘤切除术后经病理确诊为RCC且排除骨转移的1 694例患者纳入未发生骨转移组,经病理确诊为RCC骨转移的133例患者纳入骨转移组,并将其中先后或同时行肾脏原发灶及骨转移灶手术的25例患者纳入配对分析组,对肾脏原发灶与骨转移灶的组织病理与免疫组织化学结果进行回顾性分析。
1.2.1 组织病理学分析所有手术切除标本均经10%中性甲醛溶液固定,常规石蜡包埋。对石蜡标本行4 μm厚连续切片,然后进行H-E染色和Fuhrman核分级[9],观察肾包膜及肾周侵犯情况。
1.2.2 免疫组织化学分析取石蜡包埋切片组织,利用抗原抗体特异结合原理使Ki-67抗体与细胞周期活动期(G1、S、G2及M期)的Ki-67抗原相结合。经标记放大显色后,在高倍镜下计数1 000个细胞,以每100个肿瘤细胞内阳性细胞的百分比作为Ki-67标记指数。
1.3 统计学处理应用SPSS 24.0软件(美国IBM公司)进行统计学分析。计量资料采用x±s或中位数(下四分位数,上四分位数)表示,组间比较采用独立样本t检验或秩和检验;计数资料以例数和百分数表示,组间比较采用χ2 检验或秩和检验。检验水准(α)为0.05。
2 结果 2.1 RCC骨转移病理特点分析肾脏肿瘤切除后经病理确诊为RCC并排除骨转移的患者共1 694例(未发生骨转移组),其中男1 188例(70.1%),女506例(29.9%);年龄为13~71岁,平均年龄为(55.2±12.1)岁;经病理确诊为RCC骨转移的患者共133例(骨转移组),其中男112例(84.2%),女21例(15.8%);年龄为18~67岁,平均年龄为(53.7±12.3)岁。经统计学分析发现,两组患者年龄差异无统计学意义(P>0.05);骨转移组男性患者所占比例高于未发生骨转移组,差异有统计学意义(χ2=11.91,P<0.001)。
未发生骨转移组中CCRCC患者所占比例为83.4%(1 412/1 694),骨转移组(仅110例有病理亚分型)中CCRCC患者所占比例为93.6%(103/110),两组CCRCC所占比例差异有统计学意义(χ2=8.12,P=0.004),提示CCRCC较nCCRCC更容易发生骨转移。未发生骨转移组1 412例CCRCC患者中,1 398例有明确的Fuhrman核分级资料,Fuhrman核分级(以最高核分级计算)Ⅰ、Ⅱ、Ⅲ、Ⅳ级者分别为355例、796例、221例、26例,其中高级别组(FuhrmanⅢ/Ⅳ级)占17.7%(247/1 398);骨转移组CCRCC患者中62例可明确追溯肾脏原发肿瘤Fuhrman核分级,Fuhrman核分级(以最高核分级计算)Ⅰ、Ⅱ、Ⅲ、Ⅳ级者分别为8例、22例、27例、5例,其中高级别组(FuhrmanⅢ/Ⅳ级)占51.6%(32/62),两组比较差异有统计学意义(χ2=44.25,P<0.001)。
2.2 RCC骨转移配对分析25例RCC患者于长征医院先后或同时行肾脏原发灶与骨转移灶切除,其中男22例、女3例,22例行RN、3例行PN。25例骨转移RCC患者中,CCRCC骨转移23例(92.0%),pRCC骨转移1例(4.0%),XP11.2 tRCC骨转移1例(4.0%)。其中11例(44.0%)组织学病理提示肿瘤侵犯或突破肾包膜,同期未发生骨转移的RCC患者中18.9%(320/1 694)病理检查提示侵犯或突破肾包膜,发生骨转移的患者侵犯或突破肾包膜的比例高于同期未发生骨转移的患者(χ2=9.99,P=0.002)。
有配对标本的23例CCRCC骨转移患者中,肾脏肿瘤FuhrmanⅠ、Ⅱ、Ⅲ、Ⅳ级者分别为2、6、14、1例,高级别组(FuhrmanⅢ/Ⅳ级)所占比例为65.2%(15/23)。肾癌原发灶Ki-67标记指数中位数(下四分位数,上四分位数)为5.0%(2.0%,6.0%),骨转移灶Ki-67标记指数为6.0%(3.0%,15.0%)。骨转移灶的Ki-67标记指数高于肾脏原发灶(Z=-3.399,P<0.001)。
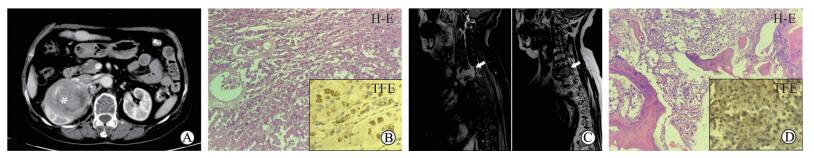
2.3 特殊病例分析本研究中包含1例少见的肾细胞癌亚型骨转移病例并获得配对标本。患者为老年女性,于健康体检时发现右肾肿瘤(图 1A),2014年8月在长征医院泌尿外科行右肾根治性切除术,术后H-E染色考虑XP11.2 tRCC(图 1B),免疫组织化学染色提示转录因子E3(translocation facor E3,TFE3)阳性(图 1B),最终诊断为XP11.2 tRCC。
|
图 1 1例XP11.2基因转位肾细胞癌患者的影像学表现和病理结果 Fig 1 Imaging and pathological findings of a patient with renal cell carcinoma associated with XP11.2 translocation A: Contrast computed tomography showing an 8.3 cm (diameter) mass in right kidney (star), with less enhancing than the cortex; B: H-E and translocation factor E3 (TFE3) immunohistochemical staining of primary renal lesion; C: Magnetic resonance imaging showing bone metastasis (arrows) in T3-T4 at 44 months after operation; D: H-E and TFE3 immunohistochemical staining of bone metastatic lesion. Original magnification: ×200 (B, D; H-E staining), ×400 (B, D; TFE3 immunohistochemical staining) |
遂行右肾RN,术后44个月患者因胸背部疼痛来我院就诊,磁共振成像检查提示T3、T4椎体占位性病变(图 1C),考虑为转移灶。对手术切除标本进行病理学检测,免疫组织化学染色提示TFE3阳性(图 1D),确诊为转移性XP11.2 tRCC。经文献检索发现,这是世界上罕见的同时获取原发灶与骨转移灶病理的XP11.2 tRCC病例。
3 讨论RCC是目前发病率和死亡率增长最快、严重危害人类健康的恶性肿瘤之一,近20年来其发病率以年均2%的速度增长[10]。近年来随着RCC治疗方式的不断改进,mRCC患者的生存期显著延长,但被公认为RCC预后不良因素的骨转移也越来越常见,并常需要外科干预或其他治疗[4-5]。目前国内泌尿外科同行已经逐渐重视RCC骨转移所致SRE及其危害,然而目前对RCC骨转移的病理特点与骨转移的高危病理因素研究仍较少。
CCRCC是发病率最高的RCC亚型[11-12],约占RCC的70%~80%[11],有研究表明几乎所有的mRCC病理类型都为CCRCC[13]。本研究收集了海军军医大学(第二军医大学)长征医院泌尿外科6年数据(2012-2017年),结果也显示CCRCC是最常见的RCC亚型(83.4%),并且CCRCC较nCCRCC患者更容易发生骨转移。
Fuhrman核分级是被广泛应用的RCC核分级系统,也是目前被广泛认同的能独立判断预后的指标,该分级系统根据肿瘤细胞核大小、形状和核仁是否明显将RCC分为4级[9]。本研究中骨转移组CCRCC患者和有配对标本的骨转移患者中肾脏原发病灶FuhrmanⅢ/Ⅳ级者分别占51.6%(32/62)和65.2%(15/23),高于同期未发生骨转移组中FuhrmanⅢ/Ⅳ级者所占比例(17.7%,247/1 398),提示FuhrmanⅢ/Ⅳ级是发生骨转移的高危因素[14]。
有配对标本的25例骨转移患者中,11例(44.0%)组织病理学提示肿瘤侵犯或突破肾脏被膜,所占比例高于同期未发生骨转移的患者(18.9%,320/1 694),提示肿瘤侵犯肾包膜也是骨转移的高危因素。25例患者中3例患者行PN,其中1例以SER为首发症状,首先切除骨骼病灶后经病理明确为RCC骨转移,因肾肿瘤较小且影像学不典型,为保留肾功能、提高生活质量并为后续靶向治疗创造条件而行姑息性PN;2例为PN后出现骨转移,虽然病理提示肾包膜完整,但均为FuhrmanⅢ级。另有1例提示CCRCC伴肉瘤样变,目前已有研究指出存在肉瘤样变是RCC发生转移的独立危险因素[14]。因此对于FuhrmanⅢ/Ⅳ级与肿瘤侵犯肾包膜的RCC患者需缩短随访间隔,并在复查时增加骨扫描等骨转移筛查项目。
Ki-67标记指数是最常用的细胞增殖标志,可以标记处于增殖周期的各期细胞,广泛用于肿瘤预后的判断。本研究结果显示RCC原发灶与骨转移灶的Ki-67标记指数总体均不高,与张力杰等[15]研究结果类似。Ki-67标记指数总体均不高或许是RCC对化学治疗药物耐药的原因之一,骨转移灶Ki-67标记指数较肾脏原发灶高,提示骨转移灶细胞增殖更加活跃。
RCC早期临床表现隐匿,患者以骨转移导致的SRE首先至骨科就诊。本组骨转移患者中33例以SRE为首诊表现,其中28例通过术前影像学检查发现肾脏病变,因此以不明原因骨痛、病理性骨折等SER症状就诊的患者,应考虑到RCC骨转移可能[16],需进行肾脏影像学筛查以避免漏诊。部分以SRE首诊的RCC骨转移患者肾脏病灶影像学表现不典型或不明显[17],此时穿刺或切除骨骼病灶明确诊断可指导后续治疗,本组中1例患者术前检查未发现明显的肾脏病灶,4例患者行计算机断层扫描或磁共振成像检查考虑肾囊肿,最终通过骨骼病灶病理检查明确RCC骨转移诊断,后续接受RCC靶向药物治疗[18]。另外RCC患者肾脏术后出现单发骨骼破坏时行骨骼病灶穿刺活组织检查也有助于鉴别与骨转移有相似表现的骨骼感染与其他原发肿瘤,还能获得靶向基因表达等信息以指导后续个体化治疗[19]。
了解RCC骨转移的高危病理因素有助于制定个体化的随访方案,在规范化随访的基础上对高危患者加强骨转移筛查项目,有利于骨转移病灶的早发现与早治疗。虽然目前肾癌骨转移的临床表现与肿瘤生物学特点尚不明确,治疗方法均属于姑息性治疗的范畴,但明确的病理诊断是制定个体化治疗方案的先决条件,或有助于降低患者SRE发生率并进一步改善预后[20]。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, SIEGEL R L, TORRE L A, JEMAL A. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68: 394-424. DOI:10.3322/caac.v68.6 |
| [2] |
SHINDER B M, RHEE K, FARRELL D, FARBER N J, STEIN M N, JANG T L, et al. Surgical management of advanced and metastatic renal cell carcinoma: a multidisciplinary approach[J/OL]. Front Oncol, 2017, 7: 107. doi: 10.3389/fonc.2017.00107.
|
| [3] |
PRASAD S R, HUMPHREY P A, CATENA J R, NARRA V R, SRIGLEY J R, CORTEZ A D, et al. Common and uncommon histologic subtypes of renal cell carcinoma:imaging spectrum with pathologic correlation[J]. Radiographics, 2006, 26: 1795-1810. DOI:10.1148/rg.266065010 |
| [4] |
WOODWARD E, JAGDEV S, MCPARLAND L, CLARK K, GREGORY W, NEWSHAM A, et al. Skeletal complications and survival in renal cancer patients with bone metastases[J]. Bone, 2011, 48: 160-166. DOI:10.1016/j.bone.2010.09.008 |
| [5] |
UMER M, MOHIB Y, ATIF M, NAZIM M. Skeletal metastasis in renal cell carcinoma:a review[J]. Ann Med Surg (Lond), 2018, 27: 9-16. DOI:10.1016/j.amsu.2018.01.002 |
| [6] |
王林辉, 董毅. 重视肾癌骨转移的个体化治疗[J]. 临床泌尿外科杂志, 2018, 33: 337-341. |
| [7] |
CHEN S C, KUO P L. Bone metastasis from renal cell carcinoma[J/OL]. Int J Mol Sci, 2016, 17. pii: E987. doi: 10.3390/ijms17060987.
|
| [8] |
BARATA P C, RINI B I. Treatment of renal cell carcinoma:current status and future directions[J]. CA Cancer J Clin, 2017, 67: 507-524. DOI:10.3322/caac.21411 |
| [9] |
DELAHUNT B, EBLE J N, EGEVAD L, SAMARATUNGA H. Grading of renal cell carcinoma[J]. Histopathology, 2019, 74: 4-17. DOI:10.1111/his.2019.74.issue-1 |
| [10] |
SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2018[J]. CA Cancer J Clin, 2018, 68: 7-30. DOI:10.3322/caac.21442 |
| [11] |
DENG F M, MELAMED J. Histologic variants of renal cell carcinoma:does tumor type influence outcome?[J]. Urol Clin North Am, 2012, 39: 119-132. DOI:10.1016/j.ucl.2012.02.001 |
| [12] |
MOCH H, CUBILLA A L, HUMPHREY P A, REUTER V E, ULBRIGHT T M. The 2016 WHO classification of tumours of the urinary system and male genital organs-part a:renal, penile, and testicular tumours[J]. Eur Urol, 2016, 70: 93-105. DOI:10.1016/j.eururo.2016.02.029 |
| [13] |
CAIRNS P. Renal cell carcinoma[J]. Cancer Biomark, 2010, 9(1/2/3/4/5/6): 461-473. |
| [14] |
DU Y, PAHERNIK S, HADASCHIK B, TEBER D, DUENSING S, JÄGER D, et al. Survival and prognostic factors of patients with renal cell cancer with bone metastasis in the era of targeted therapy: a single-institution analysis[J/OL]. Urol Oncol, 2016, 34: 433.e1-8. doi: 10.1016/j.urolonc.2016.05.017.
|
| [15] |
张力杰, 黄晓波, 徐涛, 许清泉, 王晓峰. 肾癌原发灶与骨转移灶配对组织的免疫组化分析[J]. 中华泌尿外科杂志, 2014, 35: 561-564. DOI:10.3760/cma.j.issn.1000-6702.2014.08.001 |
| [16] |
董毅, 王德胜, 吴震杰, 刘冰, 鲍一, 王坚超, 等. 肾细胞癌骨转移114例临床特点分析[J]. 临床泌尿外科杂志, 2018, 33: 342-345. |
| [17] |
王达, 胡劲博, 刘玉杰, 何韶辉, 龚海熠, 张浩, 等. 不明原发灶骨转移癌的诊疗进展[J]. 中国骨与关节杂志, 2017, 6: 716-720. |
| [18] |
ESCUDIER B, POWLES T, MOTZER R J, OLENCKI T, ARÉN FRONTERA O, OUDARD S, et al. Cabozantinib, a new standard of care for patients with advanced renal cell carcinoma and bone metastases? Subgroup analysis of the METEOR trial[J]. J Clin Oncol, 2018, 36: 765-772. DOI:10.1200/JCO.2017.74.7352 |
| [19] |
ŁUKASZEWSKI B, NAZAR J, GOCH M, ŁUKASZEWSKA M, STĘPIŃSKI A, JURCZYK M U. Diagnostic methods for detection of bone metastases[J]. Contemp Oncol (Pozn), 2017, 21: 98-103. |
| [20] |
RUATTA F, DEROSA L, ESCUDIER B, COLOMBA E, GUIDA A, BACIARELLO G, et al. Prognosis of renal cell carcinoma with bone metastases:experience from a large cancer centre[J]. Eur J Cancer, 2019, 107: 79-85. DOI:10.1016/j.ejca.2018.10.023 |
 2019, Vol. 40
2019, Vol. 40


