2. 上海交通大学医学院附属新华医院心内科, 上海 200093
2. Department of Cardiology, Xinhua Hospital Affiliated to Shanghai Jiao Tong University School of Medicine, Shanghai 200093, China
高脂血症是心脑血管疾病的独立危险因素之一,对血脂异常的防治尤为重要[1]。虽然他汀类降脂药物已得到广泛应用,但我国第二次临床血脂控制达标率调研结果显示,高危和极高危心血管病患者的低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)达标率仅为31%和22%[2]。有氧运动是许多疾病的有效治疗手段之一,大量研究表明有氧运动可调节血脂含量[3-6],但有氧运动调节脂代谢的分子机制尚不明确。本研究通过观察有氧运动对高脂血症大鼠脂代谢以及肝组织中蛋白转化酶枯草溶菌素9(proprotein convertase subtilisin/kexin type 9,PCSK9)、胆固醇调节元件结合蛋白(sterol regulatory element binding proteins,SREBP)、低密度脂蛋白受体(low-density lipoprotein receptor,LDLR)表达水平的影响,探讨有氧运动对高脂血症大鼠脂代谢的调节作用及可能机制。
1 材料和方法 1.1 实验动物和分组处理健康雄性SD大鼠120只,8周龄,体质量213~251 g,购自常州卡文斯实验动物有限公司[动物生产许可证号:SCXK(苏)2016-0010]。自然光照,室温为(22±2)℃,相对湿度为55%左右。随机分为正常对照组和3个实验组,每组30只。正常对照组给予标准饲料,3个实验组饲喂高脂饲料(标准饲料中混合1%胆固醇、5%猪油、0.61%丙基硫氧嘧啶、0.35%胆酸钠),均自由取食、饮水,连续9周,记录各组大鼠摄食情况。3个实验组大鼠经高脂饲料喂食1周后,1组不作其他干预,记为高脂饮食组;1组每周注射PCSK9抑制剂SBC-115076(8 mg/kg)1次,连续8周,记为SBC-115076组;1组在150 cm×80 cm×80 cm的玻璃水池中进行无负重游泳,水温(32±2)℃,每天定时于上午10:00开始进行游泳练习,每周运动时间从最初的10 min/d开始,随后每天增加10 min,每周运动6 d,1周内增至60 min/d,保持运动量,持续8周,记为有氧运动组。
1.2 主要试剂及仪器PCSK9抑制剂SBC-115076购自美国Selleck公司。甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体购自美国Bioworld公司,PCSK9抗体、SREBP1抗体、SREBP2抗体、LDLR抗体购自英国Abcam公司。XDS-2型倒置生物显微镜(北京泰克汇光科技有限公司),ABI ViiA7实时荧光定量PCR仪(美国Applied Biosystems公司),SPECTRA max Plus 384酶标仪(美国Molecular Devices公司),Mini-Proten Tetra System电泳系统和ChemiDoc XRS+ System凝胶成像仪(美国Bio-Rad公司),TE2000荧光显微镜(日本Nikon公司),TCS SP8共聚焦显微镜(德国Leica公司)。
1.3 血液指标检测最后一次干预结束后,大鼠禁食24 h,称体质量。以4%戊巴比妥钠麻醉,心脏采血2 mL,离心后取上层血清,用7020型全自动生化仪(日本Hitachi公司)测定血清三酰甘油(triglyceride,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白(low-density lipoprotein,LDL)、高密度脂蛋白(high-density lipoprotein,HDL)水平。
1.4 H-E染色观察大鼠胸主动脉病理学改变大鼠心脏采血后,迅速取其胸主动脉约1 cm,平展于滤纸上,放入10%中性甲醛溶液中固定24~48 h,固定后切取胸主动脉0.3 cm厚的横断面进行脱水包埋,制备4 μm厚连续切片,H-E染色后在显微镜下观察胸主动脉病理学改变。
1.5 实时荧光定量PCR检测大鼠肝组织中相关mRNA的表达取大鼠肝组织,用TRIzol法提取RNA。加入40 μL DEPC水溶解RNA,置于-80 ℃冰箱保存备用。用紫外分光光度计测定RNA浓度,反转录合成cDNA。以cDNA为模板,采用SYBR Green RT-PCR试剂盒配制10 μL反应体系,进行PCR反应。引物序列:PCSK9上游引物5′-AAC TTG GCG TCT CAT CCT GG-3′,下游引物5′-AGC TGG CCA AAG CCA ACT AT-3′;LDLR上游引物5′-ACC TGC CGA CCT GAC GAA-3′,下游引物5′-CCA AGC TGA TGC ACT CCC-3′;SREBP1上游引物5′-CGG AGC CAT GGA TTG CAC ATT-3′,下游引物5′-CTG TCT CAC CCC CAG CAT AG-3′;SREBP2上游引物5′-TCT GGA GGC TGG TTT GAC-3′,下游引物5′-TGA CCG AGG AGC GTG AGT-3′。扩增条件:95 ℃ 10 min;95 ℃ 10 s、60 ℃ 15 s、72 ℃ 20 s,40个循环。以β-actin、GAPDH为内参照,采用2-ΔΔCt法计算目的RNA的相对表达量。
1.6 蛋白质印迹分析检测大鼠肝组织中相关蛋白的表达取少量肝组织加入100 μL RIPA裂解液冰浴匀浆,充分裂解后13 470×g离心5 min,收集上清,用BCA法测定蛋白浓度,按浓度加入2×蛋白样品上样缓冲液,煮沸变性后进行10%聚丙烯酰胺凝胶电泳分离,然后电转至硝酸纤维素膜。用5%脱脂奶粉封闭,封闭结束后将膜分别放入含PCSK9(稀释比例1:2 000)、LDLR(稀释比例1:1 000)、SREBP1(稀释比例1:1 000)、SREBP2(稀释比例1:1 000)和GAPDH(稀释比例1:2 000)的一抗稀释液中,4 ℃摇床振荡孵育过夜。一抗孵育结束后加入用TBST稀释的二抗(稀释比例1:5 000),室温摇床振荡反应1~2 h。将膜移入凝胶成像分析仪中,化学光敏模式曝光显影。
1.7 免疫荧光检测大鼠肝组织中相关蛋白的表达取肝组织标本,冰冻切片,室温晾干15 min。用预冷的4%多聚甲醛溶液固定10 min。用磷酸盐缓冲液(phosphate buffer saline,PBS)洗3次,每次5 min;3% Triton X-100溶液室温通透30 min;PBS洗3次,每次5 min。用5%牛血清白蛋白(bovine serum albumin,BSA)封闭20 min。去除BSA液,每张切片加入50 μL稀释后的一抗覆盖组织,4 ℃过夜。PBS洗3次,每次5 min。去除PBS液,每张切片加50~100 μL相应种属的荧光二抗,室温避光孵育2 h。PBS洗3次,每次5 min。去除PBS液,每张切片加50~100 μL DAPI溶液,室温避光孵育5 min,用PBS冲洗3次。以90%甘油封片,在荧光显微镜下观察。
1.8 共聚焦显微镜检测大鼠肝组织中SREBP1和SREBP2的入核情况取肝组织标本,以4%多聚甲醛溶液固定24 h,石蜡包埋、切片。按1.7项下方法进行免疫荧光标记,在共聚焦显微镜下观察。
1.9 统计学处理采用SPSS 16.0软件进行统计学分析,计量资料以x±s表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验。检验水准(α)为0.05。
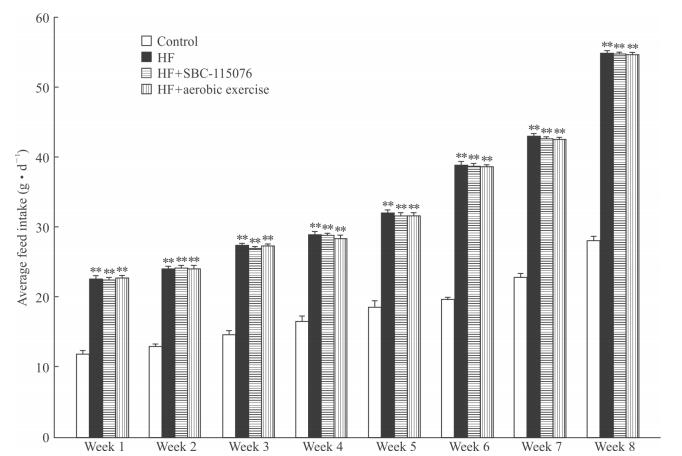
2 结果 2.1 各组大鼠摄食情况从第1周到第8周,与正常对照组相比,经高脂饲料喂食的3个实验组大鼠摄食量均升高(P<0.01),并随着时间延长不断增加,但3个实验组之间摄食量差异无统计学意义(P>0.05)。见图 1。
|
图 1 各组大鼠摄食情况 Fig 1 Feed intake of rats in each group HF: High-fat diet. **P < 0.01 vs control group. n=30, x±s |
2.2 各组大鼠体质量变化和血脂水平
造模前,正常对照组和3个实验组大鼠体质量差异无统计学意义(P>0.05)。第8周时,3个实验组大鼠体质量均高于正常对照组(P<0.01);有氧运动组大鼠体质量低于高脂饮食组、SBC-115076组(P<0.01)。见表 1。与正常对照组比较,高脂饮食组大鼠血清中TG、TC和LDL水平升高(P<0.01),HDL水平降低(P<0.01);与高脂饮食组相比,SBC-115076组和有氧运动组大鼠TG、TG、LDL水平降低(P<0.01),HDL水平升高(P<0.01);SBC-115076组和有氧运动组血脂水平差异无统计学意义(P>0.05)。见表 1。
|
|
表 1 各组大鼠体质量变化和血脂水平的比较 Tab 1 Comparison of body mass and serum lipid profile of rats in each group |
2.3 各组大鼠主动脉壁病理变化
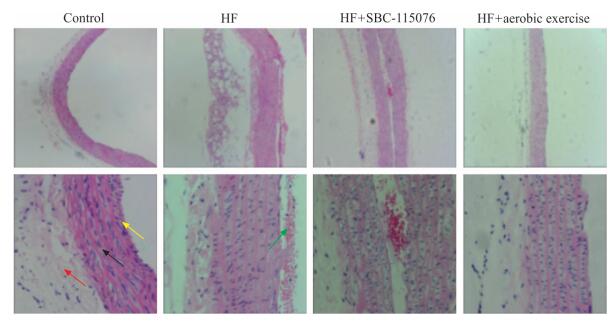
对照组大鼠主动脉壁结构完整,内膜光滑,层次清晰,内皮细胞完整无脱落。高脂饮食组大鼠主动脉壁内膜增厚,内皮细胞损伤脱落,弹力膜断裂明显,平滑肌增生且排列紊乱;SBC-115076组内皮细胞有脱落现象,但相比高脂饮食组减少;有氧运动组相比高脂饮食组内膜增厚明显减轻,内皮损伤较少。见图 2。
|
图 2 各组大鼠胸主动脉H-E染色结果 Fig 2 H-E staining of thoracic aorta of rats in each group The red arrow indicates the loose connective tissue, the black arrow indicates the tunica media, the yellow arrow indicates the tunica intima, and the green arrow indicates the shedding endothelial cells. HF: High-fat diet. Original magnification: ×100 (upper), ×400 (below) |
2.4 各组大鼠肝组织中PCSK9、LDLR、SREBP1 和SREBP2 mRNA的表达水平
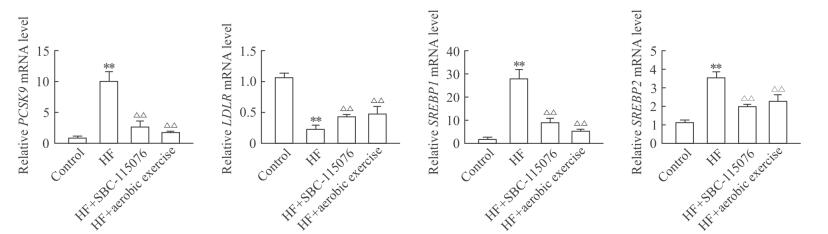
与对照组相比,高脂饮食组大鼠肝组织中PCSK9、SREBP1和SREBP2 mRNA表达水平升高,LDLR mRNA表达水平降低(P<0.01);与高脂饮食组相比,SBC-115076组和有氧运动组大鼠肝组织中PCSK9、SREBP1和SREBP2 mRNA表达水平降低(P<0.01),LDLR mRNA表达水平升高(P<0.01)。见图 3。
|
图 3 各组大鼠肝组织中PCSK9、LDLR、SREBP1和SREBP2的mRNA表达水平 Fig 3 mRNA expression levels of hepatic PCSK9, LDLR, SREBP1 and SREBP2 of rats in each group PCSK9: Proprotein convertase subtilisin/kexin type 9; LDLR: Low-density lipoprotein receptor; SREBP: Sterol regulatory element binding protein; HF: High-fat diet. **P < 0.01 vs control group; △△P < 0.01 vs HF group. n=30, x±s |
2.5 各组大鼠肝组织中PCSK9、LDLR、SREBP1和SREBP2蛋白的表达水平
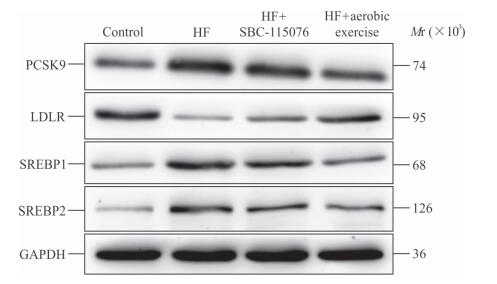
蛋白质印迹分析结果显示,与对照组相比,高脂饮食组大鼠肝组织中PCSK9、SREBP1和SREBP2蛋白表达水平升高,LDLR蛋白表达水平降低;与高脂饮食组相比,SBC-115076组和有氧运动组大鼠肝组织中PCSK9、SREBP1和SREBP2蛋白表达水平降低,LDLR蛋白表达水平升高(图 4)。免疫荧光检测结果显示,与对照组相比,高脂饮食组大鼠肝组织中PCSK9、SREBP1和SREBP2蛋白表达水平升高(P<0.01),LDLR蛋白表达水平降低(P<0.01);与高脂饮食组相比,SBC-115076组和有氧运动组大鼠肝组织中PCSK9、SREBP1和SREBP2表达水平降低(P<0.01),LDLR表达水平升高(P<0.01,图 5)。
|
图 4 蛋白质印迹分析检测各组大鼠肝组织中PCSK9、LDLR、SREBP1和SREBP2蛋白的表达水平 Fig 4 Western blotting detecting protein expression levels of hepatic PCSK9, LDLR, SREBP1 and SREBP 2 of rats in each group PCSK9: Proprotein convertase subtilisin/kexin type 9; LDLR: Low-density lipoprotein receptor; SREBP: Sterol regulatory element binding protein; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase; HF: High-fat diet |

|
图 5 免疫荧光法检测各组大鼠肝组织中PCSK9、LDLR、SREBP1和SREBP2蛋白的表达水平 Fig 5 Immunofluorescence detecting expression levels of hepatic PCSK9, LDLR, SREBP1 and SREBP2 protein of rats in each group PCSK9: Proprotein convertase subtilisin/kexin type 9; LDLR: Low-density lipoprotein receptor; SREBP: Sterol regulatory element binding protein; HF: High-fat diet; DAPI: 4' 6, -Diamidino-2-phenylindole. **P < 0.01 vs control group; △△P < 0.01 vs HF group. n=30, x±s |
2.6 各组大鼠肝组织中SREBP1和SREBP2的入核情况
共聚焦显微镜检测结果显示,与对照组相比,高脂饮食组大鼠肝组织中SREBP1和SREBP2入核表达水平升高;与高脂饮食组相比,SBC-115076组和有氧运动组大鼠肝组织中SREBP1和SREBP2入核表达水平降低(图 6)。
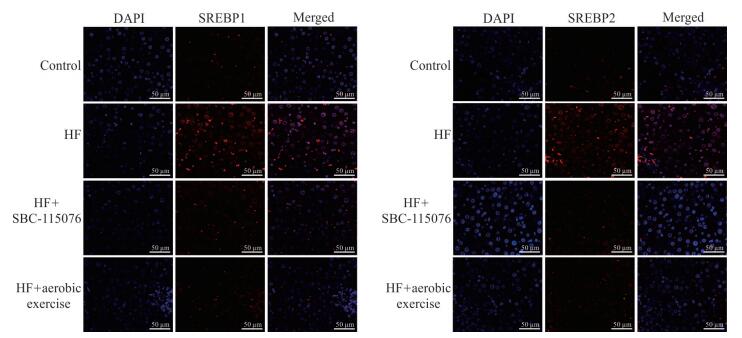
|
图 6 共聚焦显微镜检测各组大鼠肝组织中SREBP1和SREBP2的入核表达情况 Fig 6 Confocal microscope detecting transportation of hepatic SREBP1 and SREBP2 to nucleus of rats in each group SREBP: Sterol regulatory element binding protein; HF: High-fat diet; DAPI: 4' 6, -Diamidino-2-phenylindole |
3 讨论
血脂异常与饮食和生活方式有密切关系,饮食治疗和改善生活方式是血脂异常治疗的基础措施[7]。有氧运动是许多疾病防治的有效手段之一,针对其在血脂异常等肥胖相关的慢性代谢性疾病方面的研究已经成为热点。一项针对33个相关研究的meta分析发现,有氧运动能够使心血管疾病死亡率下降35%[8]。近年研究发现,有氧运动可通过多种途径调节血脂含量,是一种有效、安全的治疗手段[3-6],但其调节脂代谢的具体分子机制目前仍不清楚[9-10]。
史亚丽等[11]通过饲喂大鼠高脂膳食制作高血脂大鼠模型,并通过5周游泳训练制作有氧运动大鼠模型,所有动物模型均制造成功。本研究参照此模型制作方法,结果显示从第1周到第8周,与对照组相比,经高脂饲料喂饲的3个实验组大鼠摄食量和体质量均明显增加,3个实验组之间摄食量无明显差异,与既往研究[12]相符;而有氧运动组体质量低于高脂饮食组和SBC-115076组,说明有氧运动能减轻高脂饮食引起的体质量增加。高脂饮食组大鼠经高脂饲料喂饲8周后,血清中TG、TC和LDL水平均高于对照组,HDL水平低于对照组;而SBC-115076组和有氧运动组大鼠血清TG、TC和LDL水平低于高脂饮食组,HDL水平高于高脂饮食组,但SBC-115076组和有氧运动组之间血脂水平差异无统计学意义。结果表明有氧运动和PCSK9抑制剂SBC-115076均能降低高血脂大鼠的血清TG、TC和LDL水平,升高HDL水平,且有氧运动对高血脂大鼠的降脂程度与PCSK9抑制剂相仿。组织学观察表明,有氧运动能明显改善高脂饮食导致的内膜增厚,内皮损伤较少,而SBC-115076组内皮细胞有少许脱落现象,可能与有氧运动降脂作用机制通过多通路、多途径,较PCSK9抑制剂更为复杂有关。
PCSK9 是高胆固醇血症的第3个易感基因,其作为一个新的治疗靶点已成为高胆固醇血症研究的热点[13]。人群流行病学资料显示,PCSK9 基因突变与血液胆固醇水平相关[14]。PCSK9能介导LDLR降解,抑制血清中低密度脂蛋白胆固醇转运到细胞中的过程,从而抑制血脂水平的降低[15]。Maxwell等[16]用基因芯片和定量PCR分析了胆固醇饮食对小鼠肝脏基因表达的影响,发现PCSK9 可能是SREBP的靶基因;Horton等[17]研究了SREBP-1a和SREBP-2转基因鼠中PCSK9的表达,发现PCSK9表达增加,表明PCSK9可能受SREBP调控。
本研究结果显示,有氧运动及PCSK9抑制剂均可使高血脂大鼠肝组织中PCSK9、SREBP1和SREBP2的mRNA及蛋白表达水平降低,LDLR的mRNA及蛋白表达水平升高,且有氧运动和PCSK9抑制剂能够抑制高脂饮食引起的SREBP1和SREBP2入核表达,提示有氧运动可能通过降低SREBP家族蛋白的表达和PCSK9的表达,从而解除对LDLR表达的抑制。Wen等[18]研究踏板运动对高脂饮食C57BL/6小鼠PCSK9表达的影响,结果发现小鼠外周血中的PCSK9下降,然而肝脏的PCSK9反而上升,该研究结果与本研究中大鼠肝组织PCSK9的表达下降并不一致,考虑可能与实验动物种类、运动方式、运动时间不同有关。
在临床实践中,许多患者在接受了较大剂量他汀类药物治疗后其胆固醇水平仍不能降到目标值以下,另有一些患者由于种种原因不能耐受他汀治疗,这已成为提高血脂达标率的重要羁绊[2]。PCSK9抑制剂被认为是继他汀类药物后的新一代降脂药物[19],但该药为针剂,须长期皮下或静脉注射治疗,也比较昂贵。本研究结果表明有氧运动能减轻高脂饮食引起的体质量增加,其降脂作用与PCSK9抑制剂相仿,能显著改善高脂饮食导致的内膜增厚及内皮损伤,其降脂机制可能与抑制高脂肪饮食引起的大鼠肝组织中SREBP1和SREBP2入核表达,降低PCSK9、SREBP1和SREBP2表达,解除对LDLR表达的抑制有关。本研究结果提示对血脂异常进行干预时,除应用降脂药物外,应以改变饮食及生活方式为基石,积极推广有氧运动。
| [1] |
MASUDA D, YAMASHITA S. Postprandial hyperlipidemia and remnant lipoproteins[J]. J Atheroscler Thromb, 2017, 24: 95-109. |
| [2] |
第二次中国临床血脂控制状况多中心协作研究组. 第二次中国临床血脂控制达标率及影响因素多中心协作研究[J]. 中华心血管病杂志, 2007, 35: 420-427. DOI:10.3760/j.issn:0253-3758.2007.05.004 |
| [3] |
SHAKIL-UR-REHMAN S, KARIMI H, GILLANI S A. Effects of supervised structured aerobic exercise training program on high and low density lipoprotein in patients with type Ⅱ diabetes mellitus[J]. Pak J Med Sci, 2017, 33: 96-99. |
| [4] |
林小晶, 鲁林, 王晓慧. 炎症因子chemerin在有氧运动改善动脉粥样硬化大鼠血脂和主动脉硬化中的作用[J]. 上海体育学院学报, 2017, 41: 49-56. |
| [5] |
吴卫东, 张建军, 岳静静, 荆西民. 有氧运动对载脂蛋白E基因缺陷小鼠主动脉C反应蛋白表达水平的影响[J]. 中国康复医学杂志, 2014, 29: 714-717. DOI:10.3969/j.issn.1001-1242.2014.08.004 |
| [6] |
杨关林, 张会永, 庞琳琳, 杨茗茜, 周鹤, 李芹, 等. 跑步运动联合高脂单笼喂饲建立巴马小型猪高脂血症脾虚痰浊证动物模型[J]. 中华中医药学刊, 2016, 34: 2055-2060. |
| [7] |
潘秀凤. 社区高血脂人群生活方式的调查分析[J]. 山西医药杂志, 2010, 39: 828-829. |
| [8] |
NOCON M, HIEMANN T, MÜLLER-RIEMENSCHNEIDER F, THALAU F, ROLL S, WILLICH S N. Association of physical activity with all-cause and cardiovascular mortality:a systematic review and meta-analysis[J]. Eur J Cardiovasc Prev Rehabil, 2008, 15: 239-246. DOI:10.1097/HJR.0b013e3282f55e09 |
| [9] |
孙焱, 郝选明, 耿青青, 李金焕, 张艳艳, 任琦. 有氧运动改善动脉粥样硬化病变的抗炎症机制研究[J]. 北京体育大学学报, 2014, 37: 62-67. |
| [10] |
方彩霞, 沈志强. 有氧运动干预动脉粥样硬化作用机制的研究进展[J]. 医学综述, 2013, 19: 2536-2539. DOI:10.3969/j.issn.1006-2084.2013.14.013 |
| [11] |
史亚丽, 辛晓林, 王昌留, 李爱民. 有氧游泳运动对老年高血脂大鼠脂代谢影响的研究[J]. 北京体育大学学报, 2004, 27: 1053-1054. DOI:10.3969/j.issn.1007-3612.2004.08.017 |
| [12] |
李峻岭, 王琳, 李丽华, 杨亦春, 刘明开. 高脂饮食对慢性肾衰大鼠摄食量及其下丘脑食欲素A的影响[J]. 大连大学学报, 2009, 30: 91-94. DOI:10.3969/j.issn.1008-2395.2009.06.024 |
| [13] |
CHAUDHARY R, GARG J, SHAH N, SUMNER A. PCSK9 inhibitors:a new era of lipid lowering therapy[J]. World J Cardiol, 2017, 9: 76-91. |
| [14] |
BLOM D J, DENT R, CASTRO R C, TOTH P P. PCSK9 inhibition in the management of hyperlipidemia:focus on evolocumab[J]. Vasc Health Risk Manag, 2016, 12: 185-197. |
| [15] |
SIBLE A M, NAWARSKAS J J, ANDERSON J R. PCSK9 inhibitors:an innovative approach to treating hyperlipidemia[J]. Cardiol Rev, 2016, 24: 141-152. DOI:10.1097/CRD.0000000000000102 |
| [16] |
MAXWELL K N, SOCCIO R E, DUNCAN E M, SEHAYEK E, BRESLOW J L. Novel putative SREBP and LXR target genes identified by microarray analysis in liver of cholesterol-fed mice[J]. J Lipid Res, 2003, 44: 2109-2119. DOI:10.1194/jlr.M300203-JLR200 |
| [17] |
HORTON J D, SHAH N A, WARRINGTON J A, ANDERSON N N, PARK S W, BROWN M S, et al. Combined analysis of oligonucleotide microarray data from transgenic and knockout mice identifies direct SREBP target genes[J]. Proc Natl Acad Sci USA, 2003, 100: 12027-12032. DOI:10.1073/pnas.1534923100 |
| [18] |
WEN S, JADHAV K S, WILLIAMSON D L, RIDEOUT T C. Treadmill exercise training modulates hepatic cholesterol metabolism and circulating PCSK9 concentration in high-fat-fed mice[J/OL]. J Lipids, 2013, 2013: 908048. doi: 10.1155/2013/908048.
|
| [19] |
李勇. PCSK9抑制剂会改变临床降脂治疗的未来吗?[J]. 心血管病学进展, 2017, 38: 483-487. |
 2019, Vol. 40
2019, Vol. 40


