2. 解放军南部战区总医院肝胆外科, 广州 510010
2. Department of Hepatobiliary Surgery, General Hospital of Southern Theater Command of PLA, Guangzhou 510010, Guangdong, China
近年来,原发性肝癌已成为世界范围内第6大最常见的恶性肿瘤及第2大恶性肿瘤致死原因,其中起源于肝细胞的肝细胞癌(hepatocellular carcinoma,HCC)占总原发性肝癌的90%以上[1]。根据2015年发布的全球肿瘤统计年鉴报告,2012年全球新增确诊HCC病例782 500例,死亡745 500例,其中中国新发病例和死亡病例占据全球的一半以上[2]。2016年发布的中国肿瘤流行病学报告显示,2015年中国新发HCC病例446 100例,死亡422 100例[3]。尽管对于中早期HCC患者而言,其疾病情况相对乐观,但5年生存率仍然较低(约50%)[4]。由此可见,HCC严重威胁着人类的健康,积极探索更有效的治疗方法对于中早期HCC患者非常急迫。
近年来,随着手术技术、影像学技术及分子生物学的发展和进步,HCC的治疗方式已由手术治疗为主发展为多种方法相结合的综合治疗,包括肝切除术、化学治疗、放射治疗、射频消融术、靶向药物治疗及介入治疗等[5]。经动脉化学栓塞术(transarterial chemoembolization,TACE)是目前最常见的HCC介入治疗方法,可一定程度地使患者达到临床缓解,从而提高生活质量。传统TACE(conventional TACE,cTACE)以碘化油作为化学治疗药物的载体,经肝动脉栓塞肝脏肿瘤血管并释放化学治疗药物杀死肿瘤细胞,但由碘化油较强的扩散性而导致的系统性毒性反应给患者带来了许多严重并发症[6]。作为一种新型的介入治疗方法,载药微球TACE(drug-eluting bead-TACE,DEB-TACE)以微球作为载体,可有效地控制化学治疗药物的释放,避免化学治疗药物扩散至全身循环系统,从而最大化地杀死肿瘤细胞并降低化学治疗药物毒性[7]。DEB-TACE治疗中期或不可手术的HCC患者的疗效和安全性均较好,有研究显示其可作为接受肝移植手术HCC患者的辅助治疗手段[8]。尽管辅助治疗已经广泛应用于HCC患者的治疗,但DEB-TACE作为一种辅助治疗手段治疗中早期HCC患者的疗效和安全性目前尚不明确。本研究旨在评估DEB-TACE治疗中早期HCC患者的疗效和安全性,并探讨影响其预后因素。
1 对象和方法 1.1 研究对象本研究为前瞻性队列研究,连续纳入2016年4月至2017年9月期间在解放军南部战区总医院介入室接受DEB-TACE治疗的中早期HCC患者26例。纳入标准:(1)根据美国肝病研究协会(American Association for the Study of the Liver Diseases,AASLD)指南中的诊断标准[9],经病理诊断和无创诊断方法确诊为原发性HCC的患者;(2)巴塞罗那临床肝癌分期(Barcelona Clinic Liver Cancer,BCLC)为A、B期;(3)年龄>18岁;(4)准备接受DEB-TACE治疗;(5)能够定期随访的患者。排除标准:(1)有肝移植史;(2)合并血管造影、栓塞术或动脉穿刺禁忌证者;(3)凝血功能严重减退且无法纠正;(4)有其他实体肿瘤或恶性血液病史者;(5)严重感染或心肺功能不全者;(6)肝肾功能衰竭者;(7)孕妇或哺乳期妇女;(8)有认知障碍无法理解研究内容者。本研究已获得解放军南部战区总医院伦理委员会审批,所有患者均已签署知情同意书。
1.2 信息采集所有患者签署知情同意书后,详细记录患者的人口学特征和临床病理特征,包括年龄、性别、乙型肝炎病史、饮酒史、病灶数、肿瘤最大直径、有无静脉侵犯、BCLC分期、Child-pugh分级、美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分、DEB-TACE治疗次数、cTACE治疗史和手术治疗史。
1.3 CalliSpheres®微球加载化学治疗药物所有患者均接受加载吡柔比星的CalliSpheres®微球(直径100~300 μm,苏州恒瑞迦俐生生物医药科技有限公司)进行DEB-TACE治疗。吡柔比星加载过程:(1)准备吡柔比星80 mg,将吡柔比星用无菌注射用水溶解于10 mL注射器内,配制成浓度约为20 mg/mL的溶液;(2)打开CalliSpheres®微球瓶盖后,插入注射器针头,平衡瓶内压力,轻摇瓶身使微球分布均匀,后将瓶身倾斜,使用20 mL注射器抽取微球及生理盐水,然后将注射器竖直放置2~3 min直到微球沉降完全,随后尽可能地推出多余上清液;(3)用三通管将装有微球的注射器(20 mL)和装有吡柔比星溶液的注射器(10 mL)连通,将其连接牢固并注意流向,一边推动装有吡柔比星溶液的注射器(10 mL),另一边抽动装有微球的注射器(20 mL),缓缓地将微球和吡柔比星溶液混合到一个注射器(20 mL)中,盖紧注射器并放置30 min,期间每隔5 min轻轻摇匀1次;(4)微球载药完成后,立刻加入与微球比例为1~1.2:1的非离子型对比剂,静置5 min后即可使用;(5)使用前需将混悬液摇匀,并用1 mL注射器抽取,置于室温下待用。
1.4 加载化学药物的微球栓塞治疗(1)肝动脉造影:肝动脉造影采用数字减影血管造影(digital subtraction angiography,DSA),如果发现肝脏某区域血管稀少或缺乏,则探查可能存在的供养肿瘤的侧支血管;(2)肿瘤供血动脉栓塞:使用直径2.4 F的微导管(MC-PE27131,泰尔茂,日本)超选插管至肿瘤供血动脉内,以1 mL/min的速度、脉冲注射方式缓缓注入混有造影剂的载药微球混悬液,待造影剂流速缓慢甚至停滞时停止栓塞;(3)再次造影:等待5 min后再次造影,如发现仍有肿瘤显影则重复上述栓塞过程,直到肿瘤显影全部消失,如一瓶CalliSpheres®载药微球使用完后还未达到栓塞终点,则加用空白微球;(4)拔出导管及导管鞘:栓塞完成后拔除导管鞘,对穿刺部位进行压迫止血,随后包扎伤口。使患者仰卧,并且保持术侧下肢伸直,制动6~12 h。
1.5 术后处理介入术后给予患者保肝和降酶治疗(乙酰半胱氨酸4 g静脉滴注,丁二磺酸腺苷蛋氨酸1 g静脉推注),并酌情给予镇痛、通便、补液等支持治疗3~5 d。
1.6 术后随访记录患者术后3个月内影像学评估结果,根据改良实体瘤疗效评价标准(modified response evaluation criteria in solid tumor,mRECIST)[10]分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(sable disease,SD)和疾病进展(progressive disease,PD)。CR指所有目标病灶动脉期增强显影均消失,PR指目标病灶(动脉期增强显影)的直径总和缩小≥30%,SD指目标病灶(动脉期增强显影)的直径总和缩小但未达PR或增加但未到PD,PD指目标病灶(动脉期增强显影)的直径总和增加≥20%或出现新病灶。总有效率(objective response rate,ORR)定义为达到CR及PR患者的比例;疾病控制率(disease control rate,DCR)定义为达到CR、PR和SD患者的比例。同时,详细记录患者围手术期发生的不良事件,包括疼痛、发热和胃肠道反应等。疼痛采用数字分级法分为轻度疼痛(1~3分)、中度疼痛(4~6分)和重度疼痛(7~10分)。此外,所有患者术后半年内每月随访1次,之后每3个月随访1次,中位随访时间为7.2个月(范围:2.9~20.0个月),最后随访日期为2017年12月20日。无进展生存期(progression free survival,PFS)定义为患者接受手术的时间到患者疾病出现进展或死亡的时间,总生存期(overall survival,OS)定义为患者接受手术的时间到患者因任何原因导致死亡的时间。
1.7 统计学处理采用SPSS 22.0软件(美国IBM公司)和Office 2010(美国Microsoft公司)进行统计学分析。计量资料以x±s或中位数(下四分位数,上四分位数)表示,组内手术前后数据的比较采用Wilcoxon符号秩检验;计数资料采用频次和百分数表示,两组间比较采用χ2 检验;等级资料采用频次和百分数表示,两组间比较采用Wilcoxon符号秩检验。使用单变量和多变量logistic回归模型分析ORR的影响因素(将单变量logistic回归模型中P<.1的因素进一步纳入多变量logistic回归模型进行分析)。采用Kaplan-Meier曲线(K-M曲线)和log-rank检验分析PFS和OS,并进一步采用单变量和多变量Cox比例风险回归模型分析PFS和OS的预测因素(将单变量Cox比例风险回归模型中P<.1的因素进一步纳入多变量Cox比例风险回归模型进行分析)。检验水准(α)为0.05。
2 结果 2.1 患者基线期信息26例中早期HCC患者中,男22例、女4例,平均年龄为(57.38±12.02)岁。24例(92.3%)有乙型肝炎病史,4例(15.4%)有饮酒史,17例(65.4%)有肝硬化病史。单发病灶和多发病灶各13例,肿瘤最大直径为49.0(24.8,70.3)cm,所有患者均未见静脉侵犯。根据BCLC分期标准,A期患者16例(61.5%),B期患者10例(38.5%)。根据Child-pugh分级标准,A级患者25例(96.2%),B级患者1例(3.8%)。ECOG评分0分25例(96.2%),2分1例(3.8%)。20例(76.9%)接受DEB-TACE治疗1次,6例(23.1%)接受DEB-TACE治疗2次及以上。14例(53.8%)有cTACE治疗史,6例(23.1%)有手术治疗史。
2.2 术后1个月肝功能指标及肿瘤标志物水平的变化术后1个月时,HCC患者的甲胎蛋白(α-fetoprotein,AFP)水平较术前下降,差异有统计学意义(P=0.031);总胆汁酸(total bile acid,TBA)水平较术前降低,差异有统计学意义(P=0.015)。其他肝功能指标及肿瘤标志物水平在术后1个月时与术前比较差异无统计学意义(P>0.05)。见表 1。
|
|
表 1 中早期肝细胞癌患者术前和术后1个月肝功能指标及肿瘤标志物水平的变化 Tab 1 Liver function indexes and tumor markers of patients with early and middle stage hepatocellular carcinoma before operation and at 1 month after operation |
2.3 DEB-TACE治疗后的应答率
26例中早期HCC患者接受DEB-TACE治疗后3个月内,CR 5例(19.2%)、PR 12例(46.2%)、SD 5例(19.2%),仅4例(15.4%)患者为PD。ORR达到65.4%(17/26),DCR达到84.6%(22/26)。
2.4 ORR亚组分析如表 2所示,将患者根据基线期信息进行亚组分类比较其ORR的差异,结果显示肿瘤最大直径<50 mm(P=0.013)及BCLC分期A期(P=0.031)的患者ORR较高。其他亚组间ORR差异无统计学意义(P均>0.05)。
|
|
表 2 基于中早期肝细胞癌患者基线期信息的ORR亚组分析 Tab 2 Subgroup analyses of ORR according to the baseline information of patients with early and middle stage hepatocellular carcinoma |
2.5 ORR影响因素分析
采用单变量logistic回归模型分析临床病理特征对中早期HCC患者接受DEB-TACE治疗后ORR的影响,结果显示肿瘤最大直径≥50 mm(P=0.013)及BCLC分期B期(P=0.040)的患者获得ORR的可能更小。进一步采用多变量logistic回归模型分析中早期HCC患者接受DEB-TACE治疗后ORR的独立预测因素,结果显示肿瘤最大直径≥50 mm(P=0.036)是患者ORR较差的独立预测因素。见表 3。
|
|
表 3 中早期肝细胞癌患者ORR影响因素的logistic回归分析 Tab 3 Logistic regression analysis of factors affecting ORR of patients with early and middle stage hepatocellular carcinoma |
2.6 PFS和OS的预测因素
26例中早期HCC患者经DEB-TACE治疗后,中位PFS为11.9个月[95%置信区间(confidence interval,CI):5.0~18.9个月,图 1A],中位OS为14.6个月(95% CI:9.9~19.2个月,图 1B)。采用单变量Cox比例风险回归模型分析临床病理特征对中早期HCC患者接受DEB-TACE治疗后PFS的影响,结果显示多发病灶(P=0.028)、BCLC分期B期(P=0.027)及ECOG评分2分(P=0.015)预示患者PFS较差;进一步采用多变量Cox比例风险回归模型进行分析,发现无临床病理特征可独立预测中早期HCC患者接受DEB-TACE治疗后的PFS(表 4)。采用单变量和多变量Cox比例风险回归模型对影响OS的因素进行分析,结果显示无临床病理特征可预测中早期HCC患者的OS(表 5)。
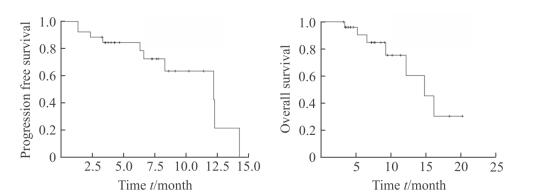
|
图 1 中早期肝细胞癌患者的无进展生存期和总生存期 Fig 1 Progression free survival and overall survival of patients with early and middle stage hepatocellular carcinoma |
|
|
表 4 中早期肝细胞癌患者PFS影响因素的Cox比例风险回归分析 Tab 4 Cox proportional hazard regression analysis of factors affecting PFS of patients with early and middle stage hepatocellular carcinoma |
|
|
表 5 中早期肝细胞癌患者OS影响因素的单变量Cox比例风险回归分析 Tab 5 Univariate Cox proportional hazard regression analysis of factors affecting OS of patients with early and middle stage hepatocellular carcinoma |
2.7 围手术期不良事件及与治疗史的关系
本研究中的26例中早期HCC患者共接受32次DEB-TACE治疗,其中有1例患者的1次DEB-TACE治疗的相关不良反应记录有缺失,因此只记录到31次治疗的不良事件发生情况。围手术期发生疼痛频次为15次(48.4%),包括轻度疼痛10次(32.3%)及中度疼痛5次(16.1%);发生发热频次为10次(32.3%);发生胃肠道反应频次为5次(16.1%)。既往cTACE治疗史及手术治疗史对于围手术期不良事件疼痛、发热及胃肠道反应均无影响(P均>0.05)。见表 6。
|
|
表 6 既往cTACE治疗史及手术治疗史与中早期肝细胞癌患者围手术期不良事件的关联 Tab 6 Correlations of cTACE and surgery history with adverse events of patients with early and middle stage hepatocellular carcinoma during perioperative period |
2.8 典型病例
患者男,42岁,因“肝脏肿瘤切除术后7年余,末次介入治疗2个月余”于2017年9月11日入院。患者于2010年4月因反复右上腹痛诊断为原发性肝癌,2010年5月14日行肝右叶部分切除术,2012年9月复查发现肝Ⅵ段肝癌复发,因此分别于2012年9月18日行肝动脉cTACE、2012年10月23日行肝脏肿瘤射频消融术,术后恢复良好。2013年3月复查发现肝右叶Ⅵ、Ⅶ段新发病灶,并于2013年4月9日、2014年1月14日、2014年5月13日、2014年6月10日、2016年12月27日、2017年6月28日行肝动脉cTACE。既往乙型肝炎“大三阳”16年。
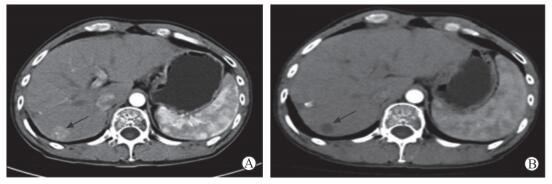
入院后行腹部增强计算机断层扫描(computed tomography,CT)检查提示:肝内病灶碘油沉积不均匀,肝Ⅵ、Ⅷ段病变(图 2A),考虑肿瘤复发。AFP 136.79 μg/L。肝功能Child-Pugh A级。诊断:HCC综合治疗后复发。2017年9月14日行肝动脉DEB-TACE。术中造影见肝右叶多发大小不等团块状、结节状肿瘤复发染色,右膈动脉亦参与肿瘤供血(图 3)。以100~300 μm Callispheres®可载药微球1瓶加载吡柔比星80 mg栓塞肿瘤供血动脉,辅以少量300~500 μm空白微球进行栓塞。栓塞后造影显示肿瘤血供完全阻断。术后7周复查腹部增强CT提示肿瘤完全坏死、无强化(图 2B),AFP正常,评估为CR。
|
图 2 1例42岁男性肝细胞癌复发患者行DEB-TACE术前、术后腹部增强CT检查结果对比 Fig 2 Comparison of abdominal enhanced CT in a 42 years old male patient with hepatocellular carcinoma before and after DEB-TACE A: Tumor response was enhanced as assessed by preoperative abdominal enhanced CT (arrow); B: Tumor was completely necrotic and unenhanced at 7 weeks after surgery (arrow). DEB-TACE: Drug-eluting bead-transarterial chemoembolization; CT: Computed tomography |

|
图 3 1例42岁男性肝细胞癌复发患者DEB-TACE术中动脉造影表现 Fig 3 Arteriography of a 42 years old male patient with hepatocellular carcinoma during DEB-TACE surgery A, B: Multiple nodular neoplasms of the right lobe of the liver were stained, and the right diaphragmatic artery was involved in tumor blood supply; C, D: After embolization, the tumor blood supply was completely blocked, and the tumor staining disappeared. DEB-TACE: Drug-eluting bead-transarterial chemoembolization |
3 讨论
HCC是世界上最常见的消化系统恶性肿瘤之一,其高致死率使探索最佳治疗策略成为一个不容忽视的问题。目前介入治疗已经成为临床上肝癌患者重要治疗方法之一,其中最常用的肝癌介入治疗为TACE。尽管TACE已经广泛应用于治疗中期HCC患者,尤其是不可手术的患者,关于DEB-TACE治疗在中早期HCC患者中的疗效和安全性却鲜有研究。本研究连续纳入26例中早期HCC患者,分析DEB-TACE治疗中早期HCC患者的疗效、安全性及预后因素。
本研究发现:(1)26例中早期HCC患者接受DEB-TACE治疗后3个月内ORR达到65.4%(17/26),DCR达到84.6%(22/26);(2)肿瘤最大直径<50 mm及BCLC分期为A期的患者ORR较高,肿瘤最大直径≥50 mm是中早期HCC患者ORR较差的独立预测因素;(3)DEB-TACE治疗后,围手术期不良事件主要包括疼痛、发热及胃肠道反应。
据报道,不同时期的HCC患者在DEB-TACE治疗后,ORR可达到52%~73.1%,DCR可达到70%~78.3%[11-15]。此外,有研究显示经DEB-TACE治疗后,中期HCC患者的中位PFS和OS分别为5.1个月(95% CI:4.1~7.7个月)和13.3个月(95% CI:10.1~18.6个月)[16]。由于患者类型及疗效的评估时间不一致,故本研究结果与上述报道有数值上的差异。本研究发现接受DEB-TACE治疗后3个月内,中早期HCC患者的ORR达到65.4%,DCR达到84.6%;中位PFS为11.9个月(95% CI:5.0~18.9个月),中位OS为14.6个月(95% CI:9.9~19.2个月)。此外,一些研究评估了影响TACE治疗原发性肝癌疗效的因素,包括肿瘤大小、肿瘤类型、血供情况、肝内病灶、肝功能及栓塞次数和技术等[17]。其中TACE被证实对于肿瘤直径<5 cm、血供丰富、单发病灶或有包膜的HCC患者有良好疗效[18-19]。与上述研究结果类似,本研究结果显示中早期HCC患者肿瘤最大直径<50 mm及BCLC分期为A期的患者ORR较高,且肿瘤最大直径≥50 mm是中早期HCC患者ORR较差的独立预测因素。这可能是由于:(1)DEB-TACE基本原理之一是通过肝动脉注入载有化学治疗药物的微球阻断肿瘤动脉血供,使其缺血坏死,因此,肿瘤最大直径越小其肿瘤供血动脉分支越少,从而栓塞的疗效越显著且释放的化学治疗药物对肿瘤细胞的杀伤作用越明显;(2)对于BCLC分期而言,肿瘤最大直径是其评分的重要指标之一,故BCLC分期对于中早期HCC患者DEB-TACE治疗后预后的影响可能类似于肿瘤大小。
DEB-TACE治疗后HCC患者发生的不良反应同样引起了人们的关注。据报道,疼痛、发热、腹泻、胃肠道出血、肝功能损害、胆管扩张及胆囊炎被记录为最常见的DEB-TACE围手术期不良事件[20-21]。与以上报道相似,本研究发现31次DEB-TACE治疗记录中,围手术期不良事件主要包括疼痛、发热以及胃肠道反应。
本研究仍有一些不足。其一,样本量小,今后应扩大样本量进一步研究;其二,本研究为单中心研究,今后应纳入来自多中心的病例进一步研究;其三,随访时间相对较短,中位随访时间仅7.2个月,故DEB-TACE治疗中早期HCC患者的长期疗效及安全性尚未评估,因此,今后的研究应延长随访时间。
综上所述,DEB-TACE治疗对于中早期HCC患者具有良好的疗效及安全性,且肿瘤最大直径≥ 50 mm可作为患者临床应答不良的独立预测因素。
| [1] |
FORNER A, REIG M, BRUIX J. Hepatocellular carcinoma[J]. Lancet, 2018, 391: 1301-1314. DOI:10.1016/S0140-6736(18)30010-2 |
| [2] |
TORRE L A, BRAY F, SIEGEL R L, FERLAY J, LORTET-TIEULENT J, JEMAL A. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65: 87-108. DOI:10.3322/caac.21262 |
| [3] |
CHEN W, ZHENG R, BAADE P D, ZHANG S, ZENG H, BRAY F, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66: 115-132. DOI:10.3322/caac.21338 |
| [4] |
RECIO-BOILES A, BABIKER H M. Cancer, liver[M]. Treasure Island (FL): StatPearls Publishing, 2018.
|
| [5] |
杨婉婷, 侯恩存. 原发性肝癌治疗的研究进展[J]. 现代肿瘤医学, 2016, 24: 3495-3499. DOI:10.3969/j.issn.1672-4992.2016.21.041 |
| [6] |
NI J Y, XU L F, WANG W D, SUN H L, CHEN Y T. Conventional transarterial chemoembolization vs microsphere embolization in hepatocellular carcinoma:a meta-analysis[J]. World J Gastroenterol, 2014, 20: 17206-17217. DOI:10.3748/wjg.v20.i45.17206 |
| [7] |
XIE Z B, WANG X B, PENG Y C, ZHU S L, MA L, XIANG B D, et al. Systematic review comparing the safety and efficacy of conventional and drug-eluting bead transarterial chemoembolization for inoperable hepatocellular carcinoma[J]. Hepatol Res, 2015, 45: 190-200. DOI:10.1111/hepr.12450 |
| [8] |
YU C Y, OU H Y, WENG C C, HUANG T L, CHEN T Y, LEUNG-CHIT L, et al. Drug-eluting bead transarterial chemoembolization as bridge therapy for hepatocellular carcinoma before living-donor liver transplantation[J]. Transplant Proc, 2016, 48: 1045-1048. DOI:10.1016/j.transproceed.2015.12.078 |
| [9] |
BRUIX J, SHERMAN M; American Association for the Study of Liver Diseases. Management of hepatocellular carcinoma:an update[J]. Hepatology, 2011, 53: 1020-1022. DOI:10.1002/hep.24199 |
| [10] |
LENCIONI R, LLOVET J M. Modified RECIST (mRECIST) assessment for hepatocellular carcinoma[J]. Semin Liver Dis, 2010, 30: 52-60. DOI:10.1055/s-0030-1247132 |
| [11] |
SOUSA P F, PRETO A S, LEÃO D, MADUREIRA A M, PAQUETE J, COSTA-MAIA J, et al. [Transcatheter arterial chemoembolization with doxorubicin eluting beads in the treatment of hepatocellular carcinoma][J]. Acta Med Port, 2011, 24: 29-36. |
| [12] |
POPOVIC P, STABUC B, JANSA R, GARBAJS M. Survival of patients with intermediate stage hepatocellular carcinoma treated with superselective transarterial chemoembolization using doxorubicin-loaded DC Bead under cone-beam computed tomography control[J]. Radiol Oncol, 2016, 50: 418-426. DOI:10.1515/raon-2015-0045 |
| [13] |
BOULIN M, HILLON P, CERCUEIL J P, BONNETAIN F, DABAKUYO S, MINELLO A, et al. Idarubicin-loaded beads for chemoembolisation of hepatocellular carcinoma:results of the IDASPHERE phaseⅠtrial[J]. Aliment Pharmacol Ther, 2014, 39: 1301-1313. DOI:10.1111/apt.2014.39.issue-11 |
| [14] |
MALAGARI K, POMONI M, KELEKIS A, POMONI A, DOURAKIS S, SPYRIDOPOULOS T, et al. Prospective randomized comparison of chemoembolization with doxorubicin-eluting beads and bland embolization with BeadBlock for hepatocellular carcinoma[J]. Cardiovasc Intervent Radiol, 2010, 33: 541-551. DOI:10.1007/s00270-009-9750-0 |
| [15] |
NI J Y, SUN H L, CHEN Y T, LUO J H, WANG W D, JIANG X Y, et al. Drug-eluting bead transarterial chemoembolization in the treatment for unresectable soft tissue sarcoma refractory to systemic chemotherapy:a preliminary evaluation of efficacy and safety[J]. J Cancer Res Clin Oncol, 2018, 144: 157-163. DOI:10.1007/s00432-017-2530-3 |
| [16] |
LEE Y K, JUNG K S, KIM D Y, CHOI J Y, KIM B K, KIM S U, et al. Conventional versus drug-eluting beads chemoembolization for hepatocellular carcinoma:emphasis on the impact of tumor size[J]. J Gastroenterol Hepatol, 2017, 32: 487-496. DOI:10.1111/jgh.2017.32.issue-2 |
| [17] |
PRAJAPATI H J, XING M, SPIVEY J R, HANISH S I, EL-RAYES B F, KAUH J S, et al. Survival, efficacy, and safety of small versus large doxorubicin drug-eluting beads TACE chemoembolization in patients with unresectable HCC[J]. AJR Am J Roentgenol, 2014, 203: W706-W714. DOI:10.2214/AJR.13.12308 |
| [18] |
VESSELLE G, QUIRIER-LELEU C, VELASCO S, CHARIER F, SILVAIN C, BOUCEBCI S, et al. Predictive factors for complete response of chemoembolization with drug-eluting beads (DEB-TACE) for hepatocellular carcinoma[J]. Eur Radiol, 2016, 26: 1640-1648. DOI:10.1007/s00330-015-3982-y |
| [19] |
EBIED O M, FEDERLE M P, CARR B I, PEALER K M, LI W, AMESUR N, et al. Evaluation of responses to chemoembolization in patients with unresectable hepatocellular carcinoma[J]. Cancer, 2003, 97: 1042-1050. DOI:10.1002/(ISSN)1097-0142 |
| [20] |
DEIPOLYI A R, OKLU R, AL-ANSARI S, ZHU A X, GOYAL L, GANGULI S. Safety and efficacy of 70-150μm and 100-300μm drug-eluting bead transarterial chemoembolization for hepatocellular carcinoma[J]. J Vasc Interv Radiol, 2015, 26: 516-522. DOI:10.1016/j.jvir.2014.12.020 |
| [21] |
钱国军, 曲增强, 陈汉, 高亚莲, 程红岩, 陈栋, 等. 肝动脉栓塞化疗术治疗肝癌的副作用和并发症(附1000例报告)[J]. 中华肝胆外科杂志, 2001, 7: 38-39. DOI:10.3760/cma.j.issn.1007-8118.2001.01.014 |
 2019, Vol. 40
2019, Vol. 40


