多囊肾病(polycystic kidney disease,PKD)是人类最常见的单基因遗传病之一,按其遗传方式可分常染色体显性多囊肾病(autosomal dominant polycystic kidney disease,ADPKD)和常染色体隐性多囊肾病(autosomal recessive polycystic kidney,ARPKD),其中ADPKD是发病率最高的遗传性肾病,在我国终末期肾功能衰竭病因中居第4位[1]。PKD的主要病理特征表现为双肾出现许多大小不等的液性囊泡,囊肿进行性长大会破坏肾脏的结构和功能,最终导致尿毒症[2]。ADPKD除累及肾脏外,还会引起肝囊肿、胰囊肿、瓣膜性心脏病、结肠憩室和颅内动脉瘤等肾外病变,因此它也是一类严重危害人体健康的系统性疾病[3-5]。
肾脏体积的检测对于PKD的研究具有重要意义。在基础研究中,PKD大鼠模型是目前研究PKD最常用的动物模型,其肾脏体积大小是评价疾病严重程度的关键指标[6-7];在临床研究中,Grantham等[8]提出肾脏总体积(total kidney volume,TKV)可以用作ADPKD患者的预后指标。既往有关PKD的动物实验研究中,大多是将大鼠处死后称肾脏质量、测量肾脏浸水体积来判断疾病的严重程度[9],尚缺乏活体动态观察的数据,不能完整体现出疾病发生、发展过程中肾脏体积的变化。目前国内尚未有能开展小动物肾脏体积活体检测的仪器,本研究应用低场磁共振技术测量PKD大鼠的肾脏体积,探讨其在PKD基础研究中的应用价值。
1 材料和方法 1.1 实验动物ADPKD模型Han:SPRD大鼠为瑞士苏黎世大学的Wuthrich教授馈赠。繁育保种后将亲代种属编号,交叉配种,避免遗传性状的缺失,种群控制在25对左右。选取子代中不同月龄的15只Han:SPRD雄性杂合子(Cy/+)用于本研究。所有大鼠均于海军军医大学(第二军医大学)实验动物中心无特定病原体级环境下饲养[SYXK(沪)2017-0004]。
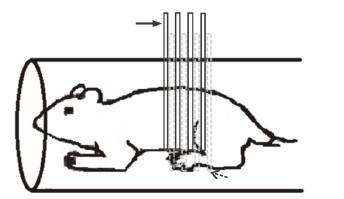
1.2 低场磁共振成像技术测量PKD大鼠肾脏体积将Han:SPRD大鼠麻醉后,使用MesoMR23-060-H-I型磁共振成像与分析系统(上海纽迈电子科技有限公司)进行低场磁共振活体检测,共振频率为23.316 MHz,磁体强度0.5 T,线圈直径为70 mm。成像方法为T1加权成像,成像位置为肾脏横断面(图 1)。最终确定的实验参数如下:重复时间(repetition time,TR)为360 ms,回波时间(echo time,TE)为18.2 ms,激励次数为10次,层厚为3 mm,层数为6层,层间距为3 mm。由临床医师和设备工程师共同判断肾脏在磁共振成像图片结果中的区域,通过计算机Matlab程序对磁共振成像数据进行处理,并对肾脏区域内的像素点大小、数量进行统计,最终计算得到两个肾脏的总体积。
|
图 1 低场磁共振成像检测Han:SPRD大鼠肾脏的成像位置 Fig 1 Renal imaging location in Han:SPRD rats by low feld magnetic resonance imaging The imaging method is T1-weighted imaging, and the cross section of the kidney is imaged, with the layer thickness being 3 mm (upper arrow) and interlayer space being 3 mm (lower arrow) |
1.3 大鼠解剖后标本采集、肾脏体积实测和血生物化学指标检测
将15只Han:SPRD大鼠称体质量后经腹腔麻醉,先进行眼眶采血备用,然后剖开腹腔、胸腔,进行心脏灌注,取出肾脏。去除肾脏包膜,称重并记录两个肾脏的总质量,计算肾脏质量/体质量比值。将大鼠肾脏放入装有5 mL水的15 mL管内,根据上升的液面计算两个肾脏的总体积。取眼眶血检测血清肌酐、尿素氮、天冬氨酸转氨酶和丙氨酸转氨酶水平。
1.4 肾脏病理观察和囊肿指数的计算取大鼠左侧肾脏,纵行切片后进行常规H-E染色,在全片扫描仪下进行全片扫描。利用Image Pro Plus 6.0软件分析并计算囊肿总面积占肾脏总面积的比例,即为该肾脏的囊肿指数[10]。
1.5 统计学处理采用SPSS 20.0软件进行统计学分析。采用配对t检验比较磁共振测量肾脏体积与解剖后实测肾脏体积的差异,采用Pearson相关分析研究磁共振测量肾脏体积与解剖后实测肾脏体积、肾脏质量、肾脏质量/体质量比值、血生物化学指标及囊肿指数的相关性。检验水准(α)为0.05。
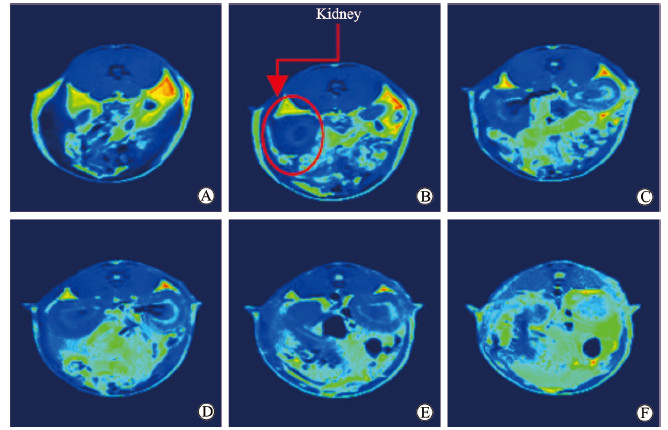
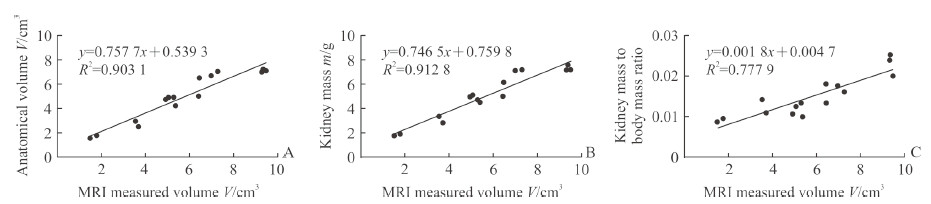
2 结果 2.1 低场磁共振技术测量大鼠肾脏体积与解剖后实测体积的对比通过低场磁共振技术能够清晰地观察到Han:SPRD大鼠的肾脏(图 2)。由表 1可见,不同月龄的15只大鼠的磁共振测量肾脏体积分别为1.51、1.77、3.54、6.45、9.34、9.38、3.72、9.51、4.95、5.31、6.47、7.01、5.39、5.08、7.31 cm3,解剖后实测肾脏体积分别为1.50、1.70、2.90、5.00、7.00、7.02、2.50、7.10、4.70、4.90、6.50、6.70、4.20、4.90、7.00 cm3。将15只大鼠磁共振测量的肾脏体积与解剖后实测肾脏体积进行对比分析,两者肾脏体积数据非常相近,差异无统计学意义(P>0.05);Pearson相关分析结果显示两者存在高度的相关性(拟合优度R2=0.903 1,图 3A)。
|
图 2 Han:SPRD大鼠低场磁共振肾脏成像伪彩图 Fig 2 Pseudo-color images of Han: SPRD rat kidney by low feld magnetic resonance imaging The kidney profile is delineated by engineers and clinicians, and image processing software is used to calculate kidney volume. A-F represent the six cross-sectional pseudo-color images from the upper pole to the lower pole of the kidney. The kidney on T1-weighted image is dark signal relative to surrounding tissue. The area is calculated according to light-dark boundary, and the volume is calculated by the area multiplied by the thickness of the layer |
|
|
表 1 15只Han:SPRD大鼠的低场MRI测量肾脏体积、解剖后实测肾脏体积、肾脏质量、肾脏质量/体质量比值 Tab 1 Kidney volume measured by low feld MRI, anatomical volume, kidney mass and kidney mass to body mass ratio of 15 Han: SPRD rats |
|
图 3 低场MRI测量的Han:SPRD大鼠肾脏体积与解剖实测肾脏体积(A)、肾脏质量(B)、肾脏质量/体质量比值(C)的相关性 Fig 3 Correlation between kidney volume of Han: SPRD rat measured by low feld MRI and anatomical volume (A), kidney mass (B) and kidney mass to body mass ratio (C) MRI: Magnetic resonance imaging |
2.2 低场磁共振测量大鼠肾脏体积与肾脏质量和肾脏质量/体质量比值的相关性
Pearson相关分析结果显示,低场磁共振测量大鼠肾脏体积与肾脏质量具有高度相关性(R2=0.912 8,图 3B)、与肾脏质量/体质量比值也存在较高的相关性(R2=0.777 9,图 3C)。
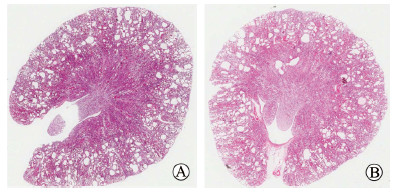
2.3 低场磁共振测量大鼠肾脏体积与血生物化学指标及肾脏囊肿指数的相关性由表 2可见,不同月龄的Han:SPRD大鼠均有一定程度的肾功能损害。肾脏病理结果可见双肾出现许多大小不等的液性囊泡(图 4)。Pearson相关分析结果显示,低场磁共振测量大鼠肾脏体积与血清肌酐、尿素氮及肾脏囊肿指数均呈正相关(相关系数r分别为0.86、0.85、0.61)。
|
|
表 2 15只Han:SPRD大鼠的血生物化学指标检测结果 Tab 2 Blood biochemical indexes of 15 Han: SPRD rats |
|
图 4 Han:SPRD大鼠肾脏病理图 Fig 4 Renal pathology of Han: SPRD rats A: The cyst index is 0.32 in a 4-month-old rat; B: The cyst index is 0.29 in a 1-month-old rat. The larger the cyst index, the more serious the damage of kidney structure. Original magnification: ×20 |
3 讨论
目前国内尚未有能开展小动物肾脏体积活体检测的仪器,低场磁共振技术在小动物上的应用有望解决这一技术难题。磁共振成像组织分辨率高,为小动物的实验研究提供了一种很好的活体观察方法。与病理解剖法相比,磁共振成像可以在不同的时间点对同一个体病变的发展过程进行连续动态的活体观察[11-13],在包括大鼠和小鼠活体成像(肿瘤及脏器诊断/药物效能测试/大鼠脑部成像)、清醒小动物体成分测试与成像分析、造影剂弛豫率分析、材料交联度与材料表面颗粒特性分析等方面得到广泛应用[14-17]。本研究使用上海纽迈电子科技有限公司生产的MesoMR23-060H-I型磁共振成像分析仪,利用低场磁共振技术测量Han:SPRD大鼠肾脏体积,以期为PKD的基础研究提供参考依据。相比于传统的解剖后取肾脏标本进行实测,该方法无需处死动物,只需要对动物进行麻醉处理而不必使用任何其他化学试剂,测试时间可控制在30 min以内,通过计算机Matlab程序对磁共振成像数据进行处理,并对肾脏区域内的像素点大小、数量进行统计,最终实现活体大鼠肾脏体积的定量评价。
本研究结果发现,15只Han:SPRD大鼠低场磁共振测量肾脏体积与解剖后的实测肾脏体积存在高度的相关性(R2=0.903 1),与肾脏质量、肾脏质量/体质量比值也具有较高相关性(R2=0.912 8、R2=0.777 9),表明低场磁共振测量肾脏体积与实际测量肾脏体积十分接近。本研究还发现低场磁共振测量肾脏体积与血清肌酐、尿素氮及囊肿指数均呈正相关(相关系数r分别为0.86、0.85、0.61),说明低场磁共振测量肾脏体积能从一定程度上反映PKD的进展。因此,我们认为低场磁共振能够满足Han:SPRD大鼠肾脏体积活体检测的需求。
本研究结果显示低场磁共振技术可以在活体条件下完成对Han:SPRD大鼠肾脏体积较为精确的测量,提示可以利用该技术对Han:SPRD大鼠的肾脏体积做活体动态观察,探明肾脏体积的发展趋势,进而完整体现出疾病的发生、发展过程,为PKD的基础研究提供参考依据。
| [1] |
RODRIGUEZ D, KAPOOR S, EDENHOFER I, SEGERER S, RIWANTO M, KIPAR A, et al. Inhibition of sodium-glucose cotransporter 2 with dapagliflozin in Han:SPRD rats with polycystic kidney disease[J]. Kidney Blood Press Res, 2015, 40: 638-647. DOI:10.1159/000368540 |
| [2] |
GALLIANI M, CHICCA S, VITALIANO E, DI LULLO L, GIANNAKAKIS K, PAONE A.[Renal manifestation of autosomal dominant polycystic kidney disease] [J]. G Ital Nefrol, 2018, 35. pii: 2018-vol2. https://www.ncbi.nlm.nih.gov/pubmed/29582957
|
| [3] |
SUTTERS M, GERMIND C G. Autosomal dominant polycystic kidney disease:molecular genetics and pathophysiology[J]. J Lab Clin Med, 2003, 141: 91-101. DOI:10.1067/mlc.2003.13 |
| [4] |
ONG A C, DEVUYST O, KNEBELMANN B, WALZ G; ERA-EDTA Working Group for Inherited Kidney Diseases. Autosomal dominant polycystic kidney disease:the changing face of clinical management[J]. Lancet, 2015, 385: 1993-2002. DOI:10.1016/S0140-6736(15)60907-2 |
| [5] |
YAO Q, WU M, ZHOU J, ZHOU M, CHEN D, FU L, et al. Treatment of persistent gross hematuria with tranexamic acid in autosomal dominant polycystic kidney disease[J]. Kidney Blood Press Res, 2017, 42: 156-164. DOI:10.1159/000474961 |
| [6] |
HARSKAMP L R, GANSEVOORT R T, BOERTIEN W E, VAN OEVEREN W, ENGELS G E, VAN GOOR H, et al. Urinary EGF receptor ligand excretion in patients with autosomal dominant polycystic kidney disease and response to tolvaptan[J]. Clin J Am Soc Nephrol, 2015, 10: 1749-1756. DOI:10.2215/CJN.09941014 |
| [7] |
XUE C, ZHOU C, MEI C. Total kidney volume:the most valuable predictor of autosomal dominant polycystic kidney disease progression[J]. Kidney Int, 2018, 93: 540-542. DOI:10.1016/j.kint.2017.10.027 |
| [8] |
GRANTHAM J J, COOK L T, TORRES V E, BOST J E, CHAPMAN A B, HARRIS P C, et al. Determinants of renal volume in autosomal-dominant polycystic kidney disease[J]. Kidney Int, 2008, 73: 108-116. DOI:10.1038/sj.ki.5002624 |
| [9] |
NANTAVISHIT J, CHATSUDTHIPONG V, SOODVILAI S. Lansoprazole reduces renal cyst in polycystic kidney disease via inhibition of cell proliferation and fluid secretion[J]. Biochem Pharmacol, 2018, 154: 175-182. DOI:10.1016/j.bcp.2018.05.005 |
| [10] |
YANG Y, CHEN M, ZHOU J, LV J, SONG S, FU L, et al. Interactions between macrophages and cyst-lining epithelial cells promote kidney cyst growth in Pkd1-deficient mice[J]. J Am Soc Nephrol, 2018, 29: 2310-2325. DOI:10.1681/ASN.2018010074 |
| [11] |
HIGASHIHARA E, NUTAHARA K, OKEGAWA T, TANBO M, HARA H, MIYAZAKI I, et al. Kidney volume estimations with ellipsoid equations by magnetic resonance imaging in autosomal dominant polycystic kidney disease[J]. Nephron, 2015, 129: 253-262. DOI:10.1159/000381476 |
| [12] |
LEONHARD W N, ZANDBERGEN M, VERAAR K, VAN DEN BERG S, VAN DER WEERD L, BREUNING M, et al. Scattered deletion of PKD1 in kidneys causes a cystic snowball effect and recapitulates polycystic kidney disease[J]. J Am Soc Nephrol, 2015, 26: 1322-1333. DOI:10.1681/ASN.2013080864 |
| [13] |
SHIN D, LEE K B, HYUN Y Y, LEE Y R, HWANG Y H, PARK H C, et al. Novel three-dimensional imaging volumetry in autosomal dominant polycystic kidney disease:comparison with 2D volumetry[J]. Clin Nephrol, 2014, 82: 98-106. DOI:10.5414/CN108181 |
| [14] |
CHEN Y, GU H, ZHANG D S, LI F, LIU T, XIA W. Highly effective inhibition of lung cancer growth and metastasis by systemic delivery of siRNA via multimodal mesoporous silica-based nanocarrier[J]. Biomaterials, 2014, 35: 10058-10069. DOI:10.1016/j.biomaterials.2014.09.003 |
| [15] |
ZHAO J Y, CHEN G, GU Y P, CUI R, ZHANG Z L, YU Z L, et al. Ultrasmall magnetically engineered Ag2Se quantum dots for instant efficient labeling and whole-body high-resolution multimodal real-time tracking of cell-derived microvesicles[J]. J Am Chem Soc, 2016, 138: 1893-1903. DOI:10.1021/jacs.5b10340 |
| [16] |
YIN J, BAO L, TIAN H, WANG Q, GAO X, YAO W. Genetic fusion of human FGF21 to a synthetic polypeptide improves pharmacokinetics and pharmacodynamics in a mouse model of obesity[J]. Br J Pharmacol, 2016, 173: 2208-2223. DOI:10.1111/bph.v173.14 |
| [17] |
CORSI C, MIGNANI R, TURCO D, MAGISTRONI R, SEVERI S. Comment on the paper:'novel approach to estimate kidney and cyst volumes using mid-slice magnetic resonance images in polycystic kidney disease'[J]. Am J Nephrol, 2014, 39: 163-164. DOI:10.1159/000358911 |
 2019, Vol. 40
2019, Vol. 40


