2. 四川大学华西医院门诊部, 成都 610041;
3. 四川大学华西医院放射科, 成都 610041
2. Department of Outpatient, West China Hospital, Sichuan University, Chengdu 610041, Sichuan, China;
3. Department of Radiology, West China Hospital, Sichuan University, Chengdu 610041, Sichuan, China
糖尿病的发病率逐年增高,据国际糖尿病联盟统计,截至2017年全球成年人口中有4.249亿糖尿病患者[1]。糖尿病是目前并发症最多的疾病之一,约有70%的2型糖尿病(type 2 diabetes mellitus,T2DM)患者死于心血管并发症[2]。糖尿病代谢紊乱时脂肪以三酰甘油的形式沉积在脂肪组织以外的器官,这既是糖尿病代谢紊乱的结果,又是各种并发症的病因之一[3]。相比单纯糖尿病患者,糖尿病合并肝脏脂肪沉积患者有更严重的糖脂代谢紊乱[4]。既往研究表明,T2DM患者合并非酒精性脂肪肝病(non-alcoholic fatty liver disease,NAFLD)会增加心血管事件的风险[5]。Dixon技术可以在T1加权成像自旋回波序列上实现水脂分离成像,从而对肝脏脂肪含量进行评价。目前磁共振波谱(magnetic resonance spectroscopy,MRS)技术是唯一能对人体组织代谢进行定量分析的无创性检查方法,被广泛应用于神经系统,而国内磁共振氢谱(1H-magnetic resonance spectroscopy,1H-MRS)应用于心脏方面的研究较少。因此,本研究对T2DM合并NAFLD患者进行1H-MRS扫描及腹部Dixon技术扫描,分别定量评价心肌三酰甘油相对含量及肝脏脂肪含量百分比,并与心功能、血清生物化学指标进行相关性分析,以进一步了解T2DM患者心肌脂肪沉积与NAFLD之间的关系。
1 资料和方法 1.1 研究对象纳入2017年1月至2018年8月四川大学华西医院内分泌科门诊确诊的52例成人T2DM患者。所有纳入的T2DM患者均接受口服降糖药或注射胰岛素治疗,且符合《中国2型糖尿病防治指南(2013年版)》 [6] T2DM诊断标准,即有典型的糖尿病症状(多饮、多尿、多食、体质量下降)且满足以下任一条件:(1)随机血糖或静脉血浆葡萄糖浓度≥ 11.1 mmol/L;(2)空腹静脉血浆葡萄糖浓度≥ 7.0 mmol/L;(3)葡萄糖负荷后2 h静脉血浆葡萄糖浓度≥ 11.0 mmol/L。无糖尿病症状者需改日重复检查。所有T2DM患者无胸痛、心悸、呼吸困难等临床症状。排除标准:心血管疾病(心肌病、先天性心脏病、肺心病、心肌梗死、瓣膜性心脏病、心律失常等)、无法控制的高血压、酒精性脂肪肝、恶性肿瘤、甲状腺疾病、其他系统性疾病、有磁共振成像(magnetic resonance imaging,MRI)检查禁忌证或MRI图像质量差。根据Dixon技术扫描结果将T2DM患者分为两组:合并NAFLD组和未合并NAFLD组。本研究获四川大学华西医院生物医学伦理委员会审批(伦理审批号No-2016-24)。所有受检者均签署MRI检查知情同意书。所有受检者信息除用于本研究外均完全保密。
1.2 研究方法 1.2.1 一般指标与血清生物化学指标测定测量并记录T2DM患者的身高、体质量、平静状态下坐位血压,计算体质量指数(body mass index,BMI)、体表面积(body surface area,BSA)。采集全血样本检测血清三酰甘油、胆固醇、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)及糖化血红蛋白(glycosylated hemoglobin,HbA1c)水平。
1.2.2 腹部Dixon序列图像采集采用德国西门子医疗系统有限公司的Skyra 3.0 T超导型磁共振成像系统进行图像采集,采用18通道体部专用相控阵线圈。受检者取仰卧位,头先进,所有图像均在屏气状态下采集,主要参数:视野(field of view,FOV)为380 mm × 380 mm,层厚为5 mm,层间距为0 mm,重复时间(repetition time,TR)为5.5 ms,回波时间(echo time,TE)为1.24 ms,每层扫描得到同相位、反相位、纯水像及纯脂肪像。
1.2.3 心脏磁共振电影序列扫描磁共振机型同上,采用18通道体部专用相控阵线圈。受检者取仰卧位,头先进,安装心电门控或指脉,所有图像均在呼气后屏气状态下采集,先采集横断位、冠状位及矢状位图像。在横断位上通过左房室瓣口中点与左心室心尖作定位线,获得左心室假两腔心图像。再在左心室假两腔心图像上通过左房室瓣口中点与左心室心尖作定位线,获得假四腔心图像。在假四腔心图像,垂直于左心室长轴作定位线获得左心室短轴图像。在左心室短轴、假两腔心及假四腔心图像基础上,获得标准四腔心和标准两腔心图像。在标准四腔心和标准两腔心图像基础上应用真实稳态自由进动(true fast imaging with steady precession,true-FISP)序列(TR为39.34 ms,TE为1.22 ms,翻转角为38 °,层厚为8 mm,FOV为340 mm × 284.58 mm,矩阵为208 × 166,每个心动周期采集25帧)获得心脏短轴电影图像(从心房基底部到心尖),以相同基础序列采集左心室长轴四腔心及两腔心电影图像。
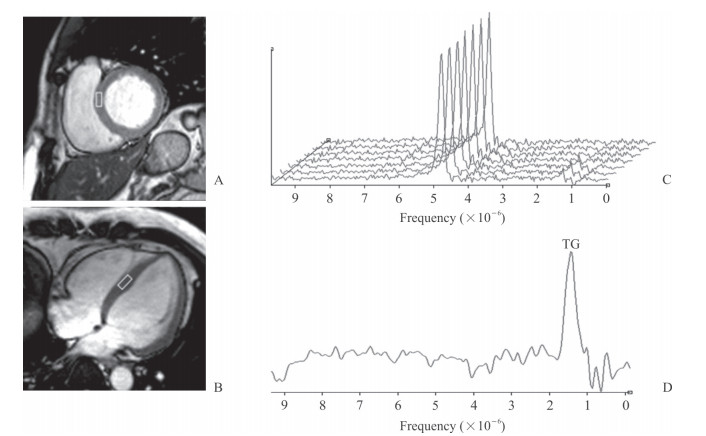
1.2.4 心脏1H-MRS扫描完成心脏磁共振电影序列扫描后进行心脏1H-MRS扫描,采用单体素波谱-自旋回波(single voxel spectroscopy-spin echo,SVS-SE)序列在呼气后屏气状态下进行波谱采集,主要参数:TR为560 ms,TE为33 ms,平均激励次数为9次,重复扫描。在标准短轴位与四腔心上定位体素,将体素定位于室间隔中部,体素大小约为1.0 cm × 2.0 cm × 1.0 cm(图 1),并根据心脏大小、心肌厚度进行适当调整。
|
图 1 左心室心肌1H-MRS扫描图 Fig 1 1H-MRS of left ventricular myocardium A, B: 1H-MRS localization in the left ventricular short-axis and 4-chamber heart images (the box represents a voxel); C: 1H-MRS spectral line map of a T2DM patient; D: The peak of TG is around 1.3×10-6 after water suppression. 1H-MRS: 1H-magnetic resonance spectroscopy; T2DM: Type 2 diabetes mellitus; TG: Triglyceride |
1.3 图像数据后处理 1.3.1 Dixon肝脏数据处理
定性评价:由2位具有高级职称的放射科医师通过同反相位图像的肝脏信号判断是否为脂肪肝[7]。定量评价:脂肪相中在肝脏放置感兴趣区(region of interest,ROI),ROI面积>1 cm2并避开Glisson系统的脉管结构,每个ROI放置3次取平均值、记录数据,获得的数值为肝脏脂肪含量百分比。
1.3.2 心功能数据处理用心血管后期处理软件(cvi42;Circle Cardiovascular Imaging Inc.,Calgary,Canada)进行心功能测定。将短轴序列数据调入软件,以四腔心为参考定位,手动勾画出从心房基底到心尖各层面舒张末期和收缩末期心外膜及心内膜,由软件自动计算获得心脏左心室舒张末期容积(left ventricular end-diastolic volume,LVEDV)、左心室收缩末期容积(left ventricular end-systolic volume,LVESV)、左心室每搏输出量(left ventricular stroke volume,LVSV)、左心室射血分数(left ventricular ejection fraction,LVEF)、左心室心输出量(left ventricular cardiac output,LVCO)、左心室心肌质量(left ventricular mass,LVmass)、左心室舒张末期内径(left ventricular end-diastolic diameter,LVEDD)、室间隔厚度(interventricular septal thickness,IVS)及左心室舒张末期心室壁厚度(left ventricular end-diastolic thickness,LVEDTH)。左心室重构指数(left ventricular mass to end-diastolic volume ratio,LVMVR)为LVmass与LVEDV的比值。
1.3.3 1H-MRS数据处理在扫描设备上将获得的原始波谱图像进行RAD格式转换后导入jMRUI波谱分析软件(jMRUI version 6.0;MRUI,Leuven,Belgium)进行波形修正、切趾抑噪、波峰平移、抑水等处理[8-9],得到1H-MRS波谱线,波谱定量获得水峰幅值、脂峰峰值、脂峰幅值。以脂峰幅值/水峰幅值× 100%表示心肌脂水比,即心肌三酰甘油相对含量。
1.4 统计学处理应用SPSS 24.0软件(SPSS Inc.,Chicago,IL,USA)进行统计学分析。对计量资料进行正态性检验和方差齐性检验,呈正态分布的计量资料以x±s表示,两组间比较采用两独立样本t检验。计数资料以例数和百分数表示,组间比较采用χ2检验。用Pearson相关分析探究心肌三酰甘油相对含量与心功能指标、肝脏脂肪含量百分比、血清生物化学指标的相关性。检验水准(α )为0.05。
2 结果 2.1 两组患者基本资料的比较共纳入T2DM患者52例,合并NAFLD组11例,其中男7例、女4例,年龄为(54.64 ± 9.78)岁;未合并NAFLD组41例,其中男27例、女14例,年龄为(54.93 ± 9.63)岁。经χ2检验,两组间性别构成比差异无统计学意义(P= 1.000)。经两独立样本t检验,两组T2DM患者的年龄、病程、BMI、BSA、血压、心率及HbA1c、胆固醇、HDL-C、LDL-C水平差异均无统计学意义(P均>0.05)。合并NAFLD组T2DM患者的三酰甘油水平高于未合并NAFLD组患者[(2.00 ± 1.07)mmol/Lvs(1.31 ± 0.59)mmol/L],差异有统计学意义(t=- 2.850,P= 0.006)。见表 1。
|
|
表 1 T2DM患者基本资料 Tab 1 Baseline characteristics of T2DM patients |
2.2 两组患者心功能参数的比较
合并NAFLD组T2DM患者的LVMVR高于未合并NAFLD组患者(0.98 ± 0.22 vs 0.76 ± 0.17),LVSV低于未合并NAFLD组患者[(60.42 ± 14.38)mL vs(72.08 ± 15.91)mL],差异均有统计学意义(t=- 2.583、2.201,P= 0.013、0.032);其余左心室功能参数在两组间差异均无统计学意义(P均>0.05)。见表 2。
|
|
表 2 T2DM患者左心室功能参数 Tab 2 Left ventricular parameters of T2DM patients |
2.3 两组心肌三酰甘油相对含量比较及相关性分析
1H-MRS扫描数据经处理得到水峰和脂峰的波谱曲线,水峰位于4.75 × 10-6附近,脂峰位于1.3 × 10-6附近(图 1D)。与未合并NAFLD组相比,合并NAFLD组T2DM患者的脂峰频率、水峰幅值差异均无统计学意义(P= 0.298、0.928,表 3)。合并NAFLD组T2DM患者心肌三酰甘油幅值高于未合并NAFLD组患者(447.27 ± 192.68 vs 283.71 ± 151.14),差异有统计学意义(t=-3.005,P= 0.004;表 3)。合并NAFLD组T2DM患者的三酰甘油相对含量(脂水比)高于未合并NAFLD组患者[(1.87 ± 0.55)% vs(1.19 ± 0.48)%],差异有统计学意义(t=-4.105,P<0.01;表 3)。合并NAFLD组T2DM患者的肝脏脂肪含量百分比高于未合并NAFLD组患者[(14.99 ± 5.21)% vs(3.51 ± 1.75%)],差异有统计学意义(t=-7.209,P<0.01;表 3)。Pearson相关分析示,T2DM患者心肌三酰甘油相对含量与肝脏脂肪含量百分比、IVS、空腹血糖及LVMVR均呈正相关(r= 0.582、0.293、0.318、0.282,P= 0.001、0.035、0.021、0.042)。
|
|
表 3 T2DM患者心肌三酰甘油相对含量及肝脏脂肪含量 Tab 3 Relative triglyceride content of myocardial and liver lipid content in T2DM patients |
3 讨论
心脏维持正常的收缩功能需要大量的能量,但心脏自身储备能量的能力有限,需要源源不断的能量供给。各种心脏疾病的产生均与心肌能量代谢改变有关[10]。糖尿病作为一种代谢性疾病,往往会增加患者心力衰竭的风险[11]。在糖尿病中,胰岛素抵抗和心血管疾病的发病机制涉及的代谢路径较为复杂,目前还不十分清楚。心脏消耗的能量主要是三磷酸腺苷(adenosine triphosphate,ATP),且心脏的能量消耗远大于其他器官[12]。当患有糖尿病时,由于胰岛素绝对或相对不足,使心肌对葡萄糖的摄取和(或)利用受损,心肌获得的能量绝大部分依赖于游离脂肪酸的氧化[3]。当体内脂质水平高于脂肪细胞的储存含量时,血浆中游离脂肪酸的含量增加[13]。增高的游离脂肪酸可以转化为三酰甘油被不同的器官吸收,包括肝脏、心脏及肌肉等[14],这些三酰甘油的积累被称为脂肪异位储存。储积在心肌的三酰甘油可以产生一系列毒性反应,如应激、炎症等,从而导致心肌细胞凋亡和心室重构,最终使心功能受损[15-16]。因此,心功能指标可能和心肌细胞内脂肪含量有关。流行病学证据表明NAFLD不仅是冠状动脉粥样硬化性心脏病的危险因素,也与心脏功能异常密切相关,参与了心脏并发症的形成和发展[17]。与单纯糖尿病相比,糖尿病合并脂肪肝患者有更严重的糖脂代谢紊乱,并且心血管事件的发生风险增加[4, 18-19]。本研究中合并NAFLD组T2DM患者的肝脏脂肪含量百分比高于未合并NAFLD组患者(P<0.01)。在左心室功能指标中,合并NAFLD组T2DM患者LVEF稍低于未合并NAFLD组患者,但差异无统计学意义(P>0.05),仅LVSV和LVMVR在两组间差异有统计学意义(P均<0.05)。可能原因是疾病处于早期阶段时LVEF尚处于代偿性正常范围,左心室容积并未发生大幅度变化。
1H-MRS技术是目前唯一一种可无创定量检测活体细胞内三酰甘油含量的手段。既往MRS多应用于大脑、肌肉、肝脏等相对静止器官。因为1H-MRS在技术上仍然存在一定的挑战,将1H-MRS应用于心脏的研究较少。Rial等[20]应用2种不同的屏气方式进行1H-MRS扫描,对健康志愿者的心肌脂肪进行定量评价,结果显示差异没有统计学意义。有学者采用1H-MRS对健康志愿者的心肌脂肪含量进行评价,发现心肌脂肪含量与年龄呈正相关[21]。动物实验证实了1H-MRS评价心肌脂肪含量的准确性[22-23]。目前可以通过心电门控、呼吸门控改进扫描序列,实现1H-MRS在心脏中的应用。1H-MRS扫描序列主要包括激励回波采集模式(stimulated echo acquisition mode,STEAM)和点分辨波谱(point resolved spectroscopy,PRESS)。STEAM技术采用3个90°脉冲,通过3个不同的层面选择梯度场,这3个90°脉冲分别施加在3个相互垂直的层面上,3个平面相交得一个点状容积的信号,其优点在于简单直接、短TE所需扫描时间短,缺点是信噪比较低[24]。PRESS技术采用1个90°脉冲和2个180°复相脉冲,层面选择和梯度场的施加与STEAM相同,其优点在于信噪比较高,但长TE扫描时间较长[25]。其中STEAM是目前较为常用的1H-MRS采集技术。Rial等[20]研究表明应用单次屏气进行心脏1H-MRS扫描具有可行性。本研究是采用SVS-SE(STEAM)序列在患者呼气后屏气的条件下进行扫描,多次扫描可以获得较满意的谱线。也有文献报道可以在呼吸门控条件下进行扫描,通过优化扫描序列可以极大地提高波谱扫描的准确性[26]。
本研究中两组水峰幅值差异没有统计学意义(P>0.05),但合并NAFLD组T2DM患者的脂峰幅值和三酰甘油相对含量(脂水比)与未合并NAFLD组相比差异均有统计学意义(P均<0.01),并且两组患者LVEF均处于正常值范围内,提示合并NAFLD组T2DM患者的心肌脂肪储积早于左心室功能障碍。既往研究表明健康非肥胖人群的心肌三酰甘油相对含量低于1%[20, 27],而本研究结果显示未合并NAFLD组T2DM患者的心肌三酰甘油相对含量高于1%,与Rijzewijk等[28]的研究结果相似。相关性分析示T2DM患者心肌三酰甘油相对含量与肝脏脂肪含量百分比、IVS、空腹血糖及LVMVR均呈正相关(P均<0.05),而与人体学特征、HbA1c、血清三酰甘油水平均无明显相关性,提示心肌三酰甘油异位储积在糖尿病发展过程中起着非常重要的作用,与糖尿病患者左心室重构的发生有关,且糖尿病患者心肌三酰甘油含量与肝脏脂肪分布较一致,而血清三酰甘油水平的高低不能反映患者心肌三酰甘油含量。但本研究中T2DM患者心肌三酰甘油相对含量与LVEF无明显相关性,其可能原因是未纳入有明显心血管疾病症状的糖尿病患者。
通过1H-MRS可以定量评价心肌三酰甘油相对含量,但本研究仍然存在一定局限性。本研究样本量小,且纳入的T2DM患者病情较轻,也未能探讨不同严重程度糖尿病患者心肌三酰甘油相对含量与心功能之间的关系。后续研究将扩大样本量,优化波谱扫描序列,进一步探讨心肌三酰甘油相对含量在不同严重程度糖尿病患者中的变化。
本研究结果表明,心脏1H-MRS作为一种无创检查方法,可以定量评价T2DM合并NAFLD患者的心肌三酰甘油相对含量,并发现其与肝脏脂肪含量百分比、IVS、空腹血糖及LVMVR有关。心脏1H-MRS定量评价心肌三酰甘油相对含量对T2DM合并NAFLD患者的疗效和心功能评估有重要意义。
| [1] |
International Diabetes Federation. IDF Diabetes Atlas, 8th edition[J/OL]. Brussels, Belgium: International Diabetes Federation, 2017.[2018-11-07]. http://diabetesatlas.org/resources/2017-atlas.html.
|
| [2] |
MORRISH N J, WANG S L, STEVENS L K, FULLER J H, KEEN H. Mortality and causes of death in the WHO multinational study of vascular disease in diabetes[J]. Diabetologia, 2001, 44(Suppl 2): S14-S21. |
| [3] |
FALLER K M, LYGATE C A, NEUBAUER S, SCHNEIDER J E. 1H-MR spectroscopy for analysis of cardiac lipid and creatine metabolism[J]. Heart Fail Rev, 2013, 18: 657-668. DOI:10.1007/s10741-012-9341-z |
| [4] |
郭敏, 郗光霞, 杨娜, 姚红. 2型糖尿病合并非酒精性脂肪性肝病的代谢相关危险因素分析[J]. 中华肝病杂志, 2014, 22: 631-635. |
| [5] |
路晓茅, 邸阜生. 2型糖尿病合并非酒精性脂肪肝患者发生心房纤颤的危险因素分析[J]. 天津医药, 2017, 45: 285-288. DOI:10.11958/20161437 |
| [6] |
中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2013年版)[J]. 中华内分泌代谢杂志, 2014, 30: 893-942. DOI:10.3760/cma.j.issn.1000-6699.2014.10.020 |
| [7] |
张天怡, 刘鹏飞. 磁共振成像诊断非酒精性脂肪肝的研究进展[J]. 医学影像学, 2017, 23: 4331-4336. |
| [8] |
JABŁOŃSKI M, STARČUKOVÁ J, STARČUK Z Jr. Processing tracking in jMRUI software for magnetic resonance spectra quantitation reproducibility assurance[J/OL]. BMC Bioinformatics, 2017, 18: 56. doi: 10.1186/s12859-017-1459-5.
|
| [9] |
陈柱.基于磁共振波谱的心肌甘油三酯的定量研究[D].南京: 东南大学, 2014. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2627393
|
| [10] |
TAHA M, LOPASCHUK G D. Alterations in energy metabolism in cardiomyopathies[J]. Ann Med, 2007, 39: 594-607. DOI:10.1080/07853890701618305 |
| [11] |
NICHOLS G A, GULLION C M, KORO C E, EPHROSS S A, BROWN J B. The incidence of congestive heart failure in type 2 diabetes:an update[J]. Diabetes Care, 2004, 27: 1879-1884. DOI:10.2337/diacare.27.8.1879 |
| [12] |
NEUBAUER S. The failing heart-an engine out of fuel[J]. N Engl J Med, 2007, 356: 1140-1151. DOI:10.1056/NEJMra063052 |
| [13] |
唐红, 李江. 肥胖致心肌脂毒性的机制的研究进展[J]. 医学与哲学, 2013, 34: 58-60. |
| [14] |
MCGAVOCK J M, VICTOR R G, UNGER R H, SZCZEPANIAK L S; American College of Physicians and the American Physiological Society. Adiposity of the heart, revisited[J]. Ann Intern Med, 2006, 144: 517-524. DOI:10.7326/0003-4819-144-7-200604040-00011 |
| [15] |
IOZZO P. Myocardial, perivascular, and epicardial fat[J]. Diabetes Care, 2011, 34(Suppl 2): S371-S379. |
| [16] |
GUZZARDI M A, IOZZO P. Fatty heart, cardiac damage, and inflammation[J]. Rev Diabet Stud, 2011, 8: 403-417. DOI:10.1900/RDS.2011.8.403 |
| [17] |
MANTOVANI A, BALLESTRI S, LONARDO A, TARGHER G. Cardiovascular disease and myocardial abnormalities in nonalcoholic fatty liver disease[J]. Dig Dis Sci, 2016, 61: 1246-1267. DOI:10.1007/s10620-016-4040-6 |
| [18] |
LU H, ZENG L, LIANG B, SHU X, XIE D. High prevalence of coronary heart disease in type 2 diabetic patients with non-alcoholic fatty liver disease[J]. Arch Med Res, 2009, 40: 571-575. DOI:10.1016/j.arcmed.2009.07.009 |
| [19] |
KOVALIC A J, SATAPATHY S K. The role of nonalcoholic fatty liver disease on cardiovascular manifestations and outcomes[J]. Clin Liver Dis, 2018, 22: 141-174. DOI:10.1016/j.cld.2017.08.011 |
| [20] |
RIAL B, ROBSON M D, NEUBAUER S, SCHNEIDER J E. Rapid quantification of myocardial lipid content in humans using single breath-hold 1H MRS at 3 Tesla[J]. Magn Reson Med, 2011, 66: 619-624. DOI:10.1002/mrm.23011 |
| [21] |
PETRITSCH B, GASSENMAIER T, KUNZ A S, DONHAUSER J, GOLTZ J P, BLEY T A, et al. Age dependency of myocardial triglyceride content:a 3T high-field 1H-MR spectroscopy study[J]. Rofo, 2015, 187: 1016-1021. DOI:10.1055/s-00000066 |
| [22] |
SHEN H, BALSCHI J A, POHOST G M, WOLKOWICZ P. 1H-MRS detected lipolysis in diabetic rat hearts requires neutral lipase[J]. J Cardiovasc Magn Reson, 2001, 3: 35-45. DOI:10.1081/JCMR-100000141 |
| [23] |
MADDEN M C, VAN WINKLE W B, KIRK K, PIKE M M, POHOST G M, WOLKOWICZ P E. 1H-NMR spectroscopy can accurately quantitate the lipolysis and oxidation of cardiac triacylglycerols[J]. Biochim Biophys Acta, 1993, 1169: 176-182. DOI:10.1016/0005-2760(93)90203-L |
| [24] |
GROVER V P, TOGNARELLI J M, CROSSEY M M, COX I J, TAYLOR-ROBINSON S D, MCPHAIL M J. Magnetic resonance imaging:principles and techniques:lessons for clinicians[J]. J Clin Exp Hepatol, 2015, 5: 246-255. DOI:10.1016/j.jceh.2015.08.001 |
| [25] |
VAN EWIJK P A, SCHRAUWEN-HINDERLING V B, BEKKERS S C, GLATZ J F, WILDBERGER J E, KOOI M E. MRS:a noninvasive window into cardiac metabolism[J]. NMR Biomed, 2015, 28: 747-766. DOI:10.1002/nbm.v28.7 |
| [26] |
SZCZEPANIAK L S, DOBBINS R L, METZGER G J, SARTONI-D'AMBROSIA G, ARBIQUE D, VONGPATANASIN W, et al. Myocardial triglycerides and systolic function in humans:in vivo evaluation by localized proton spectroscopy and cardiac imaging[J]. Magn Reson Med, 2003, 49: 417-423. DOI:10.1002/(ISSN)1522-2594 |
| [27] |
MCGAVOCK J M, LINGVAY I, ZIB I, TILLERY T, SALAS N, UNGER R, et al. Cardiac steatosis in diabetes mellitus:a 1H-magnetic resonance spectroscopy study[J]. Circulation, 2007, 116: 1170-1175. DOI:10.1161/CIRCULATIONAHA.106.645614 |
| [28] |
RIJZEWIJK L J, VAN DER MEER R W, SMIT J W, DIAMANT M, BAX J J, HAMMER S, et al. Myocardial steatosis is an independent predictor of diastolic dysfunction in type 2 diabetes mellitus[J]. J Am Coll Cardiol, 2008, 52: 1793-1799. DOI:10.1016/j.jacc.2008.07.062 |
 2019, Vol. 40
2019, Vol. 40


