2. 天津医科大学总医院心血管内科, 天津 300052
2. Department of Cardiovasology, Tianjin Medical University General Hospital, Tianjin 300052, China
肺动脉高压(pulmonary hypertension,PH)是一种以肺循环阻力进行性增加为特征的血流动力学和病理生理学异常状态,若未经治疗患者预后极差,2年内将会发生右心衰竭甚至死亡[1]。右心导管插入(right heart catheterization,RHC)检查是诊断PH的“金标准”,PH被定义为在静息状态下,经RHC检查测得的平均肺动脉压(mean pulmonary arterial pressure,mPAP)≥25 mmHg(1 mmHg=0.133 kPa)。但RHC检查有创且存在电离辐射,并且受右房室瓣反流影响较大,因此在PH患者随访中应用受限。超声心动图(ultrasonic cardiogram,UCG)是首诊PH的一线筛查手段,但受操作者经验、手法、受试部位声窗的限制,同时右心室形态不规则,使UCG无法准确评估右心功能参数。因此以上两种手段均不适用于PH患者预后的准确监测[2]。右心室应对肺动脉压逐渐增加的能力是PH患者心功能和生存能力的主要决定因素。右心室形态及功能的评估在PH患者随访过程中起核心作用。心脏磁共振(cardiac magnetic resonance,CMR)是一种多方位、多参数、多序列的成像手段,因其能无创、准确评估心室功能,在PH患者的随访中有重要作用[3]。
本研究应用CMR监测PH患者心功能指标,探寻PH患者发生主要心血管不良事件(major adverse cardiovascular event,MACE)的独立预测因素,并评估这些指标对PH患者预后的临床指导价值。
1 资料和方法 1.1 研究对象根据2015年欧洲心脏病学会制定的PH诊断标准[4],收集2012年5月至2017年8月于天津医科大学总医院经RHC检查确诊的PH患者90例(女79例)。测量并计算患者收缩期肺动脉压(systolic pulmonary arterial pressure,sPAP)、舒张期肺动脉压(diastolic pulmonary arterial pressure,dPAP)、mPAP、肺血管阻力(pulmonary vascular resistance,PVR)、右心指数(right cardiac index,RCI)等。纳入标准:(1)经RHC首诊为PH并且未经任何治疗;(2)CMR检查与RHC检查间隔时间短于2周;(3)患者无CMR检查禁忌证并知情同意;(4)CMR图像质量达到诊断及后处理要求。慢性血栓栓塞性肺动脉高压(chronic thromboembolic pulmonary hypertension,CTEPH)患者接受经球囊肺血管成形术(balloon pulmonary angioplasty,BPA)治疗,其余患者接受降肺动脉压的靶向药物治疗。通过门诊、住院及电话随访方式记录所有患者终点事件是否发生及发生时间。随访截止时间为2018年5月31日。随访终点为发生MACE,包括因右心衰竭再次入院、肺移植治疗、恶性室性心律失常、死亡。根据终点事件是否发生,将PH患者分为MACE组和non-MACE组。本研究通过天津医科大学总医院伦理委员会审批,所有受试者均无CMR检查禁忌证且均知情同意参与本研究。
1.2 基线水平CMR检查 1.2.1 图像采集采用美国GE公司1.5 T Twin-speed Infinity with Excite Ⅱ超导型磁共振扫描仪,8通道心脏相控阵线圈,呼吸和心电门控。采用二维快速稳态进动采集(fast imaging employing steady-state acquisition,FIESTA)序列,获取左心室二腔心、四腔心及短轴位CMR电影图像。短轴位电影成像参数为:重复时间(repetition time,TR)/回波时间(echo time,TE)为min full/min full,翻转角为45 °,带宽为125 kHz,视野(field of view,FOV)为35 cm × 35 cm,矩阵为224 × 224,扫描层厚为8 mm,层间距为0 mm,激励次数(number of excitation,NEX)为1,获取10 ~ 14层面的图像,每层扫描时相为20个相位[5]。受试者于呼气末屏气,根据心率不同每层影像采集期间需屏气8 ~ 15 s。
1.2.2 图像分析将CMR图像传输至美国GE公司AW 4.3磁共振成像工作站,应用Report Card 3.7软件进行CMR数据分析。在短轴位FIESTA电影图像上进行左心室、右心室功能分析。分别在收缩末期与舒张末期手动描记所有层面左心室、右心室心内膜与心外膜轮廓,其中右心室容积包括右室流出道部分;乳头肌及肌小梁记为心室腔的一部分,其质量不计入心肌质量。用软件自动计算左心室、右心室舒张末期容积(end-diastolic volume,EDV)、收缩末期容积(end-systolic volume,ESV)、每搏输出量(stroke volume,SV)、心输出量(cardiac output,CO)、射血分数(ejection fraction,EF),并计算心肌质量(myocardial mass,MM):MM =(心外膜容积-心内膜容积)× 1.05。上述各指标分别除以相应个体的体表面积(body surface area,BSA)进行标准化,分别记为舒张末期容积指数(end-diastolic volume index,EDVI)、收缩末期容积指数(end-systolic volume index,ESVI)、每搏输出量指数(stroke volume index,SVI)、心指数(cardiac index,CI)、心肌质量指数(myocardial mass index,MMI)。BSA计算公式:BSA(m2)= 0.006 1 ×身高(cm)+ 0.012 8 ×体质量(kg)- 0.152 9。计算心室质量指数(ventricular mass index,VMI),VMI =舒张末期右心室MM/舒张末期左心室MM。在标准四腔心电影图像上,于右心室收缩末期及舒张末期分别测量右房室瓣环至心尖的距离,二者之差为右房室瓣环收缩期位移(tricuspid annular plane systolic excursion,TAPSE)[6],见图 1。

|
图 1 TAPSE测量方法 Fig 1 Measurement of tricuspid annular plane systolic excursion (TAPSE) Tricuspid annular systolic excursion, a measurement of longitudinal shortening of the right ventricle, is the distance from base of the tricuspid annulus to the ventricular apex in the middle views of 4-chamber heart end-systole (A, C) and end-diastole (B, D). The distance difference between end-diastole and end-systole is TAPSE. The patient in the major adverse cardiovascular event (MACE) group has a TAPSE of 8.5 cm (A, B), and the one in the non-MACE group has a TAPSE of 22.5 cm (C, D) |
1.3 统计学处理
采用SPSS 22.0软件进行数据处理与统计学分析。呈正态分布的计量资料以x±s表示,两组间比较采用两独立样本t检验;计数资料以例数和百分数表示,两组间比较采用(校正)χ2检验或Fisher确切概率法。对于单因素分析结果中P<0.05的参数,采用Cox比例风险回归模型进行多因素分析(向前LR法)以确定终点事件的独立预测因素。经受试者工作特征(receiver operating characteristic,ROC)曲线分析,计算约登指数(Youden index)寻找多因素Cox回归分析差异有统计学意义的参数预测其判断预后的最佳截断值。采用Kaplan-Meier法对不同水平观察指标的患者进行生存分析。检验水准(α)为0.05。
2 结果 2.1 MACE组与non-MACE组患者一般临床资料与RHC检查结果本组90例PH患者,随访时间为(46.5 ± 22.6)个月。发生MACE者21例,未发生MACE者69例。两组患者的人口统计学信息、世界卫生组织心功能分级、PH类型差异均无统计学意义(P均>0.05),RHC检查结果示MACE组患者sPAP、mPAP、PVR均高于non-MACE组,差异均有统计学意义(t=- 2.595、- 2.173、- 2.985,P= 0.011、0.032、0.002)。见表 1。
|
|
表 1 MACE组与non-MACE组PH患者基本资料及RHC测量结果 Tab 1 Demography and RHC measurements of PH patients in MACE and non-MACE groups |
2.2 MACE组与non-MACE组CMR心功能参数比较
见表 2,与non-MACE组相比,MACE组右心室EF、左心室SVI和MM、TAPSE均降低,差异均有统计学意义(t=- 2.065、- 2.286、- 2.286、- 2.089,P= 0.042、0.025、0.025、0.040);右心室EDVI、ESVI均升高,差异均有统计学意义(t= 2.076、2.668,P= 0.041、0.009)。提示MACE组PH患者左、右心功能均更差。
|
|
表 2 MACE组及non-MACE组PH患者CMR心功能参数比较 Tab 2 Comparison of CMR cardiac function parameters of PH patients between MACE and non-MACE groups |
2.3 Cox比例风险回归分析结果
将单因素分析结果P<0.05的参数(右心室EF、EDVI、ESVI,左心室SVI、MM,以及TAPSE)进一步纳入Cox比例风险回归模型,采用向前LR法进行多因素分析,结果(表 3)示左心室SVI及TAPSE是PH患者发生MACE的独立预测因素[风险比(hazard ratio,HR)= 0.942、0.904,P= 0.039、0.022)。
|
|
表 3 90例PH患者MACE的多因素Cox回归分析 Tab 3 Multivariate Cox regression analysis of MACE in 90 PH patients |
2.4 生存曲线分析
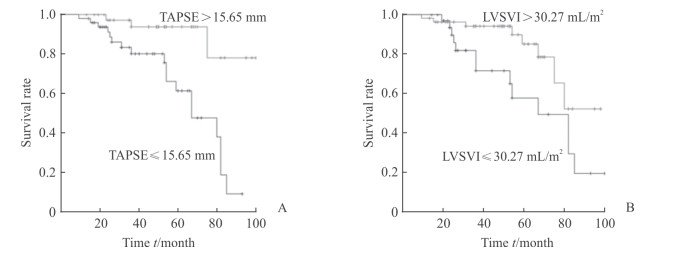
使用“是否发生MACE”作为诊断标准对TAPSE及左心室SVI 2个参数绘制ROC曲线,根据ROC曲线确定的最佳截断值(表 4)进行分组,并绘制Kaplan-Meier生存曲线(图 2),结果显示当左心室SVI ≤ 30.27 mL/m2、TAPSE ≤ 15.65 mm时PH患者MACE发生率增加(P= 0.001、0.019)。
|
|
表 4 90例PH患者MACE的ROC曲线分析 Tab 4 ROC curve analysis of MACE in 90 PH patients |
|
图 2 基于TAPSE(A)、LVSVI(B)的PH患者的Kaplan-Meier生存曲线 Fig 2 Kaplan-Meier survival curves for PH patients based on TAPSE (A) and LVSVI (B) A: Patients with TAPSE>15.65 mm have better survival than patients with TAPSE≤15.65 mm; B: Patients with LVSVI>30.27 mL/m2 have better survival than patients with LVSVI≤30.27 mL/m2. TAPSE: Tricuspid annular plane systolic excursion; LVSVI: Left ventricular stroke volume index; PH: Pulmonary hypertension |
3 讨论
本研究应用CMR探究PH患者心功能状态与预后的关系。结果显示本组PH患者中,与non-MACE组相比,发生MACE的21例患者的RHC检查指标sPAP、mPAP、PVR均升高,CMR心功能参数右心室EDVI、ESVI均升高,右心室EF、TAPSE、左心室SVI均降低。多因素Cox回归分析和生存分析提示TAPSE和左心室SVI可作为PH患者预后的独立预测因素。
PH为肺血管增生及重构导致肺循环压力增高的疾病。正常的右心室呈新月形,随着肺循环压力及肺血管阻力增高,右心室后负荷逐渐增加,导致右心室重构、右心室心肌代偿性肥厚。随着病程进展,后负荷进一步增加,右心功能失代偿,右心室逐渐扩大呈球形,从而右心室射血量减少,最终导致右心衰竭[1]。本研究结果示MACE组sPAP、mPAP及PVR均升高,右心功能参数EF和TAPSE均下降,右心室容积参数EDVI和ESVI均增加,提示PH可引起严重的右心功能不全。这与既往文献结论[7-8]一致。由于左心室、右心室共享室间隔且两心室均受限于心包,随着右心室扩张在舒张早期室间隔向左弓形突出(leftward ventricular septal bowing,LVSB),致使左心室容积减小、左心室舒张功能降低[9],从而使左心室SVI降低。同时,左心室充盈受限使左心室萎缩性重构,亦导致左心室MM减小[10]。另外,右心衰竭患者左心室MM降低也可能与左心室心肌间质水肿有关[10]。也有研究认为,右心室EF是预测PH患者预后的可靠参数[11],而本研究结果显示右心室EF在MACE组和non-MACE组间差异虽有统计学意义,但不是PH患者预后的独立预测因素。其原因可能是:(1)本研究纳入患者样本量小且两组研究对象处于PH不同的发展阶段;(2)本研究MACE组与non-MACE组患者右心功能均较差,两组患者右心室EF差异较小。随着肺动脉压的增高,右心室早期处于代偿性肥厚阶段,若此时进行干预降低肺动脉压,患者预后较好;晚期失代偿右心扩张致使右心运动能力减弱,最终室间隔左偏、双心室功能均降低,甚至发生心力衰竭或患者死亡。CMR作为一种无创、无辐射且准确的影像手段,能实时监测心功能,在PH患者的预后判断及随访中至关重要。
右心室独特的解剖结构及收缩机制使TAPSE成为评估右心室功能的重要指标[12]。Rushmer等[13]研究发现右心室的收缩主要是沿心室基底部至心尖的纵轴方向,右心室纵向收缩是右心室射血的主要动力。PH病程早期即发生右心室收缩功能障碍、射血能力降低[14]。研究表明在收缩期,心脏的纵向缩短能力是影响右心室SV的重要因素,而非周向缩短[15]。与心功能的容积参数相比,TAPSE易测量、可重复性强,因此其为反映右心室长轴收缩功能可靠且简便的指标。此外,收缩期局部心肌缩短程度与心肌纤维排列方向有关。在右心衰竭晚期,心肌纤维纵向收缩能力显著降低[16],因此TAPSE降低与右心功能障碍密切相关,而右心功能受损的程度与预后有很强的相关性[17]。
先前的研究指出UCG测得的TAPSE能反映PH患者的右心功能且与患者预后相关。当TAPSE<18 mm时,右心室收缩能力更差,死亡风险是TAPSE≥18 mm时的5.7倍,TAPSE每减少1 mm死亡风险增加17%,TAPSE<15 mm时预后更差[17]。Corona-Villalobos等[6]的研究结果指出经CMR测得的TAPSE<18 mm可作为预测不良事件的截断值。另外,还有研究表明CMR测得的TAPSE<15 mm可预测严重的右心功能障碍[18]。本研究结果提示TAPSE≤15.65 mm是PH患者发生MACE的独立预测因素,其截断值较部分前期研究数值更小。可能原因是:(1)入组患者构成不同,本研究病例病情重、病程长,MACE组与non-MACE组右心室EF分别为(27.00±9.92)%、(32.68±11.34)%,均已达到右心功能障碍的标准(右心室EF<40%);(2)本研究PH患者左心收缩功能亦较差,左、右心之间存在收缩期心室间相互作用,左心收缩功能降低对右心收缩功能的改变起重要作用。另外,右心室插入部(right ventricular insertion portion,RVIP)同时受到右心室纵向缩短和左心室周向缩短产生的机械应力的影响[19],右心室纵向缩短能力降低使RVIP心肌细胞易发生排列紊乱、纤维化,进一步加重右心收缩功能受损,加速PH恶性进展,从而使预后更差。此外,右心室应对PVR升高的能力是患者预后的关键,而TAPSE与右心室后负荷关系密切。一项关于系统性硬化症导致PH患者的研究发现,当TAPSE<1.7 cm时PVR明显升高[12],即TAPSE与右心室后负荷呈明显负相关,因此TAPSE是PH患者预后的独立预测因素。总之,使用CMR和UCG测量的TAPSE都可以预测PH患者预后,CMR的优势在于对操作者依赖性小并可对右心室形态、功能进行更可靠的评估。
本研究结果示,左心室SVI≤30.27 mL/m2是PH患者预后的另一个独立预测因素,提示PH患者随着病情的进展会发生左心功能受损。PH患者早期右心室收缩功能降低,使得从右心室射入肺循环的血量减少,因此回流至左心室的血量减少,从而左心室前负荷减低,最终导致左心室SVI降低[20]。另一方面,随着右心压力的增高,室间隔形态发生改变,由正常时的向右膨出逐渐变平最终凸向左心室[8],导致左心室腔减小。同时,右心室明显扩张导致心包顺应性降低、左心室侧壁及下壁舒张受限,使得左心室舒张末期容积减小、心室充盈水平下降,最终亦导致左心室SVI降低[21]。Knight等[22]研究发现PH患者左心室舒张功能改变是心功能恶化的独立预测因素,其可能机制是PH本身会导致左心室重构或心肌纤维化。
PH按病因不同分为五大类,每一类的病理生理发展过程并不完全一致。一项关于3种结缔组织病(connective tissue disease,CTD)相关PH患者预后的研究发现,系统性硬化症相关PH患者的预后最差,其次是干燥综合征相关PH患者,系统性红斑狼疮相关PH患者的预后最好[23]。研究指出,与其他CTD相关PH及特发性肺动脉高压(idiopathic pulmonary arterial hypertension,IPAH)相比,系统性硬化症相关PH患者的预后更差[24],具体机制尚不清楚,可能的原因是系统性硬化症相关PH患者的心肌由于炎症、纤维化、缺血反应造成心脏的“原发”受累,而CTD相关PH及IPAH患者心脏受累则是肺血管压力增高导致的“继发”改变[25]。本研究入组的PH患者包括第一类PH,其中IPAH 14例,先天性心脏病相关PH 13例,CTD相关PH 42例,第四类CTEPH 18例,以及第五类原因不明的多因素PH 3例,因每组患者例数分布不均衡,后期需进一步扩大样本量对不同病因PH患者进行分组讨论。
本研究也存在局限性。首先,作为单中心研究,样本量小,并且入组的患者大部分已属晚期PH,心功能较差。其次,发生MACE的人群中57%为CTD相关PH患者,而且患者个体治疗的差异较大,因此,TAPSE预测PH患者预后是否能广泛应用仍需进一步研究,对于CMR和UCG测量TAPSE的一致性也有待于进一步比较研究。最后,本研究只测量了右心室心肌纵向缩短的变化指标TAPSE,未来需纳入心肌横向缩短变化的指标,如右心室心肌径向应变及应变率等指标。
综上所述,CMR是一种准确、无创评估PH患者心功能和监测预后的有效检查方法。右心室EF、EDVI、ESVI,左心室SVI、MM,以及TAPSE等CMR指标与PH患者发生MACE密切相关,特别是TAPSE、左心室SVI对预测PH患者发生MACE具有重要价值。
| [1] |
PEÑA E, DENNIE C, VEINOT J, MUÑIZ S H. Pulmonary hypertension:how the radiologist can help[J]. Radiographics, 2012, 32: 9-32. DOI:10.1148/rg.321105232 |
| [2] |
ZHANG Z, WANG M, YANG Z, YANG F, LI D, YU T, et al. Noninvasive prediction of pulmonary artery pressure and vascular resistance by using cardiac magnetic resonance indices[J]. Int J Cardiol, 2017, 227: 915-922. DOI:10.1016/j.ijcard.2016.10.068 |
| [3] |
VAN DE VEERDONK M C, KIND T, MARCUS J T, MAURITZ G J, HEYMANS M W, BOGAARD H J, et al. Progressive right ventricular dysfunction in patients with pulmonary arterial hypertension responding to therapy[J]. J Am Coll Cardiol, 2011, 58: 2511-2519. DOI:10.1016/j.jacc.2011.06.068 |
| [4] |
GALIÈ N, HUMBERT M, VACHIERY J L, GIBBS S, LANG I, TORBICKI A, et al. 2015 ESC/ERS guidelines for the diagnosis and treatment of pulmonary hypertension:the Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS):endorsed by:Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT)[J]. Eur Heart J, 2016, 37: 67-119. DOI:10.1093/eurheartj/ehv317 |
| [5] |
杨帆, 李东, 杨振文, 张璋, 王丹, 于铁链. 基于CMR的肺动脉径线测量评价肺高血压的临床实用价值[J]. 中国肺癌杂志, 2017, 20: 93-99. DOI:10.3779/j.issn.1009-3419.2017.02.10 |
| [6] |
CORONA-VILLALOBOS C P, KAMEL I R, RASTEGAR N, DAMICO R, KOLB T M, BOYCE D M, et al. Bidimensional measurements of right ventricular function for prediction of survival in patients with pulmonary hypertension:comparison of reproducibility and time of analysis with volumetric cardiac magnetic resonance imaging analysis[J]. Pulm Circ, 2015, 5: 527-537. DOI:10.1086/682229 |
| [7] |
NOGUCHI A, KATO M, KONO M, OHMURA K, OHIRA H, TSUJINO I, et al. Bi-ventricular interplay in patients with systemic sclerosis-associated pulmonary arterial hypertension:detection by cardiac magnetic resonance[J]. Mod Rheumatol, 2017, 27: 481-488. DOI:10.1080/14397595.2016.1218597 |
| [8] |
LURZ P, PURANIK R, NORDMEYER J, MUTHURANGU V, HANSEN M S, SCHIEVANO S, et al. Improvement in left ventricular filling properties after relief of right ventricle to pulmonary artery conduit obstruction:contribution of septal motion and interventricular mechanical delay[J]. Eur Heart J, 2009, 30: 2266-2274. DOI:10.1093/eurheartj/ehp258 |
| [9] |
PALAU-CABALLERO G, WALMSLEY J, VAN EMPEL V, LUMENS J, DELHAAS T. Why septal motion is a marker of right ventricular failure in pulmonary arterial hypertension:mechanistic analysis using a computer model[J]. Am J Physiol Heart Circ Physiol, 2017, 312: H691-H700. DOI:10.1152/ajpheart.00596.2016 |
| [10] |
HARDZIYENKA M, CAMPIAN M E, REESINK H J, SURIE S, BOUMA B J, GROENINK M, et al. Right ventricular failure following chronic pressure overload is associated with reduction in left ventricular mass:evidence for atrophic remodeling[J]. J Am Coll Cardiol, 2011, 57: 921-928. DOI:10.1016/j.jacc.2010.08.648 |
| [11] |
MURATA M, TSUGU T, KAWAKAMI T, KATAOKA M, MINAKATA Y, ENDO J, et al. Prognostic value of three-dimensional echocardiographic right ventricular ejection fraction in patients with pulmonary arterial hypertension[J]. Oncotarget, 2016, 7: 86781-86790. |
| [12] |
MATHAI S C, SIBLEY C T, FORFIA P R, MUDD J O, FISHER M R, TEDFORD R J, et al. Tricuspid annular plane systolic excursion is a robust outcome measure in systemic sclerosis-associated pulmonary arterial hypertension[J]. J Rheumatol, 2011, 38: 2410-2418. DOI:10.3899/jrheum.110512 |
| [13] |
RUSHMER R F, CRYSTAL D K, WAGNER C. The functional anatomy of ventricular contraction[J]. Circ Res, 1953, 1: 162-170. DOI:10.1161/01.RES.1.2.162 |
| [14] |
GHIO S, KLERSY C, MAGRINI G, D'ARMINI A M, SCELSI L, RAINERI C, et al. Prognostic relevance of the echocardiographic assessment of right ventricular function in patients with idiopathic pulmonary arterial hypertension[J]. Int J Cardiol, 2010, 140: 272-278. DOI:10.1016/j.ijcard.2008.11.051 |
| [15] |
CARLSSON M, UGANDER M, HEIBERG E, ARHEDEN H. The quantitative relationship between longitudinal and radial function in left, right, and total heart pumping in humans[J]. Am J Physiol Heart Circ Physiol, 2007, 293: H636-H644. DOI:10.1152/ajpheart.01376.2006 |
| [16] |
LI Y, WANG Y, YANG Y, LIU M, MENG X, SHI Y, et al. Tricuspid annular displacement measured by 2-dimensional speckle tracking echocardiography for predicting right ventricular function in pulmonary hypertension: a new approach to evaluating right ventricle dysfunction[J/OL]. Medicine (Baltimore), 2018, 97: e11710. doi: 10.1097/MD.0000000000011710.
|
| [17] |
FORFIA P R, FISHER M R, MATHAI S C, HOUSTEN-HARRIS T, HEMNES A R, BORLAUG B A, et al. Tricuspid annular displacement predicts survival in pulmonary hypertension[J]. Am J Respir Crit Care Med, 2006, 174: 1034-1041. DOI:10.1164/rccm.200604-547OC |
| [18] |
HOETTE S, CREUZÉ N, GÜNTHER S, MONTANI D, SAVALE L, JAÏS X, et al. RV fractional area change and TAPSE as predictors of severe right ventricular dysfunction in pulmonary hypertension:a CMR study[J]. Lung, 2018, 196: 157-164. DOI:10.1007/s00408-018-0089-7 |
| [19] |
HO S Y, NIHOYANNOPOULOS P. Anatomy, echocardiography, and normal right ventricular dimensions[J]. Heart, 2006, 92(Suppl 1): i2-i13. |
| [20] |
PEACOCK A J, CRAWLEY S, MCLURE L, BLYTH K G, VIZZA C D, POSCIA R, et al. Changes in right ventricular function measured by cardiac magnetic resonance imaging in patients receiving pulmonary arterial hypertension-targeted therapy:the EURO-MR study[J]. Circ Cardiovasc Imaging, 2014, 7: 107-114. DOI:10.1161/CIRCIMAGING.113.000629 |
| [21] |
王丹, 张璋, 杨帆, 张乐, 杨振文, 任雯, 等. 不同室间隔形态肺高血压患者的心室功能特点:CMR初步研究[J]. 中国肺癌杂志, 2018, 21: 397-402. DOI:10.3779/j.issn.1009-3419.2018.05.07 |
| [22] |
KNIGHT D S, STEEDEN J A, MOLEDINA S, JONES A, COGHLAN J G, MUTHURANGU V. Left ventricular diastolic dysfunction in pulmonary hypertension predicts functional capacity and clinical worsening: a tissue phase mapping study[J/OL]. J Cardiovasc Magn Reson, 2015, 17: 116. doi: 10.1186/s12968-015-0220-3.
|
| [23] |
ZHAO J, WANG Q, LIU Y, TIAN Z, GUO X, WANG H, et al. Clinical characteristics and survival of pulmonary arterial hypertension associated with three major connective tissue diseases:a cohort study in China[J]. Int J Cardiol, 2017, 236: 432-437. DOI:10.1016/j.ijcard.2017.01.097 |
| [24] |
CHUNG L, FARBER H W, BENZA R, MILLER D P, PARSONS L, HASSOUN P M, et al. Unique predictors of mortality in patients with pulmonary arterial hypertension associated with systemic sclerosis in the REVEAL registry[J]. Chest, 2014, 146: 1494-1504. DOI:10.1378/chest.13-3014 |
| [25] |
LAMBOVA S. Cardiac manifestations in systemic sclerosis[J]. World J Cardiol, 2014, 6: 993-1005. DOI:10.4330/wjc.v6.i9.993 |
 2019, Vol. 40
2019, Vol. 40


