原发性心肌病是一组原因未明的、以心肌病变为主的心脏疾病,包括遗传性、获得性和混合性心肌病,其中以肥厚型心肌病(hypertrophic cardiomyopathy,HCM)和扩张型心肌病(dilated cardiomyopathy,DCM)最为常见。随着年龄增长,原发性心肌病患者也会同时合并如冠状动脉粥样硬化及心肌梗死等冠状动脉疾病[1]。据报道,45岁以上HCM患者合并冠状动脉粥样硬化性心脏病(以下简称“冠心病”)的检出率为20%左右[2]。而原发性DCM与冠状动脉疾病晚期引起的心力衰竭失代偿在临床及影像学表现上极其相似,二者共存在临床上更是难以诊断[3]。由于原发性心肌病的存在,临床常常忽略了并存的冠状动脉疾病,国内外相关研究以HCM为主,且数量较少。本研究拟基于心脏磁共振成像,探讨针对原发性HCM和DCM患者合并冠心病的发生率及影像学特征。
1 资料和方法 1.1 研究对象回顾性分析我院2015年9月至2018年9月心脏磁共振成像检查确诊的681例各类型原发性心肌病患者的病历资料,筛选同时接受冠状动脉造影或冠状动脉计算机断层扫描血管成像(coronary computed tomography angiography,CCTA)检查的病例。根据临床资料及心脏磁共振成像检查结果确定患者为HCM、DCM及其他类型心肌病,再依据冠状动脉狭窄程度将HCM、DCM患者分别分为冠状动脉正常组、冠状动脉粥样硬化组(冠状动脉狭窄≤ 50%)及冠心病组(冠状动脉狭窄>50%)。本研究经我院伦理委员会审批,所有患者均知情同意。
1.2 磁共振成像检查采用德国西门子医疗系统有限公司Verio 3.0 T磁共振扫描仪和32通道表面相控阵心脏线圈。
1.2.1 扫描方案(1)心脏形态功能。电影图像采用真实稳态自由进动(true fast imaging with steady precession,true-FISP)序列进行采集,扫描范围包含整个左心室在内的左心室短轴、左心室长轴和四腔心层面。主要参数:视野(field of view,FOV)为286 mm × 340 mm,矩阵为216 × 256,重复时间(repetition time,TR)为3.4 ms,回波时间(echo time,TE)为1.7 ms,时间分辨率为40 ms。(2)钆造影剂延迟增强(late gadolinium enhancement,LGE)成像。采用二维相位敏感反转恢复(phase sensitive inversion recovery,PSIR)快速小角度激发(turbo fast low-angle shot,turboFLASH)序列,造影剂为钆喷酸葡胺(马根维显,德国拜耳先灵公司),注射速率为2.0 mL/s,剂量为0.2 mmol/kg,延迟10 ~ 15 min采集两腔心、四腔心和短轴层面。主要参数:FOV为260 mm × 350 mm,矩阵为130 × 256,TR为4.1 ms,TE为1.6 ms,翻转角为20 °,层厚为8 mm,反转时间(inversion time,TI)为300 ms。
1.2.2 心脏形态和功能参数测量载入全部从基底段至心尖段左心室短轴电影图像,选取左心室舒张末期和收缩末期图像,软件自动识别、必要时手动调整左心室心内膜和心外膜边界。软件自动计算并输出心功能参数指标,记录左心室舒张末期心室壁厚度(left ventricular end-diastolic thickness,LVEDTH)、左心室射血分数(left ventricular ejection fraction,LVEF)、左心室舒张末期容积(left ventricular end-diastolic volume,LVEDV)、左心室收缩末期容积(left ventricular end-systolic volume,LVESV)、左心室每搏输出量(left ventricular stroke volume,LVSV)、左心室心输出量(left ventricular cardiac output,LVCO)。
1.2.3 诊断标准原发性心肌病的诊断主要依据心脏磁共振成像检查结果及病史。(1)HCM:舒张末期室间隔壁厚度或LVEDTH ≥ 15 mm,或有明确HCM家族史的患者≥ 13 mm,心脏磁共振成像检查示伴或不伴心肌纤维化改变,并且除外高血压、主动脉瓣狭窄等其他继发性心肌肥厚疾病。(2)DCM:左心室舒张末期内径(left ventricular end-diastolic diameter,LVEDD)>5.0 cm(女)和LVEDD>5.5 cm(男),且LVEF<45%,除外高血压、瓣膜性心脏病或缺血性心脏病。所有诊断均由心内科医师和放射科医师联合诊断得出。
1.3 冠状动脉检查冠状动脉疾病的诊断主要依据最近一次冠状动脉造影或CCTA检查结果及患者病史,并辅以心脏磁共振LGE序列明确诊断。(1)心脏表面冠状动脉单支狭窄>50%,或心脏磁共振成像检查见心内膜下或透壁性延迟强化,且既往实验室检查示心肌坏死血清生物标志物升高,提示有陈旧性心肌梗死病史者,可诊断为冠心病。(2)冠状动脉有狭窄但各支狭窄程度均≤ 50%,且心脏磁共振成像检查未见心内膜下和(或)透壁性延迟强化,诊断为冠状动脉粥样硬化。
对于拟诊断合并冠心病的原发性心肌病患者,为保证原发性心肌病诊断的准确性,需重新进行电话随访,对既往心电图、超声心动图及同位素心肌灌注显像等检查结果进行补充。
1.4 统计学处理采用SPSS 19.0软件进行数据处理。呈正态分布的计量资料以x±s表示,多组间比较采用单因素方差分析,事后两两比较采用Scheffe成对比较检验;计数资料以例数和百分数表示,多组间比较采用χ2检验,事后两两比较采用χ2分割检验。检验水准(α)为0.05,χ2分割检验水准(α)为0.017。
2 结果 2.1 患者一般资料681例心脏磁共振成像检查确诊的各类型原发性心肌病患者中,219例接受冠状动脉造影或CCTA检查,年龄为17 ~ 79(54.9 ± 11.8)岁,其中男147例、女72例;HCM 126例、DCM 78例、其他类型心肌病15例。HCM患者中冠状动脉正常组59例(46.8%)、冠状动脉粥样硬化组40例(31.7%)、冠心病组27例(21.4%);DCM患者中冠状动脉正常组40例(51.3%)、冠状动脉粥样硬化组24例(30.8%)、冠心病组14例(17.9%);其他类型心肌病患者中,限制型心肌病6例、致心律失常性右心室心肌病6例、心肌致密化不全1例和未知心肌病2例,因例数较少未进一步分析。HCM患者冠状动脉粥样硬化及冠心病发生率虽均略高于DCM患者,但差异均无统计学意义(P均>0.05)。HCM患者中明确诊断心肌梗死者7例(5.6%),DCM患者4例(5.1%),两组心肌梗死发生率接近,差异无统计学意义(P>0.05)。41例冠心病患者中,单支病变17例(41.5%),2支病变14例(34.1%),3支病变10例(24.4%),其中8例患者接受了经皮冠状动脉介入治疗。
2.2 HCM患者临床及影像学资料126例HCM患者中,冠状动脉正常组、冠状动脉粥样硬化组、冠心病组患者的平均年龄分别为(49.5 ± 11.0)岁、(59.3 ± 9.5)岁、(62.6 ± 9.8)岁,3组间差异有统计学意义(F= 19.64,P<0.01),进一步两两比较发现,冠心病组及冠状动脉粥样硬化组患者的平均年龄均高于冠状动脉正常组患者(P均<0.01),而冠状动脉粥样硬化组及冠心病组之间差异无统计学意义(P>0.05)。3组男女比例均接近2:1,差异无统计学意义(P>0.05)。冠心病组有≥ 1个心血管危险因素(包括糖尿病、吸烟、高血压、高脂血症、肥胖)的患者占比高于冠状动脉正常组及冠状动脉粥样硬化组(χ2= 12.00,P<0.01;χ2= 6.97,P= 0.008)。心脏磁共振成像检查示3组患者的LVEDTH、流出道梗阻情况及心肌内纤维化检出率均无明显差异(P均>0.05)。左心室功能参数除LVSV外(F= 1.75,P<0.05),其他参数在3组间差异均无统计学意义;两两比较发现冠心病组LVSV低于冠状动脉正常组及冠状动脉粥样硬化组[分别为(50.4 ± 21.1)、(64.6 ± 22.9)、(64.1 ± 27.1)mL],差异均有统计学意义(P均<0.05),而冠状动脉正常组与冠状动脉粥样硬化组之间差异无统计学意义(P>0.05)。见表 1。
|
|
表 1 肥厚型心肌病患者临床及影像学资料 Tab 1 Clinical and imaging data of hypertrophic cardiomyopathy patients |
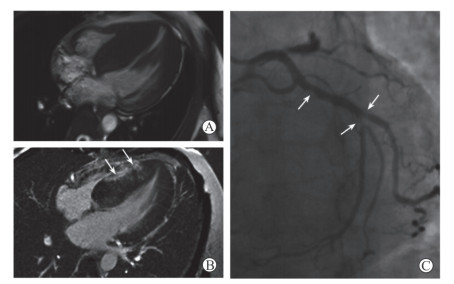
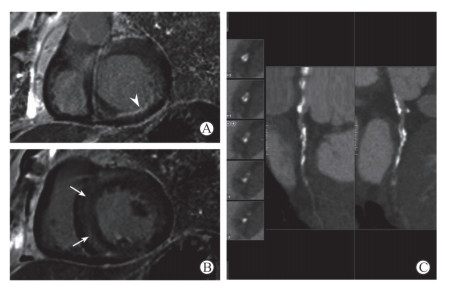
27例HCM合并冠心病(冠心病组)的患者中,心脏磁共振电影序列检查均可见心肌有不同程度增厚,其中5例为心尖肥厚型,左心室心尖呈黑桃A样改变;其余均为以室间隔增厚为主的非对称性HCM,舒张末期室间隔最厚处均超过15 mm。心脏形态上均与一般的HCM无异。LGE序列检出不同类型的延迟强化共21例,其中13例仅在肥厚心肌的中层出现延迟强化,未见心内膜下及透壁性延迟强化(图 1);3例仅在心内膜下出现线样延迟强化,1例呈侧壁透壁性延迟强化,结合相关冠状动脉检查结果,以上4例均符合相应病变冠状动脉的供血区域;另有4例患者在肥厚的心肌内不仅检出延迟强化,也检出了符合相应病变冠状动脉供血区域的心内膜下梗死灶(图 2)。
|
图 1 1例60岁男性肥厚型心肌病合并冠状动脉粥样硬化性心脏病患者的心脏磁共振成像及冠状动脉造影 Fig 1 Cardiac magnetic resonance imaging and coronary angiography in a 60-year-old male patient with hypertrophic cardiomyopathy combined with coronary atherosclerotic heart disease A: The 4-chamber heart view of left ventricular end-diastolic in magnetic resonance cine imaging shows significant asymmetric thickening septal wall, with over 15 mm; B: The 4-chamber heart view in the late gadolinium enhancement sequence shows focal delayed enhancement signals (arrows) in the septal myocardium; C: Coronary angiography shows limited lumen stenosis ≥50% at the opening of diagonal branch and the proximal-middle segment of anterior descending branch (arrows) |
|
图 2 1例65岁男性肥厚型心肌病合并心肌梗死患者的心脏磁共振成像及冠状动脉计算机断层扫描血管成像 Fig 2 Cardiac magnetic resonance imaging and coronary computed tomography angiography in a 65-year-old male patient with hypertrophic cardiomyopathy combined with myocardial infarction A: The basal view of left ventricular short-axis in the late gadolinium enhancement sequence shows subendocardial myocardial infarction in the inferior lateral wall (triangular arrow); B: The middle view of left ventricular short-axis in the late gadolinium enhancement sequence shows schistose delayed enhancement signals (arrows) in the septal myocardium; C: The coronary computed tomography angiography shows the diffusely thickened wall of the left circumflex artery, with calcification and the narrowest lumen ≥50% |
2.3 DCM患者临床及影像学资料
78例DCM患者中,冠状动脉正常组、冠状动脉粥样硬化组、冠心病组患者的平均年龄分别为(49.3 ± 12.9)岁、(58.5 ± 8.8)岁、(60.1 ± 7.2)岁,3组间差异有统计学意义(F= 7.96,P= 0.010),进一步两两比较发现,冠心病组及冠状动脉粥样硬化组患者的平均年龄均高于冠状动脉正常组(P均<0.05),而冠状动脉粥样硬化组及冠心病组之间差异无统计学意义(P>0.05)。冠状动脉粥样硬化组及冠心病组男性患者占比均较冠状动脉正常组增加,但3组间比较差异无统计学意义(P>0.05)。冠心病组有≥ 1个心血管危险因素(包括糖尿病、吸烟、高血压、高脂血症、肥胖)的患者占比高于冠状动脉正常组(χ2= 9.59,P= 0.002),而冠状动脉粥样硬化组与冠状动脉正常组、冠心病组相比差异均无统计学意义(P均>0.017)。心脏磁共振检查显示3组的LVEDD、心肌内纤维化检出率及左心功能参数差异均无统计学意义(P均>0.05)。见表 2。
|
|
表 2 扩张型心肌病患者的临床及影像学资料 Tab 2 Clinical and imaging data of dilated cardiomyopathy patients |
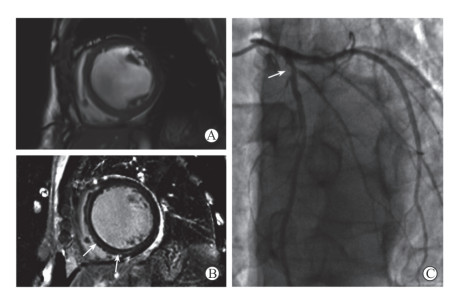
14例DCM合并冠心病(冠心病组)患者心脏磁共振电影序列均可见左心室心腔明显扩张,LVEDTH变薄,平均为(68.0±6.8)mm。其中12例患者于LGE序列中检出存在心肌中层纤维化改变(图 3),余2例心肌未见明确延迟强化。以上14例患者均未见心内膜下或透壁性延迟强化。
|
图 3 1例64岁男性扩张型心肌病合并冠状动脉粥样硬化性心脏病患者的心脏磁共振成像及冠状动脉造影 Fig 3 Cardiac magnetic resonance imaging and coronary angiography in a 64-year-old male patient with dilated cardiomyopathy combined with coronary atherosclerotic heart disease A: The middle view of left ventricular short-axis in magnetic resonance cine imaging shows enlarged left ventricle and evenly thinned wall, with left ventricular end-diastolic diameter > 55 mm; B: The middle view of left ventricular short-axis in the late gadolinium enhancement sequence shows linear delayed enhancement signals (arrows) in the septal myocardium without delayed enhancement signal under the endocardium; C: Coronary angiography shows limited lumen stenosis≥50% at the opening of diagonal branch in the proximal of anterior descending branch (arrow) |
3 讨论
本研究结果显示,不同类型的原发性心肌病患者中冠状动脉粥样硬化及冠心病发生率较高。已有研究表明HCM患者冠心病的发生率约为20%[4],与本研究结果相似。因缺血性心肌病引起的继发性DCM改变与原发性DCM影像学表现极其相似,产生与原发性DCM类似的临床综合征,原发性DCM合并冠心病的诊断难以明确,国内外均未见相关研究报道。本研究14例DCM合并冠心病患者的诊断经过严格的随访及筛选,均有长期明确的DCM病史,其中12例心脏磁共振成像检查均发现典型室间隔心肌中层线样延迟强化改变;其余2例均有近10年的DCM病史,故诊断明确,冠状动脉检查均为前降支病变,单支狭窄>50%,心脏磁共振检查均未见异常梗死或缺血心肌,故原发性DCM合并冠心病的诊断较为可靠。DCM组冠状动脉粥样硬化及冠心病发生率均接近HCM组,两种类型心肌病心肌梗死发生率均在5%左右。DCM合并冠心病再发心肌梗死的研究国内仅有个案报道[5]。
两种类型心肌病患者均以男性为主,男性占比均达60%以上,但各亚组间男女比例并无明显差异,说明性别对原发性心肌病患者发生冠状动脉疾病的影响并不显著。与国内既往报道[6]略有差异,这可能与冠心病的诊断标准稍有不同有关。年龄与心血管危险因素是心肌病患者发生冠状动脉疾病的重要危险因素。本研究纳入的心肌病患者中,冠心病组的平均年龄约为60岁,高于冠状动脉正常组,验证了年龄对冠状动脉心脏病的影响与所患心肌病种类无关,是相对独立的危险因素。合并有糖尿病、吸烟、高血压、高脂血症或肥胖等心血管危险因素的原发性心肌病患者,更易并发冠状动脉疾病。故老年原发性心肌病同时存在1个及以上心血管危险因素时,应注意合并冠心病的可能。
心脏磁共振成像可以对心脏的形态和功能进行全面评估,对HCM、DCM、限制型心肌病及致心律失常性右心室心肌病等多种原发性心肌病的诊断及鉴别诊断具有一定价值。虽然单纯依靠常规的磁共振成像检查不能明确冠状动脉的狭窄情况,但LGE序列可以发现梗死的心肌组织,在一定程度上也有助于原发性心肌病合并冠心病的诊断。
对于HCM的诊断,磁共振检查不仅可以准确显示心肌肥厚的部位及程度,还可以评估流出道的梗阻情况。与缺血性心肌病延迟强化多见于心内膜下不同,HCM的延迟强化多见于肥厚心肌的中层,尤其是室间隔与右心室游离壁交界处的心肌。因此,当肥厚的心肌同时合并心内膜下或透壁性延迟强化时,还需要结合相关的冠状动脉检查及临床病史,考虑HCM合并冠心病的可能。而对DCM的诊断,一般认为心肌延迟强化的方式同样有助于缺血性心肌扩张和非缺血性心肌扩张的鉴别诊断。DCM多表现为心肌中层线状或弥漫透壁性延迟强化,这种透壁性的延迟强化不能用冠状动脉供血区域来解释[7]。当DCM合并冠心病时,理论上也可以出现符合冠状动脉供血区域心肌的延迟强化,与单纯缺血性心肌扩张的磁共振成像特征十分相似,此时鉴别诊断的重点主要在于心脏的扩张是发生在出现冠状动脉疾病之前还是之后,同时也需要结合相关的冠状动脉检查及临床病史才能明确诊断。遗憾的是,本研究的14例DCM合并冠心病患者均未出现心内膜下或透壁性延迟强化,这可能与在对DMC诊断入组过于严格,排除了部分出现类似上述缺血性心肌扩张表现,而临床病史及相关检查不够全面难以明确诊断的病例有关。
超声心动图可以发现心肌肥厚及心室扩张,有助于心肌病的诊断,但不能发现冠状动脉病变;冠状动脉造影检查可用于评价冠状动脉病变的有无、严重程度和病变范围,是目前冠状动脉检查的“金标准”,但不能诊断原发性心肌病。有研究报道,一站式心脏计算机断层扫描检查有助于HCM可疑合并冠心病患者的鉴别诊断[8]。而对于DCM患者尚无类似报道。
原发性HCM和DCM合并冠心病患者均有较高的心肌梗死发生率(均在5%左右),可能是由于心肌病患者本身就存在冠状动脉微血管功能障碍[9]。微血管功能障碍是HCM与DCM的共同特征,反映了包括小动脉密度降低、心肌纤维化、心肌细胞紊乱和左心室舒张末期压力升高在内的多种机制的相互作用[10-11]。在这种情况下,即使没有明显的心外膜冠状动脉狭窄,也容易引起心肌缺血,这是由于高心室壁应力和供氧减少造成的[12]。
随着现代医疗技术的发展,各类原发性心肌病患者的预后及生存率较之前有了很大提高,同样的合并冠状动脉疾病的风险也随着年龄的增长而增加[13]。由于原发性心肌病在合并冠状动脉疾病后,磁共振成像的特点及心功能参数改变较为有限,临床上也容易因原发性心肌病的诊断而忽视了患者冠状动脉的情况。原发性心肌病患者是否合并冠状动脉疾病对于治疗方案的制定至关重要[13-14]。因此,无论何种原发性心肌病,临床上都应重视对患者冠状动脉的检查,治疗方案上也应考虑患者的冠状动脉因素。
| [1] |
KUBO T, KITAOKA H, OKAWA M, NISHINAGA M, DOI Y L. Hypertrophic cardiomyopathy in the elderly[J]. Geriatr Gerontol Int, 2010, 10: 9-16. DOI:10.1111/ggi.2010.10.issue-1 |
| [2] |
MCKENNA W L, DEANFIELD J, FARUQUI A, ENGLAND D, OAKLEY C, GOODWIN J. Prognosis in hypertrophic cardiomyopathy:role of age and clinical, electrocardiographic and hemodynamic features[J]. Am J Cardiol, 1981, 47: 532-538. DOI:10.1016/0002-9149(81)90535-X |
| [3] |
杨英珍, 王齐兵. 扩张型心肌病的诊断和治疗研究进展[J]. 中华心血管病杂志, 2003, 31: 645-649. DOI:10.3760/j:issn:0253-3758.2003.09.002 |
| [4] |
颜彦, 朱文青, 严卫, 王齐兵, 钱菊英, 刘少稳, 等. 肥厚型心肌病合并冠心病的临床意义[J]. 复旦学报(医学版), 2007, 34: 706-708. DOI:10.3969/j.issn.1672-8467.2007.05.015 |
| [5] |
牛保松. 扩张型心肌病合并冠心病再发心肌梗死[J]. 中国社区医师(医学专业), 2011, 13: 29. |
| [6] |
姜腾勇, 韩智红, 吴学思, 马长生, 吕树铮, 康俊萍, 等. 肥厚型心肌病合并冠心病的诊断[J]. 中华心血管病杂志, 2004, 32: 822-824. DOI:10.3760/j:issn:0253-3758.2004.09.016 |
| [7] |
中华医学会心血管病学分会, 中国医师协会心血管内科医师分会, 中华心血管病杂志编辑委员会. 心肌病磁共振成像临床应用中国专家共识[J]. 中华心血管病杂志, 2015, 43: 673-681. DOI:10.3760/cma.j.issn.0253-3758.2015.08.007 |
| [8] |
马晓海, 赵蕾, 范占明, 葛海龙, 张臣, 李宁. 心脏CT检查对肥厚型心肌病合并冠心病患者的诊断价值[J]. 心肺血管病杂志, 2014, 33: 624-627. DOI:10.3969/j.issn.1007-5062.2014.05.002 |
| [9] |
FEHER A, SINUSAS A J. Quantitative assessment of coronary microvascular function: dynamic SPECT, PET, ultrasound, CT and MR imaging[J/OL]. Circ Cardiovasc Imaging, 2017, 10: e006427. doi: 10.1161/CIRCIMAGING.117.006427.
|
| [10] |
CECCHI F, OLIVOTTO I, GISTRI R, LORENZONI R, CHIRIATTI G, CAMICI P G. Coronary microvascular dysfunction and prognosis in hypertrophic cardiomyopathy[J]. N Engl J Med, 2003, 349: 1027-1035. DOI:10.1056/NEJMoa025050 |
| [11] |
DJORDJEVIC DIKIC A, NIKCEVIC G, RASPOPOVIC S, JOVANOVIC V, TESIC M, BELESLIN B, et al. Prognostic role of coronary flow reserve for left ventricular functional improvement after cardiac resynchronization therapy in patients with dilated cardiomyopathy[J]. Eur Heart J Cardiovasc Imaging, 2014, 15: 1344-1349. DOI:10.1093/ehjci/jeu136 |
| [12] |
SKALIDIS E I, KOCHIADAKIS G E, KOUKORAKI S I, PARTHENAKIS F I, KARKAVITSAS N S, VARDAS P E. Phasic coronary flow pattern and flow reserve in patients with left bundle branch block and normal coronary arteries[J]. J Am Coll Cardiol, 1999, 33: 1338-1346. DOI:10.1016/S0735-1097(98)00698-6 |
| [13] |
GERSH B J, MARON B J, BONOW R O, DEARANI J A, FIFER M A, LINK M S, et al. 2011 ACCF/AHA guideline for the diagnosis and treatment of hypertrophic cardiomyopathy:executive summary:a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines[J]. J Am Coll Cardiol, 2011, 58: 2703-2738. DOI:10.1016/j.jacc.2011.10.825 |
| [14] |
YANCY C W, JESSUP M, BOZKURT B, BUTLER J, JR C D, COLVIN M M, et al. 2016 ACC/AHA/HFSA focused update on new pharmacological therapy for heart failure:an update of the 2013 ACCF/AHA guideline for the management of heart failure:a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Failure Society of America[J]. J Am Coll Cardiol, 2016, 68: 1476-1488. DOI:10.1016/j.jacc.2016.05.011 |
 2019, Vol. 40
2019, Vol. 40


