慢性胰腺炎(chronic pancreatitis,CP)是一种慢性不可逆性疾病,以胰腺实质破坏、炎症细胞浸润及广泛纤维化为主要特征,最终引起胰腺内分泌和外分泌功能不足,严重影响患者的生命质量[1]。胰腺星形细胞(pancreatic stellate cell,PSC)的发现及其分离培养方法的建立,在很大程度上推动了胰腺纤维化的研究进展[2]。骨桥蛋白(osteopontin,OPN)也被称为分泌型酸蛋白1,广泛表达于人体平滑肌细胞、内皮细胞及骨组织细胞等,参与骨组织矿化与重建。在炎症、肿瘤、免疫性疾病及纤维化疾病等病理状态下,OPN出现异常表达[3-6];研究还发现OPN在心肌纤维化、肾间质纤维化及肝硬化中扮演重要角色[7-9]。OPN能激活肝星形细胞,使其过表达α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)及Ⅰ型胶原蛋白(collagen protein Ⅰ,col Ⅰ),并促进肝星形细胞的增殖、迁移及趋化活性,基因剔除OPN表达可减轻四氯化碳、硫代乙酰胺所致的慢性肝损伤及肝纤维化程度[9]。2002年Nakamura等[10]发现OPN在大多数CP患者胰腺组织中表达,特别是有钙化或结石的患者,推测OPN与CP患者发生钙化或结石密切相关。本课题组前期在大鼠CP模型中发现OPN在纤维化的胰腺组织中过表达,并与胰腺纤维化程度呈正相关[11]。本研究旨在探讨OPN对PSC的影响及其可能的机制。
1 材料和方法 1.1 OPN慢病毒过表达载体(OPN-O/E)的构建与验证靶向OPN的慢病毒过表达载体引物序列:上游引物5′-ACT GTC GGG ATC AAC ATG AGA ATT GCA GTG ATT TG-3′,下游引物5′-AAC CAC TTT GTA CAA TTA ATT GAC CTC AGA AGA TG-3′;OPN-O/E购自上海亚载生物科技有限公司。构建步骤简述如下:通过软件设计OPN-O/E引物;以PCR法获取OPN过表达片段;然后进行载体酶切,载体为pLX304-Blast-V5载体,内切酶为Sac Ⅰ和Nhe Ⅰ;酶切载体胶回收,采用LIC连接酶方法连接载体与片段;挑取重组阳性克隆行PCR及测序鉴定;OPN-O/E慢病毒质粒用Lipofectamine 2000(美国Invitrogen Life Technologies公司)转染293T细胞(上海亚载生物科技有限公司),转染72 h后收集培养液上清过滤浓缩;最后测定浓缩液病毒的滴度。阴性对照(OPN-control)也采用同样的方法构建。PSC为HPaSteC细胞系,购自美国Sciencell公司,由海军军医大学(第二军医大学)长海医院消化内科实验室保存,常规培养、传代。取对数生长期的PSC,以每瓶1.5×105个细胞接种于细胞培养瓶中,培养24 h后分为OPN-O/E组及对照组。在培养液中加入病毒原液(感染复数为50)及聚凝胺(8 μg/mL左右,上海亚载生物科技有限公司),轻轻混匀后加入对应细胞培养瓶中,24 h后更换完全培养液;转染48 h后观察荧光表达,并收集细胞提取RNA进行验证。用TRIzol试剂(美国Invitrogen Life Technologies公司)提取总RNA,采用反转录试剂盒(美国Fermentas公司)反转录获得cDNA,应用实时荧光定量PCR法检测OPN-O/E组及对照组OPN mRNA水平。引物序列由上海亚载生物科技有限公司合成,OPN上游引物:5′-GAA GTT TCG CAG ACC TGA CAT-3′,下游引物:5′-GTA TGC ACC ATT CAA CTC CTCG-3′;GAPDH(内参照)上游引物:5′-GGA GCG AGA TCC CTC CAA AAT-3′,下游引物:5′-GGC TGT TGT CAT ACT TCT CAT GG-3′。PCR反应条件:95 ℃ 3 min,95 ℃ 7 s、57 ℃ 10 s、72 ℃ 15 s 45个循环。经仪器自带软件获取Ct值,以对照组表达量为1,通过公式2-ΔΔCt计算OPN mRNA的相对表达量。
1.2 细胞增殖活性检测采用CCK-8试剂盒(美国BBI Life Sciences公司)进行。用多聚赖氨酸(美国Sciencell公司)处理96孔板,将PSC铺进96孔板内,每孔约3 000个细胞,次日进行慢病毒转染,转染48 h后更换培养液,同时在OPN-O/E组及对照组每孔加入10 μL CCK-8试剂,在37 ℃细胞培养箱中避光孵育1 h,用酶标仪检测各组450 nm波长处的光密度值。
1.3 细胞趋化活性检测用多聚赖氨酸处理Transwell小室(美国Corning公司,货号354480)。将OPN-O/E组及对照组细胞消化,离心去上清后加入无血清培养液重悬,将细胞密度调至1×106/mL,取200 μL细胞悬液加入小室上层,下层加入完全培养液,放回培养箱。24 h后取出小室,用PBS清洗后加入4%甲醛固定30 min,用结晶紫染色30 min,磷酸盐缓冲液清洗后用棉签擦除上室内多余的细胞,随机选5个100倍视野拍照计数。
1.4 蛋白质印迹法检测收集细胞加入裂解液及蛋白酶抑制剂,提取总蛋白,用BCA法测定蛋白质浓度(BCA试剂盒购于上海碧云天公司)。取50 μg蛋白行常规蛋白质印迹分析,最后用ECL化学发光法显影(ECL显影液购于美国Millipore公司),采用ImageJ软件计算灰度值,以各组目的蛋白与Tubulin(内参照)灰度值的比值作为目的蛋白的相对表达量。独立实验重复3次。OPN抗体(稀释比例为1:1 000)、α-SMA抗体(1:300)均购自英国Abcam公司,Tubulin抗体(1:5000)购自上海亚载生物科技有限公司、PI3KC抗体(1:1 000)、p-PI3KC抗体(1:1 000)、Akt抗体(1:1 000)、p-Akt抗体(1:1 000)均购自美国CST公司,辣根过氧化物酶标记二抗(1:5 000)购自英国Abcam公司,Akt抑制剂LY294002(10 μmol/L、50 μmol/L)购自美国CST公司。
1.5 统计学处理采用SPSS 18.0软件进行数据处理。呈正态分布的计量资料以x±s表示,两组间比较采用两独立样本t检验。检验水准(α)为0.05。
2 结果 2.1 OPN-O/E转染效果的验证用慢病毒质粒转染PSC 48 h后,对照组细胞贴壁呈条索状,而OPN-O/E组细胞逐渐呈多角形及星形(图 1),但两组之间荧光表达率差异并无统计学意义[(78.57±2.87)% vs(77.77±1.84)%,t=0.41,P=0.705]。实时荧光定量PCR结果显示OPN-O/E组OPN mRNA的相对表达量为2.08±0.18,与对照组(1.00±0.10)相比差异有统计学意义(t=-9.07,P=0.001),证实所构建的慢病毒载体能有效上调OPN的表达。
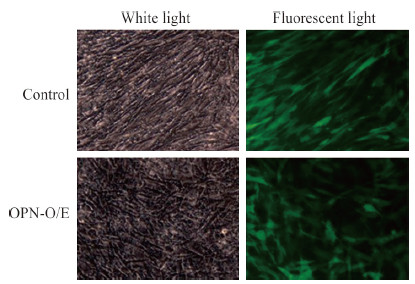
|
图 1 OPN慢病毒过表达载体(OPN-O/E)转染PSC 48 h后白光及荧光显微镜下的表现 Fig 1 PSC transfected with OPN lentiviral overexpression vector (OPN-O/E) under white light and fluorescence microscope OPN: Osteopontin; PSC: Pancreatic stellate cell. Original magnification: ×200 |
2.2 OPN过表达对PSC增殖活性、趋化活性的影响
采用CCK-8实验检测细胞增殖活性,结果显示上调OPN表达后PSC增殖活性增加,OPN-O/E组与对照组的光密度值分别为1.04±0.03与0.59±0.04,两组差异有统计学意义(t=-17.78,P<0.01)。上调OPN表达后PSC趋化活性也增加(图 2),OPN-O/E组和对照组穿过小室的细胞数分别为960.00±76.47、589.33±88.79,两组差异有统计学意义(t=-4.79,P=0.017)。

|
图 2 骨桥蛋白过表达对PSC趋化活性的影响 Fig 2 Effect of osteopontin overexpression on chemotactic activity of PSC PSC: Pancreatic stellate cell; OPN-O/E: Osteopontin lentivirus overexpression vector. Original magnification: ×200 |
2.3 上调OPN表达对PSC活性及PI3K/Akt信号通路的影响
OPN-O/E组OPN蛋白的相对表达量较对照组增加(4.42±0.15 vs 1.54±0.13,t=-25.45,P<0.01)。OPN-O/E组α-SMA蛋白的相对表达量高于对照组(4.35±0.26 vs 1.21±0.10,t=-19.46,P<0.01),提示上调OPN表达可诱导PSC转为活化状态。上调OPN表达后p-PI3K及p-Akt蛋白的相对表达量也较对照组增加(2.00±0.26 vs 1.12±0.36,t=-3.43,P=0.027;1.47±0.11 vs 0.52±0.04,t=-14.60,P<0.01);而上调OPN表达后PI3K与Akt蛋白的相对表达量与对照组相比无明显改变(3.85±0.27 vs 3.75±0.41,t=-0.37,P=0.727;1.20±0.08 vs 1.23±0.06,t=0.46,P=0.667)。见图 3。

|
图 3 上调OPN表达对PSC α-SMA及PI3K/Akt信号通路相关蛋白表达的影响 Fig 3 Effect of OPN up-regulation on expression of α-SMA and PI3K/Akt pathway-related proteins in PSC Western blotting results. OPN: Osteopontin; PSC: Pancreatic stellate cell; α-SMA: α-Smooth muscle actin; OPN-O/E: Osteopontin lentivirus overexpression vector; p-PI3KC: Phosphorylated-PI3KC; p-Akt: Phosphorylated-Akt |
2.4 Akt抑制剂对OPN过表达介导的PSC活化的影响
转染OPN-O/E 48 h后加入不同浓度的Akt抑制剂LY294002,以加入等体积的磷酸盐缓冲液为对照,处理1 h后检测α-SMA、p-Akt及Akt蛋白的表达。蛋白质印迹法结果(图 4,表 1)显示,无论LY294002的浓度是10 μmol/L还是50 μmol/L均可有效抑制α-SMA及p-Akt蛋白的表达,与OPN-O/E组相比差异均有统计学意义(α-SMA:t=19.90、45.06,P均<0.01;p-Akt:t=16.81、22.08,P均<0.01);而Akt蛋白的表达则无明显变化(t=-0.90、-0.35,P均>0.05)。

|
图 4 Akt抑制剂LY294002对OPN过表达PSC中α-SMA、p-Akt及Akt蛋白表达的影响 Fig 4 Effect of Akt inhibitor LY294002 on expression of α-SMA, p-Akt and Akt in OPN overexpression-PSC Western blotting results. OPN: Osteopontin; PSC: Pancreatic stellate cell; α-SMA: α-Smooth muscle actin; p-Akt: Phosphorylated-Akt; OPN-O/E: Osteopontin lentivirus overexpression vector |
|
|
表 1 Akt抑制剂LY294002处理后PSC中α-SMA、p-Akt及Akt蛋白的相对表达量 Tab 1 Relative expression of α-SMA, p-Akt and Akt in PSC treated with Akt inhibitor LY294002 |
3 讨论
OPN是一种分泌型糖蛋白,作为细胞因子及细胞外基质蛋白其参与了组织重建、骨重建、炎性渗出及肿瘤转移等生理及病理过程[6]。研究发现,OPN在瘢痕及纤维化组织(如肾纤维化组织、肝纤维组织、肺纤维化组织等)过表达,且与机体的促纤维化作用密切相关[10, 12-13]。有关OPN在CP的胰腺纤维化中的作用研究甚少,Rychlíková等[13]发现CP患者OPN的浓度高于2型糖尿病患者及正常人,特别在伴有钙化和结石的患者中。PSC与肝星形细胞同源,主要位于胰腺腺泡、导管及血管周围,静止状态时呈条索状或纺锤状,细胞质富含维生素A脂滴,一旦被激活其形态向多角形或星形转变,维生素A脂滴消失,取而代之表达特异性标志物α-SMA,增殖、迁移活性等也明显提高,释放多种细胞因子及生长因子,合成大量细胞外基质成分,最终导致胰腺纤维化[14]。本实验结果显示,上调OPN不仅可以激活PSC表达α-SMA,而且促进其增殖及趋化活性,进一步证实OPN可以通过激活PSC参与胰腺纤维化的形成。PI3K/Akt信号通路是参与PSC活化的重要通路之一,在血小板源性生长因子、乙醇、乙醛等公认的PSC激动剂激活PSC的过程中PI3K/Akt信号通路均起主要作用。PI3K/Akt信号通路还参与了OPN下游的重要作用机制。有研究表明OPN通过激活PI3K/Akt信号通路促进瘦素介导的肝纤维化[15]、上调血管生长因子表达[16]及促进肿瘤新生血管的形成[17]。本实验结果显示,上调OPN表达后PI3K/Akt信号通路中p-PI3K及p-Akt的表达增加,给予10 μmol/L或50 μmol/L Akt特异性抑制剂LY294002处理后,上调OPN表达引起的α-SMA及p-Akt过表达被抑制,表明OPN可以通过激活PI3K/Akt信号通路介导PSC的活化。综上,我们认为OPN通过激活PI3K/Akt信号通路介导PSC活化,进而参与了胰腺纤维化。
| [1] |
LEW D, AFGHANI E, PANDOL S. Chronic pancreatitis:current ctatus and challenges for crevention and creatment[J]. Dig Dis Sci, 2017, 62: 1702-1712. DOI:10.1007/s10620-017-4602-2 |
| [2] |
BACHEM M G, SCHNEIDER E, GROSS H, WEIDENBACH H, SCHMID R M, MENKE A, et al. Identification, culture, and characterization of pancreatic stellate cells in rats and humans[J]. Gastroenterology, 1998, 115: 421-432. DOI:10.1016/S0016-5085(98)70209-4 |
| [3] |
UCHIBORI T, MATSUDA K, SHIMODAIRA T, SUGANO M, UEHARA T, HONDA T. IL-6 trans-signaling is another pathway to upregulate osteopontin[J]. Cytokine, 2017, 90: 88-95. DOI:10.1016/j.cyto.2016.11.006 |
| [4] |
ZHANG H, GUO M, CHEN J H, WANG Z, DU X F, LIU P X, et al. Osteopontin knockdown inhibits αv, β3 integrin-induced cell migration and invasion and promotes apoptosis of breast cancer cells by inducing autophagy and inactivating the PI3K/Akt/mTOR pathway[J]. Cell Physiol Biochem, 2014, 33: 991-1002. DOI:10.1159/000358670 |
| [5] |
DIANZANI C, BELLAVISTA E, LIEPE J, VERDERIO C, MARTUCCI M, SANTORO A, et al. Extracellular proteasome-osteopontin circuit regulates cell migration with implications in multiple sclerosis[J/OL]. Sci Rep, 2017, 7: 43718. doi: 10.1038/srep43718. https://www.ncbi.nlm.nih.gov/pubmed/28276434
|
| [6] |
DONG B, PANG T T. LncRNA H19 contributes to Rh2-mediated MC3T3-E1 cell proliferation by regulation of osteopontin[J]. Cell Mol Biol (Noisy-le-grand), 2017, 63: 1-6. DOI:10.14715/cmb/2017.63.12.1 |
| [7] |
LOK S I, NOUS F M, VAN KUIK J, VAN DER WEIDE P, WINKENS B, KEMPERMAN H, et al. Myocardial fibrosis and pro-fibrotic markers in end-stage heart failure patients during continuous-flow left ventricular assist device support[J]. Eur J Cardiothorac Surg, 2015, 48: 407-415. DOI:10.1093/ejcts/ezu539 |
| [8] |
SAKURAYA K, ENDO A, SOMEYA T, HIRANO D, MURANO Y, FUJINAGA S, et al. The synergistic effect of mizoribine and a direct renin inhibitor, aliskiren, on unilateral ureteral obstruction induced renal fibrosis in rats[J]. J Urol, 2014, 191: 1139-1146. DOI:10.1016/j.juro.2013.10.053 |
| [9] |
CHEN Y, OU Y, DONG J, YANG G, ZENG Z, LIU Y, et al. Osteopontin promotes collagenⅠsynthesis in hepatic stellate cells by miRNA-129-5p inhibition[J]. Exp Cell Res, 2018, 362: 343-348. DOI:10.1016/j.yexcr.2017.11.035 |
| [10] |
NAKAMURA M, OKA M, ⅡZUKA N, KAWAUCHI S, GONDO T, UENO T, et al. Osteopontin expression in chronic pancreatitis[J]. Pancreas, 2002, 25: 182-187. DOI:10.1097/00006676-200208000-00012 |
| [11] |
王域玲, 安薇, 李桂香, 朱建伟, 蒋斐. 骨桥蛋白在大鼠慢性胰腺炎中的表达及意义[J]. 中华胰腺病杂志, 2018, 18: 251-255. DOI:10.3760/cma.j.issn.1674-1935.2018.04.009 |
| [12] |
KHALIULLIN T O, KISIN E R, MURRAY A R, YANAMALA N, SHURIN M R, GUTKIN D W, et al. Mediation of the single-walled carbon nanotubes induced pulmonary fibrogenic response by osteopontin and TGF-β1[J]. Exp Lung Res, 2017, 43: 311-326. DOI:10.1080/01902148.2017.1377783 |
| [13] |
RYCHLÍKOVÁ J, VECKA M, JÁCHYMOVÁ M, MACÁŠEK J, HRABÁK P, ZEMAN M, et al. Osteopontin as a discriminating marker for pancreatic cancer and chronic pancreatitis[J]. Cancer Biomark, 2016, 17: 55-65. DOI:10.3233/CBM-160617 |
| [14] |
ERKAN M, WEIS N, PAN Z, SCHWAGER C, SAMKHARADZE T, JIANG X, et al. Organ-, inflammation- and cancer specific transcriptional fingerprints of pancreatic and hepatic stellate cells[J/OL]. Mol Cancer, 2010, 9: 88. doi: 10.1186/1476-4598-9-88. https://link.springer.com/article/10.1186/1476-4598-9-88
|
| [15] |
COOMBES J D, CHOI S S, SWIDERSKA-SYN M, MANKA P, REID D T, PALMA E, et al. Osteopontin is a proximal effector of leptin-mediated non-alcoholic steatohepatitis (NASH) fibrosis[J]. Biochim Biophys Acta, 2016, 1862: 135-144. DOI:10.1016/j.bbadis.2015.10.028 |
| [16] |
XU J, YI Y, LI L, ZHANG W, WANG J. Osteopontin induces vascular endothelial growth factor expression in articular cartilage through PI3K/AKT and ERK1/2 signaling[J]. Mol Med Rep, 2015, 12: 4708-4712. DOI:10.3892/mmr.2015.3975 |
| [17] |
DAI J, PENG L, FAN K, WANG H, WEI R, JI G, et al. Osteopontin induces angiogenesis through activation of PI3K/AKT and ERK1/2 in endothelial cells[J]. Oncogene, 2009, 28: 3412-3422. DOI:10.1038/onc.2009.189 |
 2019, Vol. 40
2019, Vol. 40


