2. 海军军医大学(第二军医大学)长海医院介入诊疗科, 上海 200433
2. Department of Interventional Radiology, Changhai Hospital, Naval Medical University(Second Military Medical University), Shanghai 200433, China
胰腺腺泡细胞癌是少见的胰腺外分泌肿瘤,占所有胰腺肿瘤的1%~2%[1-2]。其临床症状不典型,多以腹痛就诊,可伴有甲胎蛋白(α-fetoprotein,AFP)水平增高,约15%的患者因血液中脂肪酶水平增高而出现多发性皮下脂肪坏死、多动脉炎及血嗜酸性粒细胞增多[3]。既往文献报道较少。本研究总结2012至2018年于我院就诊的胰腺腺泡细胞癌患者的计算机断层扫描(computed tomography,CT)及磁共振成像(magnetic resonance imaging,MRI)特征。
1 资料和方法 1.1 病例资料回顾性分析2012至2018年于海军军医大学(第二军医大学)长海医院经外科手术切除或穿刺活组织病理检查证实为胰腺腺泡细胞癌的5例患者的病例资料,其中2例经外科手术切除病理证实,3例经转移灶穿刺活组织病理检查证实。2例行CT平扫加增强检查,2例行MRI平扫加增强检查,1例既行CT平扫加增强又行MRI平扫加增强检查。本研究通过海军军医大学(第二军医大学)长海医院生物医学研究伦理委员会审批。
1.2 检查方法 1.2.1 CT平扫加增强检查采用德国西门子医疗系统有限公司64层螺旋CT扫描仪,管电压为120 kV,管电流为432 mA,螺距为1.8,重建图像层厚为1.5 mm。层厚为5.0 mm,层间距为0.5 mm。造影剂采用碘海醇(碘含量为300 mg /mL)80~90 mL,注射速率为3~4 mL/s,分别于注射造影剂后20~25、60~70、110~130 s行动脉期、门静脉期和延迟期3期扫描。
1.2.2 MRI平扫加增强检查采用德国西门子医疗系统有限公司Skyra 3.0 T超导型磁共振成像系统,常规自旋回波序列T1加权成像(T1-weighted imaging,T1WI)、抑脂T2加权成像(T2-weighted imaging,T2WI),层厚为3 mm,层间距为1 mm,视野(field of view,FOV)为375 mm×300 mm。动态增强扫描采用梯度回波(gradient echo,GRE)容积内插体部检查(volume interpolated body examination,VIBE)序列,重复时间(repetition time,TR)为3.97 ms,回波时间(echo time,TE)为1.26 ms,矩阵为208×164,FOV为375 mm×296 mm。造影剂为钆喷酸葡胺,剂量为0.1 mmol/kg,注射速率为3.0 mL/s,分别于注射造影剂后25~28、45~50、65~80 s行动脉期、门静脉期和延迟期扫描。
1.3 图像分析由2名影像医学科副主任医师共同阅片,意见不同时通过讨论达成一致。主要观察肿瘤的部位、大小、边界、密度或信号特点、有无坏死、有无出血、有无钙化、有无包膜、包膜是否完整、有无强化及强化的程度和方式,以及有无胰胆管扩张、脾静脉受侵及远处转移等。
1.4 病理学检查2例患者行胰腺部分切除,1例行腹膜后肿大淋巴结穿刺,1例行肝脏转移瘤穿刺,1例行网膜结节、系膜结节穿刺。获得的标本常规行大体病理标本及镜下免疫组织化学检测,并由2名病理科副主任医师共同分析得出结论。
2 结果 2.1 一般资料入组的5例胰腺腺泡细胞癌患者中,男3例、女2例,年龄为59~75岁,平均年龄为66.2岁。1例为健康体检发现,4例因腹痛、腹胀、纳差、消瘦等症状入院后确诊。肿瘤部位:1例位于胰头钩突,4例位于胰尾部。肿瘤最大径为44.6~142.3 mm,平均为86.14 mm。实验室检查:1例患者AFP水平>2 000 ng/mL(正常值≤8.78 ng/mL),1例患者糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)水平为328.92 U/mL(正常值≤37.00 U/mL),余病例AFP或CA19-9水平均在正常值范围。详见表 1。
|
|
表 1 5例胰腺腺泡细胞癌患者的基本情况 |
2.2 影像学特征
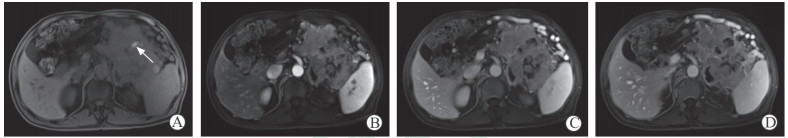
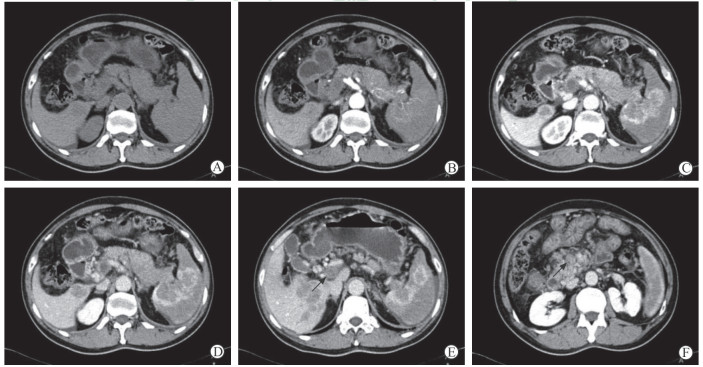
1例CA19-9水平为328.92 U/mL胰腺腺泡细胞癌患者的肿瘤最大径为142.3 mm,MRI检查示肿瘤内部出血、坏死及散在钙化灶,伴脾静脉受累(图 1)。1例AFP水平>2 000 ng/mL胰腺腺泡细胞癌患者的CT检查结果示门静脉、脾静脉、肠系膜上静脉内均见癌栓,肝脏、脾脏内多发转移瘤(图 2)。肿瘤位于胰腺钩突的1例患者病灶最大径为44.6 mm,伴有胰胆管扩张;CT平扫检查示肿瘤病灶呈等低混杂密度,于MRI T1WI平扫图像上呈等低信号,T2WI平扫图像上呈等高信号且信号欠均匀、边界不清。5例患者肿瘤均有多发、大小不等坏死区。5例患者肿瘤边界均不清楚,位于胰头的1例肿瘤有完整的包膜,位于胰尾部的4例病灶均未见到完整包膜。CT或MRI增强动脉期5例肿瘤实性部分均明显强化,均于门静脉期达到强化峰值,延迟期造影剂略有消退;坏死部分无强化,肿瘤强化程度始终低于胰腺实质。4例位于胰尾部的肿瘤均侵犯脾静脉,其中2例有肝脏转移。详见表 2。
|
图 1 1例胰腺腺泡细胞癌患者的磁共振成像 男, 69岁, 糖类抗原19-9水平为328.92 U/mL, 肿瘤最大径为142.3 mm.磁共振成像增强检查动脉期病灶强化明显, 随延迟时间加长强化程度逐渐降低. A:磁共振T1加权成像平扫(箭头所示高信号为肿瘤内出血); B:磁共振成像增强检查动脉期; C:磁共振成像增强检查门静脉期; D:磁共振成像增强检查延迟期 |
|
图 2 1例胰腺腺泡细胞癌患者的计算机断层扫描图像 男, 64岁, 甲胎蛋白水平>2 000 ng/mL.计算机断层扫描检查示胰尾部占位, 动脉期强化明显, 延迟后胰腺病灶强化程度低于正常胰腺, 脾脏内病灶强化明显. A:计算机断层扫描平扫; B:计算机断层扫描增强检查动脉期; C, D:计算机断层扫描增强检查门静脉期; E, F:计算机断层扫描增强检查延迟期[箭头所示为门静脉内癌栓(E)和肠系膜上静脉内癌栓(F)] |
|
|
表 2 5例胰腺腺泡细胞癌患者的影像学特征 |
3 讨论
胰腺腺泡细胞癌是极少见的胰腺恶性肿瘤,多发生于老年男性,发病年龄为50~70岁[4]。本研究中男3例、女2例,平均年龄为66.2岁。本研究中患者临床表现多无特异性,多以腹痛、腹胀就诊,CA19-9、AFP也多在正常值范围,仅1例患者CA19-9水平升高,1例AFP水平(>2 000 ng/mL)升高。AFP>2 000 ng/mL的这例患者,肿瘤侵犯门静脉、脾静脉、肠系膜上静脉,形成静脉内瘤栓,肝脏、脾脏内可见多发转移瘤,术后病理提示肝脏、脾脏内病灶与胰腺病灶同源。文献报道部分病灶较大的胰腺腺泡细胞癌患者可出现AFP水平升高[2]。因此可以推测本例患者的AFP水平升高可能与肿瘤大小及分化程度有关,但具体原因仍待进一步研究。
文献报道有15%的胰腺腺泡细胞癌病例出现血脂升高,表现为脂肪酶增多综合征,如脂膜炎、关节炎、大动脉炎等[5-7],也有文献报道胰腺腺泡细胞癌患者无脂肪酶增多综合征表现[8-10]。本研究5例胰腺腺泡细胞癌患者胰蛋白酶、糜蛋白酶均在正常值范围,亦无脂肪酶增多综合征。
研究发现胰腺腺泡细胞癌为胰头部和胰颈部多见(占60%),其中胰头钩突胰腺腺泡细胞癌占全部的40%[3];也有文献报道胰腺腺泡细胞癌可发生于胰腺的任何部位,以胰腺体尾部多见[5]。由此可见,胰腺腺泡细胞癌无确切好发部位。本研究中,5例患者胰腺腺泡细胞癌发生在胰头钩突1例、胰尾部4例。本研究中胰腺腺泡细胞癌病灶平均最大径为86.14 mm,既往研究报道平均最大径为76~100 mm[11-12],肿瘤体积均较大,可能与胰腺体尾部肿瘤生长空间较大、周围脏器受累较晚、症状出现较晚有关。本研究中位于胰头的1例肿瘤最大径较小(仅为44.6 mm),4例位于胰尾部的肿瘤最大径相对较大(为68.5~142.3 mm,平均为96.525 mm),可能与该例胰头部胰腺腺泡细胞癌患者侵犯胰胆管、出现症状早,患者就诊早有关。
本研究中5例患者病灶均有坏死,原因可能是病灶均较大,内部容易缺血坏死。最大的1例肿瘤内部出现出血、坏死、钙化,其余4例仅有坏死,无出血及钙化,推测肿瘤体积越大越容易发生出血、坏死、钙化。既往文献报道肿瘤包膜不完整提示肿瘤的潜在侵袭性[11-12]。本研究中1例位于胰头的病灶见完整包膜,其余4例位于胰尾部的病灶均无完整包膜,可能是因为肿瘤本身具有一定的侵袭性,并且体积越大向各个方向生长越不均衡,从而造成肿瘤包膜不完整。
研究报道胰腺腺泡细胞癌引起主胰管扩张的患者占29.2%[13]。本研究中1例位于胰头的病灶见双管征,4例位于胰尾部的病灶均累及脾静脉。胰头部空间较小,易发生肿瘤压迫主胰管和(或)胆总管引起上游主胰管和(或)胆总管扩张,而位于胰尾部的病灶比邻脾静脉,最容易侵犯脾静脉。
本研究中病灶增强后均为门静脉期强化达到峰值,延迟期病灶强化略减低,可能是因为肿瘤间质内存在大量血窦样结构及少量纤维组织,增强后呈渐进性强化。肿瘤的强化程度始终低于正常胰腺实质,表明胰腺腺泡细胞癌是乏血供肿瘤。本研究中4例位于胰尾部的病灶均侵犯脾静脉,说明胰腺腺泡细胞癌具有侵袭性,是低度恶性肿瘤。
胰腺腺泡细胞癌应注意与以下疾病鉴别:(1)胰腺导管腺癌,病灶的平均最大径为2~3 cm[14],伴有上游主胰管明显扩张,CA19-9水平明显增高,肿瘤为乏血供肿瘤,较胰腺腺泡细胞癌强化弱,瘤体内更多的是纤维组织,肉眼甚至分辨不出是否有强化。胰腺导管腺癌具有噬神经及围管生长特征。(2)胰腺实性假乳头状瘤,好发于青年女性,病灶与主胰管不相通,肿瘤内多伴出血,肿瘤内部密度或信号欠均匀,增强后呈不均匀逐渐强化。(3)胰腺神经内分泌肿瘤,病灶与主胰管不相通,为富血供肿瘤,边界清楚,增强后动脉期明显强化。
综上所述,胰腺腺泡细胞癌是实性低度恶性肿瘤,肿瘤体积较大,内部多见坏死,多不侵犯胰胆管,乏血供,增强后呈渐进性强化。CT及MRI平扫加增强检查可为临床诊断提供重要信息。
| [1] |
MOROHOSHI T, HELD G, KLÖPPEL G. Exocrine pancreatic tumours and their histological classification. A study based on 167 autopsy and 97 surgical cases[J]. Histopathology, 1983, 7: 645-661. DOI:10.1111/his.1983.7.issue-5 |
| [2] |
KITAGAMI H, KONDO S, HIRANO S, KAWAKAMI H, EGAWA S, TANAKA M. Acinar cell carcinoma of the pancreas:clinical analysis of 115 patients from Pancreatic Cancer Registry of Japan Pancreas Society[J]. Pancreas, 2007, 35: 42-46. DOI:10.1097/mpa.0b013e31804bfbd3 |
| [3] |
JANG S H, CHOI S Y, MIN J H, KIM T W, LEE J A, BYUN S J, et al. [A case of acinar cell carcinoma of pancreas, manifested by subcutaneous nodule as initial clinical symptom][J]. Korean J Gastroenterol, 2010, 55: 139-143. DOI:10.4166/kjg.2010.55.2.139 |
| [4] |
HOLEN K D, KLIMSTRA D S, HUMMER A, GONEN M, CONLON K, BRENNAN M, et al. Clinical characteristics and outcomes from an institutional series of acinar cell carcinoma of the pancreas and related tumors[J]. J Clin Oncol, 2002, 20: 4673-4678. DOI:10.1200/JCO.2002.02.005 |
| [5] |
WISNOSKI N C, TOWNSEND C M Jr, NEALON W H, FREEMAN J L, RIALL T S. 672 patients with acinar cell carcinoma of the pancreas:a population-based comparison to pancreatic adenocarcinoma[J]. Surgery, 2008, 144: 141-148. DOI:10.1016/j.surg.2008.03.006 |
| [6] |
RADIN D R, COLLETTI P M, FORRESTER D M, TANG W W. Pancreatic acinar cell carcinoma with subcutaneous and intraosseous fat necrosis[J]. Radiology, 1986, 158: 67-68. DOI:10.1148/radiology.158.1.3940400 |
| [7] |
TATLI S, MORTELE K J, LEVY A D, GLICKMAN J N, ROS P R, BANKS P A, et al. CT and MRI features of pure acinar cell carcinoma of the pancreas in adults[J]. AJR Am J Roentgenol, 2005, 184: 511-519. DOI:10.2214/ajr.184.2.01840511 |
| [8] |
许壮勇, 曾向廷, 林黛英, 杜光舟. 胰腺腺泡细胞癌的CT、MRI影像特征[J]. 现代医用影像学, 2017, 26: 284-286. |
| [9] |
王金花, 谭婉嫦, 刘立志, 李立, 靳仓正. 胰腺腺泡细胞癌CT、MRI诊断[J]. 中国CT和MRI杂志, 2013, 11: 65-67. |
| [10] |
霍丙胜, 孙金锋, 郎岩, 师艳敏. 胰腺腺泡细胞癌的CT和MRI诊断[J]. 影像研究与医学应用, 2017, 1: 138-139. |
| [11] |
CHIOU Y Y, CHIANG J H, HWANG J I, YEN C H, TSAY S H, CHANG C Y. Acinar cell carcinoma of the pancreas:clinical and computed tomography manifestations[J]. J Comput Assist Tomogr, 2004, 28: 180-186. DOI:10.1097/00004728-200403000-00005 |
| [12] |
KHALILI M, WAX B N, REED W P, SCHUSS A, DREXLER S, WESTON S R, et al. Radiology-pathology conference. Acinar cell carcinoma of the pancreas[J]. Clin Imaging, 2006, 30: 343-346. DOI:10.1016/j.clinimag.2006.05.027 |
| [13] |
IMAMURA M, KIMURA Y, ITO H, NOBUOKA T, KOITO K, SASAKI A, et al. Acinar cell carcinoma of the pancreas with intraductal growth:report of a case[J]. Surg Today, 2009, 39: 1006-1009. DOI:10.1007/s00595-009-3968-y |
| [14] |
MERGO P J, HELMBERGER T K, BUETOW P C, HELMBERGER R C, ROS P R. Pancreatic neoplasms:MR imaging and pathologic correlation[J]. Radiographics, 1997, 17: 281-301. DOI:10.1148/radiographics.17.2.9084072 |
 2019, Vol. 40
2019, Vol. 40


