引用本文

唐海双, 贺晓武, 左乔, 薛盖茨, 张小曦, 许奕, 洪波, 黄清海, 刘建民. 支架辅助弹簧圈栓塞治疗急性期颅内破裂动脉瘤的围手术期危险因素分析[J]. 第二军医大学学报, 2019, 40(2): 117-124

TANG Hai-shuang, HE Xiao-wu, ZUO Qiao, XUE Gai-ci, ZHANG Xiao-xi, XU Yi, HONG Bo, HUANG Qing-hai, LIU Jian-min. Perioperative risk factors of stent-assisted coiling for acute ruptured intracranial aneurysm[J]. Academic Journal of Second Military Medical University, 2019, 40(2): 117-124 (in Chinese with English abstract)

支架辅助弹簧圈栓塞治疗急性期颅内破裂动脉瘤的围手术期危险因素分析
唐海双

, 贺晓武, 左乔, 薛盖茨, 张小曦, 许奕, 洪波, 黄清海, 刘建民


海军军医大学(第二军医大学)长海医院神经外科, 上海 200433
收稿日期: 2019-01-14 接受日期: 2019-02-02
基金项目: 国家重点研发计划重大慢性非传染性疾病防控研究重点专项(2016YFC1300700),国家卫生和计划生育委员会脑卒中防治工程“中国脑卒中高危人群干预适宜技术研究及推广项目”(GN-2018R0001),国家自然科学基金(81701136).
摘要:
目的
探讨支架辅助弹簧圈栓塞(SAC)治疗急性期(≤28 d)颅内破裂动脉瘤(RIA)围手术期技术相关并发症及临床预后的影响因素。方法
回顾性连续纳入2012年1月至2018年6月在海军军医大学(第二军医大学)长海医院接受SAC治疗的急性期RIA患者,对其临床及影像学资料进行单因素分析及多因素logistic回归分析,筛选可能存在的围手术期技术相关并发症及预后的危险因素。结果
最终接受SAC治疗并完成30 d随访的急性期RIA患者共509例,其中男170例、女339例。28例(5.5%)患者围手术期发生缺血并发症,多因素分析结果显示动脉瘤位于血管分叉处是SAC治疗急性期RIA患者围手术期发生缺血并发症的独立危险因素[比值比(OR)=4.108,P=0.001]。25例(4.9%)患者围手术期发生出血并发症,多因素分析结果显示年龄 < 60岁是SAC治疗急性期RIA患者围手术期发生出血并发症的独立危险因素(OR=3.574,P=0.014)。出院改良Rankin量表(mRS)评分为3~5分的患者81例(15.9%),死亡(mRS评分为6分)27例(5.3%),预后不良(mRS评分>2分)率为21.2%(108/509);多因素分析结果显示年龄≥80岁、入院时高Hunt-Hess分级(3~5级)、围手术期发生缺血并发症、围手术期发生出血并发症、入院格拉斯哥昏迷量表(GCS)评分差是急性期RIA患者SAC治疗后预后不良的独立危险因素(P均 < 0.01)。结论
对于SAC治疗的急性期RIA患者,动脉瘤位于血管分叉处是围手术期发生缺血并发症的独立危险因素;年龄 < 60岁是围手术期发生出血并发症的独立危险因素;入院时GCS评分较差的患者出院时临床预后较差,围手术期发生缺血及出血并发症是预后不良的独立危险因素。
关键词:
颅内动脉瘤
蛛网膜下隙出血
支架
神经系统并发症
Perioperative risk factors of stent-assisted coiling for acute ruptured intracranial aneurysm
TANG Hai-shuang

, HE Xiao-wu, ZUO Qiao, XUE Gai-ci, ZHANG Xiao-xi, XU Yi, HONG Bo, HUANG Qing-hai, LIU Jian-min


Department of Neurosurgery, Changhai Hospital, Naval Medical University(Second Military Medical University), Shanghai 200433, China
Supported by Key Project of Prevention and Control of Major Chronic Non-communicable Diseases of National Key Research and Development Plan (2016YFC1300700), Project of Research and Application of Effective Intervention Techniques for High-risk Stroke Population from Stroke Prevention and Control Program of National Health and Family Planning Commission of China (GN-2018R0001), and National Natural Science Foundation of China (81701136).
Abstract:
Objective
To explore the influencing risk factors of perioperative technical complications and clinical prognosis of stent-assisted coiling (SAC) for acute (≤ 28 d) ruptured intracranial aneurysm (RIA).
Methods
Acute RIA patients, who received SAC treatment in Changhai Hospital of Naval Medical University (Second Military Medical University) between Jan. 2012 and Jun. 2018, were retrospectively enrolled. The clinical and imaging data were analyzed using univariable analysis and multivariate logistic regression analysis to identify the potential risk factors of perioperative technical complications and clinical prognosis.
Results
A total of 509 acute RIA patients (170 males and 339 females), who underwent SAC treatment and received 30-d follow-up, were included in this study. Perioperative ischemic complications occurred in 28 cases (5.5%), and multivariate regression analysis showed that the location of aneurysms at the bifurcation of blood vessels was an independent risk factor of ischemic complications (odds ratio[OR]=4.108, P=0.001). Perioperative hemorrhagic complications occurred in 25 cases (4.9%), and multivariate regression analysis showed that age < 60 years was an independent risk factor of hemorrhagic complications (OR=3.574, P=0.014). The modified Rankin scale (mRS) scores of 81 patients (15.9%) ranged from 3 to 5 at discharge, 27 patients (5.3%) died with mRS score of 6, and the poor prognosis (mRS score>2) rate was 21.2% (108/509). Multivariate regression analysis showed that age ≥ 80 years, Hunt-Hess 3-5 class, perioperative ischemic complications, perioperative hemorrhagic complications and poor Glasgow coma scale (GCS) score were independent risk factors of poor prognosis (all P < 0.01).
Conclusion
For the acute RIA patients treated with SAC, the location of aneurysms at the vascular bifurcation is an independent risk factor of perioperative ischemic complications; age < 60 years is an independent risk factor for hemorrhagic complications; and the patients with poor GCS score at admission have a poor prognosis at discharge, and perioperative ischemic and hemorrhagic complications are independent risk factors of poor prognosis.
Key words:
intracranial aneurysm
subarachnoid hemorrhage
stents
neurologic complications
颅内动脉瘤是最常见的脑血管病之一,据统计人群中颅内动脉瘤的检出率约为0.5%~3%[1],尸体解剖报道的颅内动脉瘤发病率为0.2%~9.9%[2]。颅内动脉瘤一旦破裂可造成动脉瘤性蛛网膜下隙出血,致残、致死率很高。研究表明动脉瘤性蛛网膜下隙出血中约12%~15%的患者于就诊前死亡,总体死亡率高达25%,半数以上的幸存者可残留永久性神经功能缺损[3-4]。目前,血管内治疗(endovascular treatment,EVT)是治疗动脉瘤的重要手段之一,随着材料学及治疗理念不断进步,支架辅助弹簧圈栓塞(stent-assisted coiling,SAC)技术已成为宽颈动脉瘤及复杂形态动脉瘤的标准治疗方法之一[5]。然而对于急性期颅内破裂动脉瘤(ruptured intracranial aneurysm,RIA),由于需要使用抗血小板药物,SAC治疗RIA的安全性和有效性尚存在争议。近年来,应用SAC治疗RIA的报道逐渐增多,其安全性和有效性逐渐为临床实践所验证[6-7]。然而针对SAC治疗RIA的围手术期并发症及临床预后风险因素的研究相对较少,本研究拟通过对单中心应用SAC治疗急性期(≤28 d)RIA的患者资料进行回顾性分析,探讨围手术期技术相关缺血、出血并发症及临床预后的危险因素,从而协助临床医师筛选适宜SAC治疗的RIA患者,降低手术并发症及不良预后发生风险。
1 资料和方法
1.1 研究对象
回顾性连续收集2012年1月至2018年6月于海军军医大学(第二军医大学)长海医院行SAC治疗的509例急性期RIA患者的临床资料。纳入标准:(1)入院时经计算机断层扫描(computed tomography,CT)或腰椎穿刺证实为蛛网膜下隙出血;(2)经数字减影血管造影(digital subtraction angiography,DSA)证实RIA为蛛网膜下隙出血的责任病灶;(3)根据三维旋转造影结果判断患者适合行SAC治疗。排除标准:(1)假性、外伤性及感染性动脉瘤;(2)合并脑动静脉畸形或硬脑膜动静脉瘘的动脉瘤;(3)复发需要再治疗的动脉瘤;(4)挽救性支架置入患者;(5)临床或影像资料不完整的病例。本研究经海军军医大学(第二军医大学)长海医院伦理委员会审批,所有纳入对象均签署知情同意书。
1.2 治疗策略
介入治疗策略:患者急诊接诊后于局部麻醉下行脑血管造影,然后由2名及以上神经介入科主任医师结合临床及影像学资料进行病情评估并制定个体化治疗方案,确定行SAC治疗后启动急诊介入治疗程序:全身麻醉后气管插管,根据个体载瘤动脉直径、血管形态及动脉瘤瘤颈大小,由治疗医师选择合适的支架类型及支架释放方案。支架类型包括Enterprise、Lvis、Solitaire和Neuroform。
抗凝策略:以Seldinger法于右侧股动脉穿刺后置入6 Fr鞘管,旋即给予全身肝素化[46 mL生理盐水+2支肝素钠(100 mg/支)配液,按0.67 mg/kg给药,每30 min追加给药1次],维持活化凝血时间为250~300 s。所有患者于手术结束后自然中断肝素注射。
抗血小板策略:治疗策略确定后即刻经口服或纳肛给予负荷剂量双联抗血小板药物(阿司匹林300 mg+氯吡格雷300 mg),或术中支架释放后即刻静脉注射替罗非班。
1.3 研究指标
(1)患者一般状况,包括性别、年龄、高血压病史、糖尿病史、吸烟史、饮酒史、入院Hunt-Hess分级、入院Fisher分级、格拉斯哥昏迷量表(Glasgow coma scale,GCS)评分;(2)动脉瘤特征,包括动脉瘤的部位、瘤颈、最大径、动脉瘤性质、动脉瘤形态、是否宽颈动脉瘤、是否多发动脉瘤、是否位于动脉分叉处;(3)介入治疗因素,包括治疗时机、应用支架类型、是否多支架、是否单次治疗多个动脉瘤。
1.4 预后评价
患者出院时行改良Rankin量表(modified Rankin scale,mRS)评分[8]:0~2分为预后良好,3~5分为有严重神经功能缺损,6分为死亡;mRS评分>2分定义为预后不良。致残定义为出院时mRS评分为3~5分且入院前无相应神经功能缺损症状。术后影像学检查结果由3名及以上手术医师依据Raymond分级法进行独立判读,若结果不一致则共同商讨决定。术后即刻栓塞程度Raymond分级:Ⅰ级为致密栓塞,Ⅱ级为瘤颈残留,Ⅲ级为瘤体残留。
1.5 统计学处理
应用SPSS 22.0软件进行统计学分析。呈偏态分布的计量资料以中位数(下四分位数,上四分位数)表示,两组间比较采用Mann-Whitney U检验;计数资料以例数和百分数表示,两组间比较采用Pearson χ2检验或Fisher确切概率法。对单因素分析中P<0.10的变量行多因素logistic回归(向前选择法)分析,筛选缺血、出血并发症及临床预后的独立危险因素。检验水准(α)为0.05。
2 结果
2.1 患者一般资料
纳入患者共509例,年龄为16~88岁,中位年龄为59(50,66)岁。其中男170例(33.4%),年龄为16~85岁,中位年龄为55(45,63)岁;女339例(66.6%),年龄为24~88岁,中位年龄为61(52,69)岁。既往高血压病史者225例(44.2%),糖尿病史43例(8.4%),吸烟史51例(10.0%),饮酒史20例(3.9%)。入院Hunt-Hess分级高(3~5级)者133例(26.1%),Fisher分级3~4级者247例(48.5%);清醒及轻度意识障碍(GCS评分为13~15分)者414例(81.3%),中度意识障碍(GCS评分为9~12分)者41例(8.1%),重度意识障碍(GCS评分为3~8分)者54例(10.6%)。
2.2 介入治疗情况
509例患者均行SAC治疗,支架释放满意,载瘤动脉通畅。应用支架类型中,Enterprise支架191例(37.5%),Lvis支架284例(55.8%),Solitaire及Neuroform支架34例(6.7%)。术后即刻栓塞程度Raymond分级:Ⅰ级206例(40.5%),Ⅱ级74例(14.5%),Ⅲ级229例(45.0%)。
2.3 围手术期技术相关并发症及危险因素
2.3.1 缺血并发症及危险因素
509例患者中28例(5.5%)于围手术期内出现技术相关缺血并发症,包括术中缺血并发症20例(3.9%)[15例为术中支架内血栓形成,4例为分支或穿支血管缺血事件,1例分叉处动脉瘤患者因术中弹簧圈突入分支血管引起血栓形成]和术后症状性缺血事件8例(1.6%)[5例为支架内血栓形成,2例为分支血管受累,1例穿支血管受累]。单因素分析结果(表 1)显示,分叉处动脉瘤更易发生缺血并发症,差异有统计学意义(χc2=11.178,P=0.001),两组在年龄、性别、病史、饮酒史、入院Hunt-Hess 1~2级、入院Fisher 1~2级、入院GCS评分、介入治疗相关因素及其他动脉瘤特征方面差异均无统计学意义(P均>0.05)。将单因素分析结果中P<0.10的3项危险因素(年龄、吸烟史、分叉处动脉瘤)纳入logistic回归模型进行多因素分析,结果(表 2)显示动脉瘤位于血管分叉处是SAC治疗急性期RIA围手术期发生缺血并发症的独立危险因素[比值比(odds ratio,OR)=4.108,P=0.001]。
表 1
(Tab 1)
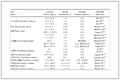
表 1 SAC治疗急性期RIA围手术期发生缺血并发症的单因素分析
Tab 1 Univariate analysis of perioperative ischemic complications of acute RIA treated with SAC
| Variable |
Ischemic N=28 |
Non-ischemic N=481 |
Statistic |
P value |
| General characteristic n (%) |
|
|
|
|
| Age (year) |
|
|
χ2=3.184 |
0.074 |
| <60 |
19 (67.9) |
243 (50.5) |
|
|
| ≥60 |
9 (32.1) |
238 (49.5) |
|
|
| Female |
16 (57.1) |
323 (67.2) |
χ2=1.192 |
0.275 |
| Hypertension |
14 (50.0) |
211 (43.9) |
χ2=0.404 |
0.525 |
| Diabetes mellitus |
4 (14.3) |
39 (8.1) |
χc2=0.629 |
0.428 |
| Smoking |
6 (21.4) |
45 (9.4) |
χc2=3.043 |
0.081 |
| Drinking |
2 (7.1) |
18 (3.7) |
χc2=0.160 |
0.689 |
| Hunt-Hess grade 1-2 |
21 (75.0) |
355 (73.8) |
χ2=0.020 |
0.889 |
| Fisher grade 1-2 |
15 (53.6) |
247 (51.4) |
χ2=0.052 |
0.819 |
| GCS score |
|
|
Fisher exact test |
1.000 |
| 13-15 |
23 (82.1) |
391 (81.3) |
|
|
| 9-12 |
2 (7.1) |
39 (8.1) |
|
|
| 3-8 |
3 (10.7) |
51 (10.6) |
|
|
| Aneurysm feature |
|
|
|
|
| Aneurysm neck diameter d/mm, M (QL, QU) |
3.7 (2.5, 4.4) |
3.6 (2.7, 4.7) |
Z=-0.285 |
0.776 |
| Maximum diameter d/mm, M (QL, QU) |
4.3 (3.1, 6.9) |
4.6 (3.3, 6.3) |
Z=-0.392 |
0.695 |
| <4 n (%) |
12 (42.9) |
192 (39.9) |
|
|
| 4-10 n (%) |
13 (46.4) |
251 (52.2) |
|
|
| >10 n (%) |
3 (10.7) |
38 (7.9) |
|
|
| Wide neck n (%) |
24 (85.7) |
396 (82.3) |
χc2=0.041 |
0.839 |
| Classification of aneurysm n (%) |
|
|
Fisher exact test |
0.551 |
| Saccular aneurysm |
23 (82.1) |
418 (86.9) |
|
|
| Dissecting aneurysm |
3 (10.7) |
39 (8.1) |
|
|
| Vesicular aneurysm |
2 (7.1) |
24 (5.0) |
|
|
| Anterior circulation aneurysm n (%) |
21 (75.0) |
413 (85.9) |
χc2=1.696 |
0.193 |
| Bifurcated aneurysm n (%) |
10 (35.7) |
57 (11.9) |
χc2=11.178 |
0.001 |
| Multiple aneurysm n (%) |
7 (25.0) |
107 (22.2) |
χ2=0.116 |
0.734 |
| Irregular aneurysm n (%) |
9 (32.1) |
125 (26.0) |
χ2=0.517 |
0.472 |
| Therapeutic factor n (%) |
|
|
|
|
| Treatment time≤3 d |
22 (78.6) |
369 (76.7) |
χ2=0.051 |
0.821 |
| Intraoperative tirofiban |
|
|
χ2=0.745 |
0.388 |
| Yes |
15 (53.6) |
297 (61.7) |
|
|
| No |
13 (46.4) |
184 (38.3) |
|
|
| Stent |
|
|
Fisher exact test |
0.446 |
| Enterprise |
8 (28.6) |
183 (38.0) |
|
|
| Lvis |
17 (60.7) |
267 (55.5) |
|
|
| Solitaire/neuroform |
3 (10.7) |
31 (6.4) |
|
|
| Multi-stent |
4 (14.3) |
86 (17.9) |
χc2=0.053 |
0.818 |
| Multi aneurysm |
3 (10.7) |
44 (9.1) |
χc2=0.000 |
1.000 |
| Immediate embolization after operation |
|
|
Fisher exact test |
0.745 |
| Raymond Ⅰ |
13 (46.4) |
193 (40.1) |
|
|
| Raymond Ⅱ |
3 (10.7) |
71 (14.8) |
|
|
| Raymond Ⅲ |
12 (42.9) |
217 (45.1) |
|
|
| SAC: Stent-assisted coiling; RIA: Ruptured intracranial aneurysm; GCS: Glasgow coma scale; M (QL, QU): Median (lower quartile, upper quartile) |
|
表 1 SAC治疗急性期RIA围手术期发生缺血并发症的单因素分析
Tab 1 Univariate analysis of perioperative ischemic complications of acute RIA treated with SAC
|
表 2
(Tab 2)

表 2 SAC治疗急性期RIA围手术期缺血并发症的多因素分析
Tab 2 Multivariate analysis of perioperative ischemic complications of acute RIA treated with SAC
| Variable |
B |
SE |
Wald |
df |
OR (95% CI) |
P value |
| Age |
0.595 |
0.423 |
1.982 |
1 |
1.814 (0.792, 4.156) |
0.159 |
| Smoking |
0.970 |
0.502 |
3.741 |
1 |
2.638 (0.987, 7.052) |
0.053 |
| Bifurcated aneurysm |
1.413 |
0.426 |
11.016 |
1 |
4.108 (1.783, 9.462) |
0.001 |
| SAC: Stent-assisted coiling; RIA: Ruptured intracranial aneurysm; B: Regression coefficient; SE: Standard error; df: Degree of freedom; OR: Odds ratio; CI: Confidence interval |
|
表 2 SAC治疗急性期RIA围手术期缺血并发症的多因素分析
Tab 2 Multivariate analysis of perioperative ischemic complications of acute RIA treated with SAC
|
2.3.2 出血并发症及危险因素
509例患者中25例(4.9%)于围手术期内发生出血并发症,包括术中动脉瘤破裂出血8例(1.6%)[5例于术中见弹簧圈或微导管头端穿出动脉瘤壁伴造影剂外溢,3例仅见造影剂外溢]和术后早期再出血17例(3.3%)。单因素分析结果(表 3)显示,年龄<60岁、动脉瘤位于颈内及前交通动脉的患者更易发生出血并发症,差异有统计学意义(χ2=8.565、4.103;P=0.003、0.043),两组在性别、病史、吸烟史、入院Hunt-Hess 1~2级、入院Fisher 1~2级、入院GCS评分、介入治疗相关因素及其他动脉瘤特征方面差异均无统计学意义(P均>0.05)。将单因素分析结果中P<0.10的4项危险因素(年龄、饮酒史、颈内及前交通动脉瘤、治疗时机)纳入logistic回归模型进行多因素分析,结果(表 4)显示年龄<60岁是SAC治疗急性期RIA围手术期发生出血并发症的独立危险因素(OR=3.574,P=0.014)。
表 3
(Tab 3)

表 3 SAC治疗急性期RIA围手术期出血并发症的单因素分析
Tab 3 Univariate analysis of perioperative hemorrhagic complications of acute RIA treated with SAC
| Variable |
Hemorrhage N=25 |
Non-hemorrhage N=484 |
Statistic |
P value |
| General characteristic n (%) |
|
|
|
|
| Age (year) |
|
|
χ2=8.565 |
0.003 |
| <60 |
20 (80.0) |
242 (50.0) |
|
|
| ≥60 |
5 (20.0) |
242 (50.0) |
|
|
| Female |
14 (56.0) |
325 (67.1) |
χ2=1.328 |
0.249 |
| Hypertension |
11 (44.0) |
214 (44.2) |
χ2=0.000 |
0.983 |
| Diabetes mellitus |
2 (8.0) |
41 (8.5) |
χc2=0.000 |
1.000 |
| Smoking |
3 (12.0) |
48 (9.9) |
χc2=0.000 |
1.000 |
| Drinking |
3 (12.0) |
17 (3.5) |
Fisher exact test |
0.069 |
| Hunt-Hess grade 1-2 |
17 (68.0) |
359 (74.2) |
χ2=0.469 |
0.493 |
| Fisher grade 1-2 |
12 (48.0) |
250 (51.7) |
χ2=0.127 |
0.722 |
| GCS score |
|
|
Fisher exact test |
0.295 |
| 13-15 |
19 (76.0) |
395 (81.6) |
|
|
| 9-12 |
1 (4.0) |
40 (8.3) |
|
|
| 3-8 |
5 (20.0) |
49 (10.1) |
|
|
| Aneurysm feature |
|
|
|
|
| Aneurysm neck diameter d/mm, M (QL, QU) |
3.6 (2.2, 4.4) |
3.6 (2.7, 4.7) |
Z=-0.918 |
0.358 |
| Maximum diameter d/mm, M (QL, QU) |
4.1 (2.9, 5.5) |
4.5 (3.3, 6.5) |
Z=-1.170 |
0.242 |
| Wide neck n (%) |
22 (88.0) |
398 (82.2) |
χc2=0.221 |
0.638 |
| Classification of aneurysm n (%) |
|
|
Fisher exact test |
0.893 |
| Saccular aneurysm |
23 (92.0) |
418 (86.4) |
|
|
| Dissecting aneurysm |
1 (4.0) |
41 (8.5) |
|
|
| Vesicular aneurysm |
1 (4.0) |
25 (5.2) |
|
|
| Anterior circulation aneurysm n (%) |
23 (92.0) |
411 (84.9) |
χc2=0.469 |
0.493 |
| Location of aneurysm n (%) |
|
|
χ2=4.103 |
0.043 |
| Internal and anterior communicating arteries |
14 (56.0) |
174 (36.0) |
|
|
| Other location |
11 (44.0) |
310 (64.0) |
|
|
| Bifurcated aneurysm n (%) |
3 (12.0) |
64 (13.2) |
χc2=0.000 |
1.000 |
| Multiple aneurysm n (%) |
5 (20.0) |
109 (22.5) |
χ2=0.087 |
0.768 |
| Irregular aneurysm n (%) |
7 (28.0) |
127 (26.2) |
χ2=0.038 |
0.845 |
| Therapeutic factor n (%) |
|
|
|
|
| Treatment time≤3 d |
23 (92.0) |
368 (76.0) |
χ2=3.400 |
0.065 |
| Intraoperative tirofiban |
|
|
χ2=0.958 |
0.328 |
| Yes |
13 (52.0) |
299 (61.8) |
|
|
| No |
12 (48.0) |
185 (38.2) |
|
|
| Stent |
|
|
Fisher exact test |
0.712 |
| Enterprise |
8 (32.0) |
183 (37.8) |
|
|
| Lvis |
15 (60.0) |
269 (55.6) |
|
|
| Solitaire/Neuroform |
2 (8.0) |
32 (6.6) |
|
|
| Multi-stent |
4 (16.0) |
86 (17.8) |
χc2=0.000 |
1.000 |
| Multi aneurysm |
2 (8.0) |
45 (9.3) |
χc2=0.000 |
1.000 |
| Immediate embolization after operation |
|
|
Fisher exact test |
0.961 |
| Raymond Ⅰ |
11 (44.0) |
195 (40.3) |
|
|
| Raymond Ⅱ |
3 (12.0) |
71 (14.7) |
|
|
| Raymond Ⅲ |
11 (44.0) |
218 (45.0) |
|
|
| SAC: Stent-assisted coiling; RIA: Ruptured intracranial aneurysm; GCS: Glasgow coma scale; M (QL, QU): Median (lower quartile, upper quartile) |
|
表 3 SAC治疗急性期RIA围手术期出血并发症的单因素分析
Tab 3 Univariate analysis of perioperative hemorrhagic complications of acute RIA treated with SAC
|
表 4
(Tab 4)

表 4 SAC治疗急性期RIA围手术期出血并发症的多因素分析
Tab 4 Multivariate analysis of perioperative hemorrhagic complications of acute RIA treated with SAC
| Variable |
B |
SE |
Wald |
df |
OR (95% CI) |
P value |
| Age<60 years |
1.274 |
0.519 |
6.022 |
1 |
3.574 (1.292, 9.884) |
0.014 |
| Drinking |
1.216 |
0.690 |
3.102 |
1 |
3.373 (0.872, 13.048) |
0.078 |
| Treatment time≤3 d |
-1.342 |
0.750 |
3.204 |
1 |
0.261 (0.060, 1.136) |
0.073 |
| Internal and anterior communicating arteries |
0.664 |
0.429 |
2.395 |
1 |
1.942 (0.838, 4.502) |
0.122 |
| SAC: Stent-assisted coiling; RIA: Ruptured intracranial aneurysm; B: Regression coefficient; SE: Standard error; df: Degree of freedom; OR: Odds ratio; CI: Confidence interval |
|
表 4 SAC治疗急性期RIA围手术期出血并发症的多因素分析
Tab 4 Multivariate analysis of perioperative hemorrhagic complications of acute RIA treated with SAC
|
2.4 出院时患者状况及预后因素分析
出院时对509例患者行mRS评分,401例(78.8%)无明显神经功能障碍(mRS评分为0~2分),81例(15.9%)残留不同程度神经功能缺损(mRS评分为3~5分),27例(5.3%)死亡(mRS评分为6分),预后不良率(mRS评分>2分)为21.2%。单因素分析结果(表 5)显示,年龄、高血压病史、入院Hunt-Hess 3~5级、入院Fisher 3~4级、入院GCS评分、围手术期发生缺血并发症、围手术期发生出血并发症与预后情况关系密切,差异有统计学意义(χc2=8.716,χ2=9.689、133.249、53.094,Fisher确切概率法,χ2=22.876、54.346;P均<0.01),两组在性别等其他基本资料、介入治疗相关因素及动脉瘤特征方面的差异均无统计学意义(P均>0.05)。将单因素分析结果中P<0.10的9项危险因素纳入logistic回归模型进行多因素分析,结果(表 6)显示,年龄≥80岁、入院时高Hunt-Hess分级(3~5级)、围手术期发生缺血并发症、围手术期发生出血并发症是急性期RIA患者SAC治疗后预后不良的独立危险因素(OR=7.687、4.905、7.804、39.317,P均<0.01)。相较于入院时清醒及轻度意识障碍(GCS评分为13~15分)者,中度意识障碍(GCS评分为9~12分)者预后不良风险上升6倍(OR=6.019,P=0.001),重度意识障碍(GCS评分为3~8分)者预后不良风险上升近13倍(OR=12.800,P<0.01)。
表 5
(Tab 5)

表 5 SAC治疗急性期RIA预后的单因素分析
Tab 5 Univariate analysis of prognosis of acute RIA treated with SAC
| Variable |
Poor prognosis N=108 |
Good prognosis N=401 |
Statistic |
P value |
| General characteristic n (%) |
|
|
|
|
| Age (year) |
|
|
χc2=8.716 |
0.003 |
| <80 |
99 (91.7) |
393 (98.0) |
|
|
| ≥80 |
9 (8.3) |
8 (2.0) |
|
|
| Female |
68 (63.0) |
271 (67.6) |
χ2=0.816 |
0.366 |
| Hypertension |
62 (57.4) |
163 (40.6) |
χ2=9.689 |
0.002 |
| Diabetes mellitus |
12 (11.1) |
31 (7.7) |
χ2=1.257 |
0.262 |
| Smoking |
13 (12.0) |
38 (9.5) |
χ2=0.619 |
0.431 |
| Drinking |
6 (5.6) |
14 (3.5) |
χc2=0.491 |
0.483 |
| Hunt-Hess grade 3-5 |
75 (69.4) |
58 (14.5) |
χ2=133.249 |
<0.01 |
| Fisher grade 3-4 |
86 (79.6) |
161 (40.1) |
χ2=53.094 |
<0.01 |
| GCS score |
|
|
Fisher exact test |
<0.01 |
| 13-15 |
42 (38.9) |
372 (92.8) |
|
|
| 9-12 |
24 (22.2) |
17 (4.2) |
|
|
| 3-8 |
42 (38.9) |
12 (3.0) |
|
|
| Aneurysm feature |
|
|
|
|
| Aneurysm neck diameter d/mm, M (QL, QU) |
4.0 (2.8, 5.0) |
3.5 (2.6, 4.6) |
Z=-1.288 |
0.358 |
| Maximum diameter d/mm, M (QL, QU) |
5.0 (3.4, 7.4) |
4.5 (3.2, 6.3) |
Z=-1.920 |
0.055 |
| Wide neck n (%) |
90 (83.3) |
330 (82.3) |
χ2=0.064 |
0.801 |
| Classification of aneurysm n (%) |
|
|
Fisher exact test |
0.227 |
| Saccular aneurysm |
90 (83.3) |
351 (87.5) |
|
|
| Dissecting aneurysm |
9 (8.3) |
33 (8.2) |
|
|
| Vesicular aneurysm |
9 (8.3) |
17 (4.2) |
|
|
| Posterior circulation aneurysm n (%) |
21 (19.4) |
54 (13.5) |
χ2=2.420 |
0.120 |
| Bifurcated aneurysm n (%) |
17 (15.7) |
50 (12.5) |
χ2=0.797 |
0.372 |
| Multiple aneurysm n (%) |
25 (23.1) |
89 (22.2) |
χ2=0.045 |
0.833 |
| Irregular aneurysm n (%) |
32 (29.6) |
102 (25.4) |
χ2=0.771 |
0.380 |
| Therapeutic factor n (%) |
|
|
|
|
| Treatment time≤3 d |
84 (77.8) |
307 (76.6) |
χ2=0.071 |
0.790 |
| Intraoperative tirofiban |
58 (53.7) |
254 (63.3) |
χ2=3.331 |
0.068 |
| Stent |
|
|
Fisher exact test |
0.365 |
| Enterprise |
45 (41.7) |
146 (36.4) |
|
|
| Lvis |
54 (50.0) |
230 (57.4) |
|
|
| Solitaire/Neuroform |
9 (8.3) |
25 (6.2) |
|
|
| Multi-stent |
21 (19.4) |
69 (17.2) |
χ2=0.293 |
0.589 |
| Multi aneurysm |
11 (10.2) |
36 (9.0) |
χ2=0.148 |
0.700 |
| Immediate embolization after operation |
|
|
Fisher exact test |
0.367 |
| Raymond Ⅰ |
50 (46.3) |
156 (38.9) |
|
|
| Raymond Ⅱ |
15 (13.9) |
59 (14.7) |
|
|
| Raymond Ⅲ |
43 (39.8) |
186 (46.4) |
|
|
| Ischemic complication n (%) |
16 (14.8) |
12 (3.0) |
χ2=22.876 |
<0.01 |
| Hemorrhagic complication n (%) |
20 (18.5) |
5 (1.2) |
χ2=54.346 |
<0.01 |
| SAC: Stent-assisted coiling; RIA: Ruptured intracranial aneurysm; GCS: Glasgow coma scale; M (QL, QU): Median (lower quartile, upper quartile) |
|
表 5 SAC治疗急性期RIA预后的单因素分析
Tab 5 Univariate analysis of prognosis of acute RIA treated with SAC
|
表 6
(Tab 6)

表 6 SAC治疗急性期RIA预后不良的多因素分析
Tab 6 Multivariate analysis of poor prognosis of acute RIA treated with SAC
| Variable |
B |
SE |
Wald |
df |
OR (95% CI) |
P value |
| Age≥80 years |
2.040 |
0.657 |
9.647 |
1 |
7.687 (2.122, 27.841) |
0.002 |
| Hunt-Hess grade 3-5 |
1.590 |
0.494 |
10.375 |
1 |
4.905 (1.864, 12.908) |
0.001 |
| GCS grade 13-15 |
|
|
22.097 |
2 |
|
|
| GCS grade 9-12 |
1.795 |
0.538 |
11.134 |
1 |
6.019 (2.097, 17.276) |
0.001 |
| GCS grade 3-8 |
2.549 |
0.546 |
21.831 |
1 |
12.800 (4.393, 37.294) |
<0.01 |
| Ischemic complication |
2.055 |
0.557 |
13.602 |
1 |
7.804 (2.619, 23.256) |
<0.01 |
| Hemorrhage complication |
3.672 |
0.604 |
37.314 |
1 |
39.317 (12.104, 127.705) |
<0.01 |
| SAC: Stent-assisted coiling; RIA: Ruptured intracranial aneurysm; GCS: Glasgow coma scale; B: Regression coefficient; SE: Standard error; df: Degree of freedom; OR: Odds ratio; CI: Confidence interval |
|
表 6 SAC治疗急性期RIA预后不良的多因素分析
Tab 6 Multivariate analysis of poor prognosis of acute RIA treated with SAC
|
3 讨论
EVT已经成为临床治疗颅内动脉瘤安全、有效的措施[9],其中SAC可以为动脉瘤瘤颈提供支撑,避免弹簧圈突入载瘤动脉而导致血管狭窄或闭塞,同时可对血流产生一定的导向作用,减少入动脉瘤内血量,有利于动脉瘤内血栓形成、机化,从而获得较好的远期预后[10-11]。目前SAC技术多用于治疗宽颈及复杂形态的未破裂动脉瘤,对于治疗急性期RIA的研究较少。本研究中,SAC治疗急性期RIA的围手术期缺血并发症的发生率为5.5%(28/509),出血并发症的发生率为4.9%(25/509),总体并发症发生率为10.4%。需要注意的是,RIA患者一旦出现并发症,尤其是再出血并发症,其临床预后通常较差[12]。研究指出,相较于未破裂动脉瘤,SAC治疗RIA早期严重并发症的发生风险上升10倍,早期再出血是致死的主要原因[13]。因此,明确SAC治疗RIA的并发症及临床预后危险因素有重要价值,可以为RIA患者的治疗决策提供科学指导,有助于筛选SAC治疗的适宜人群从而降低手术风险。
本研究对单中心509例行SAC治疗的急性期RIA患者资料进行单因素分析,结果显示血管分叉处动脉瘤容易发生缺血并发症,差异有统计学意义(P=0.001),多因素分析结果显示血管分叉处动脉瘤是SAC治疗急性期RIA患者围手术期发生缺血并发症独立危险因素(OR=4.108,P=0.001)。CLARITY研究[14]认为缺血并发症与动脉瘤部位无明显相关性,与本研究结果不一致,但该研究仅通过解剖位置对动脉瘤进行分类,未对具体血管条件进行分层分析。本研究纳入的分叉处动脉瘤大多位于大脑中动脉分叉处及基底动脉尖部,支架置入会对分叉血管及动脉瘤内血流产生影响,复杂的血流动力学改变可能与缺血并发症的发生有关;另外因血管解剖的复杂性,手术操作不便利以及手术时间延长也可能是缺血并发症发生率较高的原因之一。
本研究多因素分析结果还显示年龄<60岁是SAC治疗急性期RIA患者围手术期发生出血并发症的独立危险因素(OR=3.574,P=0.014)。CLARITY研究显示年龄<65岁可能与术中动脉瘤破裂出血相关,但多因素分析结果显示差异并无统计学意义[14]。目前,动脉瘤瘤颈大小与出血事件的相关性意见仍不统一[14-15],本研究结果并未发现二者之间具有相关性。本研究单因素分析结果显示动脉瘤位于颈内动脉及前交通动脉出血并发症的发生率高于其他部位动脉瘤[56.0%(14/25)vs 44.0%(11/25)],但既往有研究认为动脉瘤位于大脑中动脉、大脑前动脉可能与术中动脉瘤破裂出血有关[16],两者不一致可能与患者的人群差异及临床医师的经验、技能有关[17]。
本研究509例患者中,出院时预后不良率为21.2%(108/509),多因素分析结果显示年龄≥80岁、入院高Hunt-Hess分级(3~5级)、围手术期发生缺血并发症、围手术期发生出血并发症是SAC治疗急性期RIA患者预后不良的独立危险因素(OR=7.687、4.905、7.804、39.317、P均<0.01);此外,相较于入院清醒及轻度意识障碍者(GCS评分为13~15分),中度意识障碍者(GCS评分为9~12分)预后不良风险上升至6倍,重度意识障碍者预后不良风险上升近13倍。Muto等[18]关于SAC治疗RIA的研究中,预后不良率为17.5%,入院高Hunt-Hess分级(4~5级)者预后更差。Zhao等[19]的研究也认为高龄、入院评分状况差的患者临床预后不佳。一般而言,入院临床评分(Hunt-Hess分级、Fisher分级、GCS评分)较差的患者通常蛛网膜下隙出血本身也较严重,后续的脑组织水肿、血管痉挛等并发情况亦可加重病情,这类患者通常在出院时存在或轻或重地神经功能缺损,随着后续治疗及康复锻炼,部分患者的临床状况可改善。此外,围手术期发生技术相关并发症,尤其是出血并发症是预后不良的影响因素。因此,拟采用SAC治疗的RIA患者,预防并发症尤其是出血并发症的发生对其临床预后至关重要。
综上所述,对于SAC治疗急性期RIA的患者,动脉瘤位于血管分叉处是围手术期发生缺血并发症的独立危险因素;年龄<60岁是围手术期发生出血并发症的独立危险因素;入院时GCS评分较差的患者出院时临床预后较差,围手术期出现缺血及出血并发症是预后不良的独立危险因素。但是受限于回顾性研究以及单中心的样本数据,本研究结果的普适性仍较差,其相关结论有待大规模的多中心前瞻性研究进一步证实。
参考文献
| [1] |
WINN H R, JANE J A Sr, TAYLOR J, KAISER D, BRITZ G W. Prevalence of asymptomatic incidental aneurysms:review of 4568 arteriograms[J]. J Neurosurg, 2002, 96: 43-49. DOI:10.3171/jns.2002.96.1.0043 |
| [2] |
International Study of Unruptured Intracranial Aneurysms Investigators. Unruptured intracranial aneurysms-risk of rupture and risks of surgical intervention[J]. N Engl J Med, 1998, 339: 1725-1733. DOI:10.1056/NEJM199812103392401 |
| [3] |
MAYBERG M R, BATJER H H, DACEY R, DIRINGER M, HALEY E C, HEROS R C, et al. Guidelines for the management of aneurysmal subarachnoid hemorrhage. A statement for healthcare professionals from a special writing group of the Stroke Council, American Heart Association[J]. Stroke, 1994, 25: 2315-2328. DOI:10.1161/01.STR.25.11.2315 |
| [4] | |
| [5] |
GRANJA M F, CORTEZ G M, AGUILAR-SALINAS P, AGNOLETTO G J, IMBARRATO G, JAUME A, et al. Stent-assisted coiling of cerebral aneurysms using the Y-stenting technique: a systematic review and meta-analysis[J/OL]. J Neurointerv Surg, 2019 Jan 4. pii: neurintsurg-2018-014517. doi: 10.1136/neurintsurg-2018-014517.
|
| [6] |
AMENTA P S, DALYAI R T, KUNG D, TOPOROWSKI A, CHANDELA S, HASAN D, et al. Stent-assisted coiling of wide-necked aneurysms in the setting of acute subarachnoid hemorrhage:experience in 65 patients[J]. Neurosurgery, 2012, 70: 1415-1429. DOI:10.1227/NEU.0b013e318246a4b1 |
| [7] |
张小曦, 左乔, 刘建民, 黄清海, 许奕, 赵瑞, 等. 支架辅助弹簧圈栓塞术和单纯弹簧圈栓塞术治疗急性期颅内破裂宽颈动脉瘤安全性的比较[J]. 第二军医大学学报, 2018, 39: 124-128. ZHANG X X, ZUO Q, LIU J M, HUANG Q H, XU Y, ZHAO R, et al. Safety of stent-assisted coiling versus coiling-only in treatment of acute ruptured intracranial wide-necked aneurysms:a comparitive study[J]. Acad J Sec Mil Med Univ, 2018, 39: 124-128. |
| [8] | |
| [9] |
PENGFEI Y, KAIJUN Z, YU Z, RUI Z, LEI Z, WENYUAN Z, et al. Stent-assisted coil placement for the treatment of 211 acutely ruptured wide-necked intracranial aneurysms:a single-center 11-year experience[J]. Radiology, 2015, 276: 545-552. DOI:10.1148/radiol.2015140974 |
| [10] |
YANG H, SUN Y, JIANG Y, LV X, ZHAO Y, LI Y, et al. Comparison of stent-assisted coiling vs coiling alone in 563 intracranial aneurysms:safety and efficacy at a high-volume center[J]. Neurosurgery, 2015, 77: 241-247. DOI:10.1227/NEU.0000000000000765 |
| [11] |
PIOTIN M, BLANC R, SPELLE L, MOUNAYER C, PIANTINO R, SCHMIDT P J, et al. Stent-assisted coiling of intracranial aneurysms:clinical and angiographic results in 216 consecutive aneurysms[J]. Stroke, 2010, 41: 110-115. DOI:10.1161/STROKEAHA.109.558114 |
| [12] |
李力, 段国礼, 赵瑞, 黄清海, 洪波, 刘建民, 等. 颅内未破裂动脉瘤介入治疗术后神经系统并发症的危险因素分析[J]. 第二军医大学学报, 2018, 39: 238-244. LI L, DUAN G L, ZHAO R, HUANG Q H, HONG B, LIU J M, et al. Risk factors of neurological complication after endovascular treatment of unruptured intracranial aneurysm[J]. Acad J Sec Mil Med Univ, 2018, 39: 238-244. |
| [13] |
BECHAN R S, SPRENGERS M E, MAJOIE C B, PELUSO J P, SLUZEWSKI M, VAN ROOIJ W J. Stent-assisted coil embolization of intracranial aneurysms:complications in acutely ruptured versus unruptured aneurysms[J]. Am J Neuroradiol, 2015, 37: 502-507. |
| [14] |
PIEROT L, COGNARD C, ANXIONNAT R, RICOLFI F; CLARITY Investigators. Ruptured intracranial aneurysms:factors affecting the rate and outcome of endovascular treatment complications in a series of 782 patients (CLARITY study)[J]. Radiology, 2010, 256: 916-923. DOI:10.1148/radiol.10092209 |
| [15] |
MITCHELL P J, MUTHUSAMY S, DOWLING R, YAN B. Does small aneurysm size predict intraoperative rupture during coiling in ruptured and unruptured aneurysms?[J]. J Stroke Cerebrovasc Dis, 2013, 22: 1298-1303. DOI:10.1016/j.jstrokecerebrovasdis.2012.10.017 |
| [16] |
LEE K M, JO K I, JEON P, KIM K H, KIM J S, HONG S C. Predictor and prognosis of procedural rupture during coil embolization for unruptured intracranial aneurysm[J]. J Korean Neurosurg Soc, 2016, 59: 6-10. DOI:10.3340/jkns.2016.59.1.6 |
| [17] |
DETMER F J, CHUNG B J, MUT F, SLAWSKI M, HAMZEI-SICHANI F, PUTMAN C, et al. Development and internal validation of an aneurysm rupture probability model based on patient characteristics and aneurysm location, morphology, and hemodynamics[J]. Int J Comput Assist Radiol Surg, 2018, 13: 1767-1779. DOI:10.1007/s11548-018-1837-0 |
| [18] |
MUTO M, GIURAZZA F, AMBROSANIO G, VASSALLO P, BRIGANTI F, TECAME M, et al. Stent-assisted coiling in ruptured cerebral aneurysms:multi-center experience in acute phase[J]. Radiol Med, 2017, 122: 43-52. DOI:10.1007/s11547-016-0686-6 |
| [19] |
ZHAO B, YANG H, ZHENG K, LI Z, XIONG Y, TAN X, et al. Preoperative and postoperative predictors of long-term outcome after endovascular treatment of poor-grade aneurysmal subarachnoid hemorrhage[J]. J Neurosurg, 2017, 126: 1764-1771. |
 2019, Vol. 40
2019, Vol. 40


