2. 喀什地区第一人民医院心内科, 喀什 844000;
3. 海军军医大学(第二军医大学)药学院海洋药物研究所, 上海 200433
2. Department of Cardiology, First People's Hospital of Kashgar Prefecture, Kashgar 844000, Xinjiang Uygur Autonomous Region, China;
3. Institute of Marine Drugs, School of Pharmacy, Naval Medical University(Second Military Medical University), Shanghai 200433, China
脱细胞真皮基质是一种由动物或人类皮肤制成的无细胞组织薄片,它保留了真皮的胶原成分和组织基本结构,同时也保留了基底膜成分,是目前最为理想的细胞微环境,已成为仿生型再生医疗产品开发和成果转化热点[1-2],并在创伤和烧伤修复、口腔医学、组织缺损等领域得以应用[3-6]。目前所用的脱细胞真皮基质材料主要来源于猪、牛等哺乳动物,但由于存在疯牛病、蓝耳病、口蹄疫等疾病的传播风险和宗教信仰等问题,探索开发鱼类来源的脱细胞基质材料作为新型真皮替代品变得越来越重要[1, 7]。鱼皮的蛋白质含量较鱼体的其他部位高,其胶原含量最高可占其蛋白质总量的8%以上[8-9]。本研究以5种鱼皮为原料制备脱细胞真皮基质,并对其进行生物安全性评价,以为筛选制备组织工程支架的鱼皮来源脱细胞真皮基质提供实验基础。
1 材料和方法 1.1 脱细胞鱼皮基质材料制备与处理马面鱼(Thamnaconus septentrionalis)、黑鱼(Channa argus)、鳗鱼(Anguillidae)、鲤鱼(Cyprinus carpio)、鲢鱼(Hypophthalmichthys molitrix)5种鱼皮原料均购自上海江阳水产批发交易市场,新鲜鱼皮刮除鱼肉、清洗干净后立即于-25 ℃冻存。将速冻鱼皮在常温下解冻后洗净风干,依次用0.1% NaOH溶液和3% H2O2溶液浸泡,脱色、脱脂并去除部分杂蛋白。首次浸泡5 h,待H2O2全部还原,取出鱼皮洗净,换液继续浸泡24 h后取出。鱼皮取出后用自来水冲洗至中性并沥干,用适量洗洁精揉搓后反复冲洗并沥干,此过程重复5次。再次用自来水冲洗干净后,用实验室配制的脱色液(甲醇:乙酸:水=25:8:67)浸泡24 h进一步脱色、脱脂、去杂蛋白。鱼皮取出后冲洗至中性,沥干水分,用适量洗洁精清洗5次,再用蒸馏水清洗3次,清洗完毕后置于蒸馏水中浸泡12 h,以去除鱼皮中残留的物质,整个过程重复3次。最后将鱼皮取出,沥干水分,铺盘冷冻干燥成膜。将制备好的鱼皮材料放置于真空干燥箱中,设置干燥箱温度为110 ℃,72 h后取出,即可完成交联,得到变性后的脱细胞鱼皮基质材料[10]。
将5种脱细胞鱼皮基质材料进行60Co消毒,依据国家标准GB/T 16886.5-2017[11]制备稀释浓度为10 g/L及标准浓度为100 g/L的浸提液(浸提液介质为含血清培养液),保存于4 ℃备用。
1.2 细胞提取、培养与鉴定人骨髓间充质干细胞(human bone marrow-derived mesenchymal stem cells,hBMSCs)提取自健康志愿者骨髓[实验方案经过医学研究伦理委员会批准(批准号:2009LL004;中国临床试验注册中心注册号:ChiCTR-ONRC-12002056)]。将提取的hBMSCs进行原代培养,传代至第3代用于实验[12]。在光学显微镜下观察hBMSCs的形态,根据hBMSCs的表面标志物(阳性标志物为CD90、CD73、CD105,阴性标志物为CD34、CD45)特点,采用流式细胞术检测相应抗体表达。
1.3 CCK-8法初步检测脱细胞鱼皮基质的细胞增殖毒性将hBMSCs以5×103/孔的密度接种于96孔板,用含血清的LG-DMEM培养液培养,待细胞贴壁后,实验组中加入100 μL/孔稀释浓度为10 g/L的脱细胞鱼皮基质材料浸提液继续培养,对照组中加入100 μL/孔含血清LG-DMEM培养液。在1、3、6 d时加入10 μL/孔CCK-8试剂(日本同仁化学研究所)并培养2.5 h,用酶标仪测定450 nm波长处的光密度(D)值,计算细胞存活率[细胞存活率(%)=(实验组D值-空白组D值)/(对照组D值-空白组D值)×100%],筛选出符合毒性标准的脱细胞鱼皮基质浸提液材料。将初步筛选出的无毒脱细胞鱼皮基质材料再以标准浓度为100 g/L浸提液进行CCK-8检测,步骤同上。
1.4 脱细胞鱼皮基质材料结构与成分观察将初步筛选的样品经真空干燥、表面喷金处理后,在扫描电镜(型号:MERLIN Compact,德国Carl Zeiss公司)下随机取不同位置观察脱细胞鱼皮基质材料表面结构。
为了观察所研究的脱细胞鱼皮基质材料是否完全脱细胞,对初步筛选出的脱细胞鱼皮基质材料进行H-E染色和Masson染色。H-E染色实验中,细胞核被苏木精染成鲜明的蓝色,软骨基质、钙盐颗粒呈深蓝色,黏液呈灰蓝色,细胞质呈深浅不同的粉红色至桃红色,蛋白性液体呈粉红色。Masson染色实验中,胶原纤维、黏液呈蓝色。
1.5 血液相容性实验参照国家标准GB/T 16886.4-2003[13]对初步筛选出的脱细胞鱼皮基质材料进行血液相容性实验。经志愿者同意后采集新鲜抗凝血,将稀释的抗凝血60 μL分别加入盛有3 mL脱细胞鱼皮基质材料浸提液、蒸馏水、生理盐水(即分别为实验组、阴性对照组、阳性对照组)的试管中,37 ℃恒温水浴锅中水浴1 h。之后离心取上清液,用722s型可见分光光度计于545 nm波长处测定各组的D值。溶血率计算公式:溶血率(%)=(实验组D值-阴性对照组D值)/(阳性对照组D值-阴性对照组D值)×100%。
1.6 细胞Live/Dead存活分析将hBMSCs以2×104/孔的密度接种于24孔板,用含血清培养液培养,待细胞贴壁后,实验组中加入0.5 mL标准浓度为100 g/L的脱细胞鱼皮基质材料浸提液,对照组中加入含血清培养液,培养48 h后加入Live/Dead试剂(美国艾美捷公司)在37 ℃下孵育15 min对细胞进行染色,荧光显微镜下观察细胞存活情况。绿色标记为健康正常的活细胞,红色标记为死细胞,死细胞和活细胞所得结果图整合后显示为黄红色。
1.7 细胞凋亡实验将hBMSCs以2×104/孔的密度接种于24孔板,用含血清培养液培养,待细胞贴壁后,实验组中加入0.5 mL标准浓度为100 g/L的脱细胞鱼皮基质材料浸提液,对照组中加入含血清培养液,培养48 h后用磷酸盐缓冲液冲洗2次,再用4%多聚甲醛溶液固定细胞15 min。采用TUNEL法标记凋亡细胞DNA片段,用标准荧光滤光片直接在荧光显微镜下观察,凋亡细胞在520 nm波长处显示绿色荧光、在460 nm波长处显示蓝色DAPI染色的细胞核。
将hBMSCs以约5×104/孔的密度接种于6孔板,用含血清培养液隔夜培养,待细胞贴壁后,将初步筛选的脱细胞鱼皮基质材料浸提液加入6孔板,2.5 mL/孔,培养24 h后收集所有细胞进行Annexin Ⅴ-FITC/PI染色,用流式细胞仪分析结果。
1.8 统计学处理应用SPSS 16.0软件进行统计学分析。计量资料以x±s表示,多组间比较采用单因素方差分析,两两比较采用Dunnett-t检验。检验水准(α)为0.05。
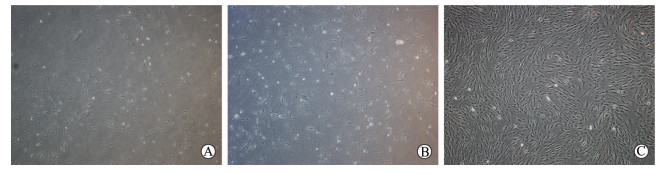
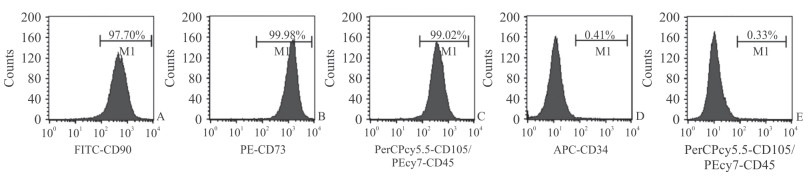
2 结果 2.1 细胞提取、鉴定结果提取的hBMSCs在显微镜下呈梭形,细胞核居中,细胞呈旋涡状排列(图 1)。细胞表面标志物CD90阳性率为97.70%,CD73阳性率为99.98%,CD105阳性率为99.02%,CD34阳性率为0.41%,CD45阳性率为0.33%(图 2)。由此可确认提取的细胞为纯度较高的hBMSCs。
|
图 1 hBMSCs生长形态观察 Fig 1 Morphological observation of hBMSCs The third generation of hBMSCs under the microscope. A: First day; B: Third day; C: Fifth day. hBMSCs: Human bone marrow-derived mesenchymal stem cells. Original magnification: ×100 |
|
图 2 流式细胞术检测hBMSCs表面标志物 Fig 2 Determination of hBMSCs surface markers by flow cytometry A: CD90; B: CD73; C: CD105; D: CD34; E: CD45. hBMSCs: Human bone marrow-derived mesenchymal stem cells |
2.2 脱细胞鱼皮基质材料细胞增殖毒性初步实验结果
CCK-8法检测结果显示,加入马面鱼和黑鱼脱细胞鱼皮基质材料浸提液培养1、3、6 d,hBMSCs活力与对照组相比差异无统计学意义(P>0.05),提示材料对细胞生长无抑制或促进作用。而其余3种材料均对hBMSCs有一定的抑制作用,培养6 d时其细胞活力与对照组相比差异有统计学意义(P<0.05)。见表 1。
|
|
表 1 5种脱细胞鱼皮基质材料浸提液(10 g/L)培养的hBMSCs增殖活力 Tab 1 Tab 1 Cell viability of hBMSCs in extracts of 5 kinds of acellular fish skin materials (10 g/L) |
依据国家标准GB/T 16886.5-2017[11],在稀释浓度10 g/L下马面鱼及黑鱼脱细胞鱼皮基质材料浸提液中细胞活性均>70%,而其他3种材料中细胞活性均<70%,表明只有马面鱼和黑鱼脱细胞鱼皮基质材料对细胞无毒,因此初步筛选出这两种材料用于后续研究。进一步检测结果显示,在标准浓度100 g/L下,加入马面鱼脱细胞鱼皮基质材料浸提液培养1、3、6 d,hBMSCs活力分别为(93.77±0.04)%、(96.05±0.01)%和(84.70±0.06)%,均>70%;加入黑鱼脱细胞鱼皮基质材料浸提液培养1、3、6 d,hBMSCs活力分别为(28.57±0.01)%、(14.18±0.01)%和(1.49±0.01)%,均<70%。结果表明只有马面鱼脱细胞鱼皮基质材料对细胞无毒。
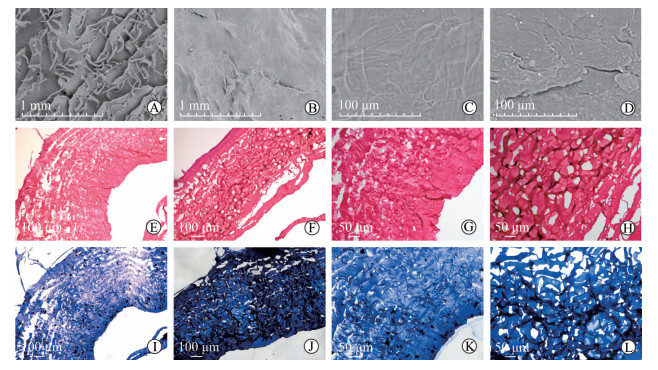
2.3 脱细胞鱼皮基质材料的结构与成分扫描电镜下可见马面鱼脱细胞鱼皮基质材料为双层结构,一面光滑、一面疏松多孔(图 3A、3C);黑鱼脱细胞鱼皮基质材料双层皆为平滑结构,几乎没有孔隙结构(图 3B、3D)。H-E染色结果显示马面鱼和黑鱼脱细胞鱼皮基质材料均为粉红色条状分布的胶原纤维,无蓝色标记出现(图 3E~3H),说明鱼皮中的细胞已去净,只剩脱细胞基质。Masson染色结果显示马面鱼和黑鱼脱细胞鱼皮基质材料均被染成蓝色,胶原纤维沿一定方向整齐排列,无紊乱和中断现象(图 3I~3L),说明材料经过脱细胞后胶原纤维结构保留完整。
|
图 3 脱细胞鱼皮基质材料结构和成分观察 Fig 3 Structure and constituents of acellular fish skin matrix materials A-D: Scanning electron microscope graphs (A: Rough surface of leather jacket fish skin acellular dermal matrix material; B: Rough surface of black fish skin acellular dermal matrix material; C: Smooth surface of leather jacket fish skin acellular dermal matrix material; D: Smooth surface of black fish skin acellular dermal matrix material); E-H: H-E staining (E, G: Leather jacket fish skin acellular dermal matrix material; F, H: Black fish skin acellular dermal matrix material); I-L: Masson staining (I, K: Leather jacket fish skin acellular dermal matrix material; J, L: Black fish skin acellular dermal matrix material) |
2.4 脱细胞鱼皮基质材料的血液相容性
溶血实验检测结果显示,马面鱼和黑鱼脱细胞鱼皮基质材料浸提液溶血率分别为(1.23±0.43)%和(6.35±0.47)%。马面鱼脱细胞鱼皮基质材料的溶血率远低于医用材料的国家标准(≤5%)[13],在国家生物材料的溶血性安全评价范围内;黑鱼脱细胞鱼皮基质材料溶血率>5%,对红细胞有破坏作用。
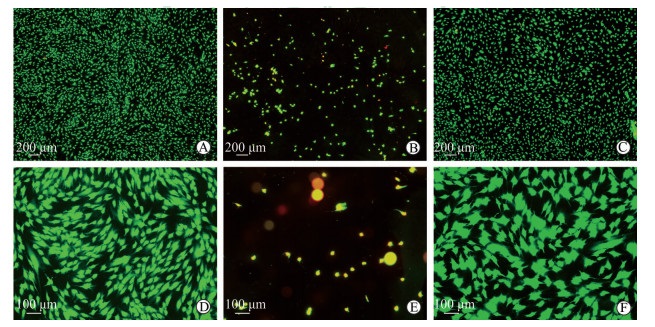
2.5 脱细胞鱼皮基质材料对细胞存活的影响荧光显微镜下可见经Live/Dead染色后,加入马面鱼脱细胞鱼皮基质材料浸提液培养的hBMSCs全部为绿色标记,几乎没有红色标记的细胞,且较对照组的密、多;加入黑鱼脱细胞鱼皮基质材料浸提液培养的细胞基本都被染成了黄红色,表明多数为死细胞(图 4)。说明马面鱼脱细胞鱼皮基质材料能够促进细胞生长且适合细胞生长,而黑鱼脱细胞鱼皮基质材料不适合细胞生长,易致细胞死亡。
|
图 4 Live/Dead法检测脱细胞鱼皮基质材料浸提液对hBMSCs存活的影响 Fig 4 Effect of acellular fish skin matrix material extract on the survival of hBMSCs by Live/Dead assay A, D: Leather jacket fish skin acellular dermal matrix material; B, E: Black fish skin acellular dermal matrix material; C, F: Control group. hBMSCs: Human bone marrow-derived mesenchymal stem cells |
2.6 脱细胞鱼皮基质材料对细胞凋亡的影响
TUNEL法检测结果显示,马面鱼脱细胞鱼皮基质材料浸提液中的凋亡细胞数远少于黑鱼脱细胞鱼皮基质材料,活细胞数与对照组差别不明显(图 5)。流式细胞术检测结果显示,马面鱼脱细胞鱼皮基质材料浸提液组、黑鱼脱细胞鱼皮基质材料浸提液组及对照组的细胞死亡率分别为(0.67±0.01)%、(37.25±0.01)%、(0.89%±0.01)%,细胞凋亡率分别为(3.74±0.01)%、(1.04±0.61)%、(2.54±0.01)%(图 6)。可见黑鱼鱼皮基质材料浸提液组细胞死亡率远超出正常范围(≤15%),而马面鱼鱼皮基质材料浸提液组细胞死亡率低,说明马面鱼鱼皮基质材料更适合细胞生长。

|
图 5 TUNEL法检测脱细胞鱼皮基质材料浸提液对hBMSCs凋亡的影响 Fig 5 Effect of acellular fish skin matrix material extract on the apoptosis of hBMSCs by TUNEL assay A, D, G: Leather jacket fish skin acellular dermal matrix material; B, E, H: Black fish skin acellular dermal matrix material; C, F, I: Control group. A-C: TUNEL; D-F: DAPI; G-I: Merged. hBMSCs: Human bone marrow-derived mesenchymal stem cells. Original magnification: ×200 |
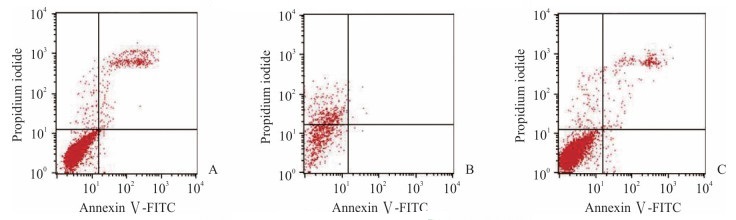
|
图 6 流式细胞术检测脱细胞鱼皮基质材料浸提液对hBMSCs凋亡的影响 Fig 6 Effect of acellular fish skin matrix material extract on the apoptosis of hBMSCs by flow cytometry A: Leather jacket fish skin acellular dermal matrix material; B: Black fish skin acellular dermal matrix material; C: Control group. hBMSCs: Human bone marrow-derived mesenchymal stem cells |
3 讨论
脱细胞真皮基质主要成分为胶原蛋白,自身抗原性很低,可在宿主体内长期存留并最终被降解,其作为一种生物材料相比人工合成材料因优良的生物学特性、人体较强的适应性和较少的并发症等优势在多学科领域得到广泛应用[14-15]。
本研究按照生物材料的生物学评价基本原则及国家标准[11]制备了5种鱼皮脱细胞真皮基质,以目前组织工程研究的热门种子细胞hBMSCs[16-17]检测其生物相容性。本研究根据国家标准分别制备出稀释浓度为10 g/L和标准浓度为100 g/L的浸提液,先用CCK-8法进行细胞毒性检测,对稀释浓度下脱细胞鱼皮基质材料进行初步筛选,结果显示只有马面鱼和黑鱼脱细胞鱼皮基质材料无毒。之后将筛选出的两种材料在标准浓度(100 g/L)下进行细胞增殖毒性实验,发现马面鱼脱细胞鱼皮基质材料对细胞无毒性,而黑鱼脱细胞鱼皮基质材料对细胞有毒性。
国内外目前还没有制备脱细胞鱼皮基质材料的统一标准。有2篇文献报道了脱细胞鱼皮基质制备的方法[18-19],但这两种方法有很大的不同。本研究的制备方法与上述亦有不同之处,因此在继续进行其他实验之前须对材料是否符合脱细胞基质材料的标准进行鉴定。从扫描电镜结果可以看出,马面鱼脱细胞鱼皮基质材料具备多孔孔隙结构,而黑鱼脱细胞鱼皮基质材料几乎为平滑无孔隙结构,说明马面鱼脱细胞鱼皮基质材料结构更接近理想的组织工程支架材料特点。H-E染色和Masson染色结果显示,制备的马面鱼和黑鱼鱼皮基质材料均无细胞核或其他细胞成分存在,说明所得材料确实是脱细胞鱼皮基质材料。材料内部疏松多孔结构有利于细胞的生长和黏附,本研究进行Live/Dead存活实验以及细胞凋亡实验的结果给予了进一步证实,即马面鱼脱细胞鱼皮基质材料浸提液中细胞存活率更高且具有促进细胞增长的趋势。这些结果也从一定程度上说明即使制备条件和交联条件相同,不同种类的脱细胞鱼皮基质材料结构也会影响材料对细胞的作用。
溶血率是血液相容性的一项重要指标。参照国家标准GB/T 16886.4-2003,医用材料溶血率应≤5%,若溶血率>5%则可认为该材料对红细胞有破坏作用[13]。本研究结果中马面鱼脱细胞鱼皮基质材料的溶血率远低于医用材料的国家标准,而黑鱼脱细胞鱼皮基质材料溶血率超过国家标准值,表明马面鱼脱细胞鱼皮基质材料可考虑作为医用材料来使用。
综上所述,本研究采用相同制备方法和交联条件制备了5种不同鱼类的脱细胞鱼皮基质材料,通过一系列生物相容性实验发现,马面鱼脱细胞鱼皮基质材料具有良好的细胞相容性及促进细胞增殖的作用,在5种材料中各项性能最佳,为进一步探究鱼皮源脱细胞真皮基质的应用奠定了良好的实验基础。虽然马面鱼脱细胞鱼皮基质材料的生物相容性及促细胞增殖作用较其他材料好,但相比对照组仍有差异。如果要把马面鱼脱细胞鱼皮基质材料应用到医疗领域中,还需更高的组织相容性和细胞相容性,我们将在后续的研究中继续对马面鱼等淡水鱼来源的脱细胞基质材料进行改进。
志谢 感谢海军军医大学(第二军医大学)细胞与生物学平台王越教授对实验中细胞提取及细胞实验方案提供的宝贵意见;感谢海军军医大学(第二军医大学)长海医院中心实验室提供细胞实验平台,以及稽柏尧老师对细胞培养及实验用品用法的指导和帮助。
| [1] |
TURNER N J, BADYLAK S F. The use of biologic scaffolds in the treatment of chronic nonhealing wounds[J]. Adv Wound Care (New Rochelle), 2015, 4: 490-500. DOI:10.1089/wound.2014.0604 |
| [2] |
位晓娟, 王南平, 何兰, 郭休玉, 顾其胜. 脱细胞鱼皮基质作为新型组织工程支架的研究进展[J]. 中国修复重建外科杂志, 2016, 30: 1437-1440. |
| [3] |
NEMETH N L, BUTLER C E. Complex torso reconstruction with human acellular dermal matrix:long-term clinical follow-up[J]. Plast Reconstr Surg, 2009, 123: 192-196. DOI:10.1097/PRS.0b013e3181934812 |
| [4] |
池朝玲, 王家盛, 张洪杰, 庞晓纲. 组织补片在腭裂修复术软组织缺损中的应用[J]. 临床口腔医学杂志, 2007, 23: 34-35. DOI:10.3969/j.issn.1003-1634.2007.01.013 |
| [5] |
殷艳丽, 王倩婷, 赵蕾. 脱细胞真皮基质用于牙周病学领域研究进展[J]. 中国实用口腔科杂志, 2014, 7: 434-439. DOI:10.7504/kq.2014.07.014 |
| [6] |
赵利敏, 张庆泉, 孙岩, 宋西城, 张华, 陈秀梅. 异种脱细胞真皮基质在鼻中隔缺损修复中的应用[J]. 山东大学耳鼻喉眼学报, 2009, 23: 31-32. |
| [7] |
DUAN R, ZHANG J, DU X, YAO X, KONNO K. Properties of collagen from skin, scale and bone of carp (Cyprinus carpio)[J]. Food Chemistry, 2009, 112: 702-706. DOI:10.1016/j.foodchem.2008.06.020 |
| [8] |
吴丹, 康怀彬, 肖枫. 鱼皮胶原蛋白研究进展[J]. 肉类研究, 2007(6): 23-25. DOI:10.3969/j.issn.1001-8123.2007.06.011 |
| [9] |
鸿巢章二, 桥本周久. 水产利用化学[M]. 北京: 中国农业出版社, 1994: 269.
|
| [10] |
陈彤, 夏凯, 吴刚, 祖丽皮也·阿不力克木, 朱庆丰, 王少海, 等. 一种新型巴沙鱼皮胶原支架材料的理化性能及体外降解性[J]. 第二军医大学学报, 2017, 38: 41-47. CHEN T, XIA K, WU G, ABLIKIM Z, ZHU Q F, WANG S H, et al. Physicochemical properties and in vitro degradation of a novel collagen scaffold material from Basa fish (Pangasisus haniltoa) skin[J]. Acad J Sec Mil Med Univ, 2017, 38: 41-47. |
| [11] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会.医疗器械生物学评价: 第5部分: 体外细胞毒性试验: GB/T 16886.5-2017/ISO 10993-5: 2009[S].北京: 中国标准出版社, 2017.
|
| [12] |
朱庆丰.鱼骨来源BCP多孔陶瓷骨支架的制备及性能研究[D].上海: 海军军医大学, 2018.
|
| [13] |
中华人民共和国国家质量监督检验检疫总局.医疗器械生物学评价: 第4部分: 与血液相互作用试验选择: GB/T 16886.4-2003[S].北京: 中国标准出版社, 2003.
|
| [14] |
史新立. 脱细胞真皮基质材料的研究及应用[J]. 透析与人工器官, 2009, 20: 34-40. |
| [15] |
薛松, 刘昶, 纪艳超, 万会魁, 崔磊, 姜龙. 骨髓间充质干细胞在脱细胞真皮基质再生过程中的初步研究[J]. 现代生物医学进展, 2015, 15: 998-1000. |
| [16] |
SULTANA N, SINGH M, NAWAL R R, CHAUDHRY S, YADAV S, MOHANTY S, et al. Evaluation of biocompatibility and osteogenic potential of tricalcium silicate-based cements using human bone marrow-derived mesenchymal stem cells[J]. J Endod, 2018, 44: 446-451. DOI:10.1016/j.joen.2017.11.016 |
| [17] |
MCGRAIL D J, MCANDREWS K M, DAWSON M R. Biomechanical analysis predicts decreased human mesenchymal stem cell function before molecular differences[J]. Exp Cell Res, 2013, 319: 684-696. DOI:10.1016/j.yexcr.2012.11.017 |
| [18] |
王月坤, 侯虎, 张凯, 刘晗, 司磊磊, 李八方. 巴沙鱼皮脱细胞真皮基质的制备及生物相容性评价[J]. 材料科学, 2018, 8: 346-354. |
| [19] |
SIGURJONSSON G F, GISLADOTTIR D H, GUDMUNDSSON G. Scaffold material for wound care and/or other tissue healing applications: US8613957[P]. 2013-12-24.
|
 2019, Vol. 40
2019, Vol. 40


