2. 海军军医大学(第二军医大学)东方肝胆外科医院肝外六科, 上海 200438
2. Department of Hepatic Surgery(Ⅵ), Eastern Hepatobiliary Surgery Hospital, Naval Medical University(Second Military Medical University), Shanghai 200438, China
原发性肝癌是消化系统中常见的恶性肿瘤之一,其中90%以上为肝细胞癌(hepatocellular carcinoma,HCC)[1-2]。HCC是全世界第6位常见的恶性肿瘤和第2位致死癌症[3]。据2018年世界卫生组织(World Health Organization,WHO)全球癌症报告数据显示,2018年肝癌新增病例约84万人,死亡约78万人,发病人数与死亡人数比例接近1:1[4]。在我国,肝癌是第4位常见恶性肿瘤,其死亡率位居恶性肿瘤的第2位[5]。乙型肝炎病毒(hepatitis B virus,HBV)感染是诱发肝癌的主要病因[6-7]。目前肝癌的主要治疗方法仍然是以外科根治性手术切除为主,但术后复发率和转移率仍然较高,术后5年复发率高达50%,5年生存率仅为18%[8-9]。近年来,研究者们在HBV相关的肝癌研究中发现,HBV X基因编码的X蛋白(hepatitis B virus X protein,HBx)通过协调和激活具有不同作用的功能性蛋白及其靶基因,在肝癌的发生、发展中发挥重要的作用[10-11]。HBx的突变体在诱发肝细胞癌变的过程中具有重要作用,在HBV相关性HCC患者肝癌组织中频繁检测出羧基末端截短型HBx蛋白(carboxylic acid-terminal truncated HBx,Ct-HBx)[12]。Ct-HBx表现出抑制细胞凋亡、调控细胞周期、促进细胞增殖的作用及增强HBx反式激活的功能,更容易引起活动性肝炎等肝脏疾病和HCC的发生[13]。本研究采用回顾性队列研究方法分析HBV相关性HCC患者肝癌组织和癌旁组织中Ct-HBx蛋白的表达情况,探讨其与HCC患者临床病理参数及术后预后的关系。
1 资料和方法 1.1 研究对象纳入2006年5月至2009年7月在海军军医大学(第二军医大学)东方肝胆外科医院行根治性切除手术的HBV相关性HCC患者及其手术样本。所有手术样本均经病理证实为HBV相关性HCC,其中肝癌组织样本462例,配对的癌旁组织样本263例,配对的癌栓组织样本25例。所有患者均具有完整的病例资料。本研究经过海军军医大学(第二军医大学)东方肝胆外科医院伦理委员会审批。
1.2 术后随访采取门诊复诊和电话等方式进行随访。患者术后每3个月进行甲胎蛋白(α-fetoprotein,AFP)、HBV DNA和肝功能检测,每6个月进行计算机断层扫描和(或)磁共振成像扫描检查诊断肿瘤是否复发和(或)转移。患者生存时间以患者死亡或终点随访日期为时间节点。随访终点时间截至2012年6月28日。
1.3 Ct-HBx蛋白检测采用两种抗体检测Ct-HBx蛋白,HBx-ab1小鼠抗人单克隆抗HBx抗体(美国Millipore公司)用于识别HBx蛋白第50~88位氨基酸,HBx-ab2兔抗人多克隆抗HBx抗体(武汉博士德生物工程有限公司)用于识别HBx蛋白第139~154位氨基酸。委托上海芯超生物科技有限公司设计并制作组织芯片。所有组织芯片连续切片(厚度为5 μm),采用链霉亲和素-生物素复合物(strept avidin-biotin complex,SABC)三步法进行免疫组织化学染色(试剂盒购自武汉博士德生物工程有限公司)。将切片脱蜡至水后,加入柠檬酸缓冲液进行高温高压修复15 min;用3%过氧化氢进行内源性过氧化物酶阻断;加入正常非免疫羊血清封闭10 min;除去血清,滴加一抗,4 ℃孵育过夜;滴加生物素标记的二抗,室温孵育10 min;滴加SABC试剂,室温孵育10 min;二氨基联苯胺(diaminobenzidine,DAB)显色,苏木精复染,脱水、透明、中性树胶封固。在光学显微镜下观察结果。
1.4 免疫组织化学染色结果判定免疫组织化学染色结果由1位病理学技师采用双盲法读片判定。HBx-ab1和HBx-ab2阳性表达呈棕黄色着色。参照Formwitz评分方法[14],分别进行阳性细胞计数评分和阳性细胞染色强度评分。阳性细胞计数<5%或无阳性细胞记0分,阳性细胞计数为5%~25%记1分,阳性细胞计数为26%~50%记2分,阳性细胞计数为51%~75%记3分,阳性细胞计数>75%记4分;阳性细胞染色强度弱阳性记1分,中等阳性记2分,强阳性记3分。将以上2个指标的评分结果相乘得到最终评分,大于1分者定义为阳性表达。当HBx-ab1抗体呈阳性表达且HBx-ab2抗体呈阴性表达时表明肝癌细胞或肝细胞中Ct-HBx蛋白阳性表达;其他表达结果则为Ct-HBx蛋白阴性表达[15]。
1.5 统计学处理应用SPSS 17.0软件进行统计学分析。正态分布的计量资料以x±s表示;非正态分布的计量资料以中位数(下四分位数,上四分位数)表示,采用秩和检验进行比较。计数资料以例数和百分数表示,采用χ2检验进行比较。采用Cox风险回归模型分析HCC患者术后复发和死亡的独立危险因素。采用Kaplan-Meier法绘制生存曲线并计算生存率,采用log-rank检验进行生存分析。检验水准(α)为0.05。
2 结果 2.1 患者基本资料共纳入462例患者,其中男418例(90.48%),女44例(9.52%),男女比例为9.5:1;年龄范围为21~75岁,平均年龄为(48.65±9.74)岁。患者基本临床病理资料见表 1。
|
|
表 1 纳入患者的基本临床病理资料 Tab 1 General clinicopathological data of included patients |
2.2 Ct-HBx蛋白在肝癌组织和癌旁组织中的表达结果
HBx蛋白阳性表达定位于细胞质,仅小部分定位于细胞核。HBx-ab1大部分呈阳性表达,仅小部分呈阴性表达;HBx-ab2大部分呈阴性表达,仅小部分呈阳性表达。见图 1。肝癌组织中Ct-HBx蛋白表达阳性率为45.45%(210/462)。配对的肝癌组织和癌旁组织中Ct-HBx蛋白表达阳性率分别为43.73%(115/263)和11.79%(31/263),两组间Ct-HBx蛋白表达差异有统计学意义(χ2=66.90,P<0.05)。配对的肝癌组织和癌栓组织中Ct-HBx蛋白表达阳性率分别为40.00%(10/25)和64.00%(16/25),两组间Ct-HBx蛋白表达差异无统计学意义(χ2=2.89,P>0.05)。
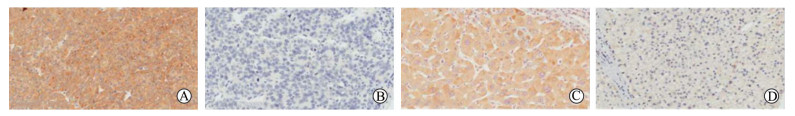
|
图 1 Ct-HBx蛋白在HCC患者肝癌组织和癌旁组织中的表达 Fig 1 Expression of Ct-HBx protein in HCC tissues and adjacent tissues Immunohistochemistry for HBx-ab1 and HBx-ab2 were detected. Positive for HBx-ab1 and negative for HBx-ab2 indicated the presence of Ct-HBx. A: Positive expression of HBx-ab1 in HCC tissues; B: Negative expression of HBx-ab2 in HCC tissues; C: Positive expression of HBx-ab1 in adjacent tissues; D: Negative expression of HBx-ab2 in adjacent tissues. Ct-HBx: Carboxylic acid-terminal truncated hepatitis B virus X protein; HCC: Hepatocellular carcinoma. Original magnification: ×200 |
2.3 HCC患者术后预后的危险因素分析
以复发率和生存率为因变量、临床病理参数为自变量进行单因素Cox风险回归模型分析,结果显示,年龄、门静脉癌栓、乙型肝炎e抗原(hepatitis B e antigen,HBeAg)、术前丙氨酸转氨酶(alanine transaminase,ALT)、术前天冬氨酸转氨酶(aspartate aminotransferase,AST)、术前AFP、肿瘤大小、主瘤旁微小子灶、癌巢内血管癌栓、肿瘤分化程度、肝硬化程度、术前巴塞罗那临床肿瘤(Barcelona Clinic Liver Cancer,BCLC)分期、术后抗病毒治疗均是HCC患者术后肿瘤复发的危险因素(P均<0.05);性别、年龄、门静脉癌栓、HBeAg、术前ALT、术前AST、术前总胆红素、术前AFP、肿瘤大小、肿瘤包膜、主瘤旁微小子灶、癌巢内血管癌栓、肿瘤分化程度、肝硬化程度、术前BCLC分期、术后抗病毒治疗和Ct-HBx蛋白表达均是HCC患者术后生存的危险因素(P均<0.05)。见表 2。
|
|
表 2 影响HCC患者术后肿瘤复发和生存的单因素Cox风险回归模型分析 Tab 2 Univariate Cox regression analysis of factors associated with postoperative HCC recurrence and survival of HCC patients |
将单因素分析有统计学意义的自变量进行多因素Cox风险回归模型分析,采用向前逐步剔除法进行筛选,结果显示年龄、门静脉癌栓、术前AST、术前AFP、主瘤旁微小子灶、术前BCLC分期和术后抗病毒治疗是HCC患者术后复发的独立危险因素(P均<0.05),门静脉癌栓、术前AFP、肿瘤包膜、术前BCLC分期和Ct-HBx蛋白表达是HCC患者术后生存的独立危险因素(P均<0.05)。见表 3。
|
|
表 3 影响HCC患者术后肿瘤复发和生存的多因素Cox风险回归模型分析 Tab 3 Multivariate Cox regression analysis of factors associated with postoperative HCC recurrence and survival of HCC patients |
2.4 Ct-HBx蛋白表达与HCC患者临床病理参数的关系
在462例HCC患者肝癌组织中,Ct-HBx蛋白表达阳性组和Ct-HBx蛋白表达阴性组男女比例分别为182:28和236:16,两组间差异有统计学意义(P=0.01);BCLC分期0/A期和B/C期患者比例分别为31:179和56:196,两组间差异有统计学意义(P=0.04);术后未接受抗病毒治疗和接受抗病毒治疗患者比例分别为177:33和191:61,两组间差异有统计学意义(P=0.02)。在263对配对的肝癌组织和癌旁组织样本中,肝癌组织中Ct-HBx蛋白表达阳性组和Ct-HBx蛋白表达阴性组男女比例分别为98:17和140:8,两组间差异有统计学意义(P=0.01);CA19-9水平分别为19.10(10.60,36.30)和16.40(8.50,29.73)kU/L,两组间差异有统计学意义(P=0.04);术后未接受抗病毒治疗和接受抗病毒治疗患者比例分别为82:33和87:61,两组间差异有统计学意义(P=0.04)。癌旁组织中Ct-HBx蛋白的表达与临床病理参数均无明显关系(P>0.05)。在25对配对的肝癌组织和癌栓组织样本中,Ct-HBx蛋白的表达与临床病理参数均无明显关系(P>0.05)。
根据Ct-HBx蛋白在肝癌组织和癌旁组织中的表达情况,将所有患者分为4组:(1)癌组织(-)癌旁组织(-);(2)癌组织(+)癌旁组织(-);(3)癌组织(+)癌旁组织(+);(4)癌组织(-)癌旁组织(+)。经组间临床病理参数对比分析,结果显示癌组织(-)癌旁组织(-)组和癌组织(+)癌旁组织(-)组在性别上差异有统计学意义(P=0.01);癌组织(-)癌旁组织(-)组和癌组织(+)癌旁组织(+)组在HBeAg上差异有统计学意义(P=0.04);癌组织(+)癌旁组织(+)组和癌组织(-)癌旁组织(+)组在术前HBV DNA上差异有统计学意义(P=0.02);癌组织(-)癌旁组织(-)组和癌组织(+)癌旁组织(+)组、癌组织(-)癌旁组织(-)组和癌组织(-)癌旁组织(+)组、癌组织(+)癌旁组织(-)组和癌组织(-)癌旁组织(+)组在肿瘤分化程度上差异有统计学意义(P=0.04、0.04、0.04)。见表 4。
|
|
表 4 肝癌组织和癌旁组织中Ct-HBx蛋白表达与HCC患者临床病理参数的关系 Tab 4 Relationship between Ct-HBx expression in HCC tissues and adjacent tissues and clinicopathological data of HCC patients |
2.5 Ct-HBx蛋白表达与HCC患者术后预后的关系
HCC患者术后随访时间为12~60个月,中位随访时间为36个月。行HCC根治切除术后,肝癌组织中Ct-HBx蛋白阳性表达组和阴性表达组3年总生存率分别为27.80%和34.00%,差异无统计学意义(P=0.34);3年无瘤生存率分别为12.30%和11.00%,差异无统计学意义(P=0.77)。癌组织(-)癌旁组织(-)组与癌组织(-)癌旁组织(+)组3年总生存率差异无统计学意义(P=0.06),3年无瘤生存率差异有临界统计学意义(P=0.050 1);癌组织(+)癌旁组织(+)组与癌组织(+)癌旁组织(-)组3年总生存率和无瘤生存率差异均无统计学意义(P=0.73、0.72)。见图 2。
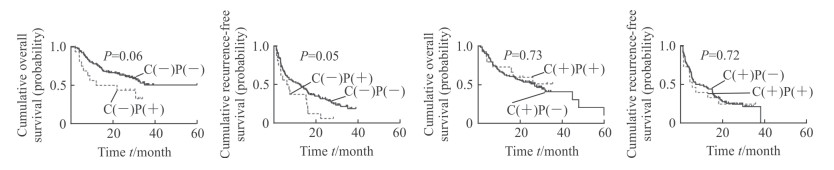
|
图 2 Kaplan-Meier生存曲线分析Ct-HBx蛋白表达与HCC患者术后生存的关系 Fig 2 Kaplan-Meier analysis of relationship between Ct-HBx protein expression and postoperative survival of HCC patients C (-) P (+): Carcinoma tissue negative and para-carcinoma tissue positive; C (-) P (-): Carcinoma tissue negative and para-carcinoma tissue negative; C (+) P (-): Carcinoma tissue positive and para-carcinoma tissue negative; C (+) P (+): Carcinoma tissue positive and para-carcinoma tissue positive; Ct-HBx: Carboxylic acid-terminal truncated hepatitis B virus X protein; HCC: Hepatocellular carcinoma |
3 讨论
HBV感染是HCC的主要危险因素,HBx基因突变在HCC发生、发展过程中逐渐累积,与HCC的发生及预后密切相关[16]。HBx基因可整合入宿主细胞基因组,从而引起宿主基因组的不稳定,并形成HBx基因的3′末端缺失突变,导致Ct-HBx蛋白在肝癌组织中过表达。Ct-HBx能起到促进细胞增殖及抑制细胞凋亡的作用,从而促进细胞癌变[17]。Li等[18]报道,Ct-HBx蛋白在肝癌组织中的表达较癌旁组织更为常见。本研究结果显示,Ct-HBx蛋白在肝癌组织和癌旁组织中均有表达,且肝癌组织中Ct-HBx蛋白的表达阳性率高于癌旁组织,实验结果与上述研究结果[18]相符。
本研究多因素Cox风险回归模型分析结果显示,门静脉癌栓、术前AST、术前AFP、主瘤旁微小子灶和术前BCLC分期是HCC患者术后复发的独立危险因素,年龄和术后抗病毒治疗是术后复发的保护因素;门静脉癌栓、术前AFP、肿瘤包膜、术前BCLC分期和Ct-HBx蛋白表达是HCC患者术后生存的独立危险因素。其他临床病理参数均不是患者术后预后的独立危险因素。已有研究发现肿瘤因素(如有无门静脉癌栓、肿瘤数目、肿瘤大小、有无肿瘤包膜、肿瘤分化程度、肝纤维化程度等)、宿主因素(如性别、年龄、肝功能等)和治疗手段(抗病毒治疗等)为HCC患者术后预后的独立危险因素[19]。本研究结果与上述研究结果[19]有一定差异,部分临床病理参数未被验证与患者术后预后相关,这可能与样本的选择偏倚和较小的样本数量有关,因此对预后影响因素需要进一步研究探讨。本研究发现Ct-HBx蛋白表达与HCC患者的术后预后有关,可独立预测患者的术后生存期。吴忱思等[20]发现,HBx基因中的5个突变位点(1329、1341、1381、1461、1485)为HCC患者术后预后相关的独立危险因素,这在一定程度上解释了本研究结果的合理性。
Ct-HBx蛋白有明显的抑制肝癌细胞凋亡、促进细胞增殖和侵袭作用[21-22],并能促进细胞恶性转化[23]。因此Ct-HBx蛋白与肿瘤的恶性生物学行为密切相关。本研究通过分析Ct-HBx蛋白表达与HCC患者临床病理参数的关系,发现Ct-HBx蛋白在肝癌组织中的表达与性别、术前BCLC分期和术后抗病毒治疗有关。应用配对的肝癌组织和癌旁组织样本分析发现,Ct-HBx蛋白在肝癌组织中的表达与性别、CA19-9和术后抗病毒治疗有关。Li等[18]发现,肝癌组织中Ct-HBx的表达与年龄、性别、AFP、肝硬化、肿瘤数目、肿瘤大小、肿瘤包膜、肿瘤分化、癌巢内血管癌栓均无相关性。本实验结果与之不符。据报道,雄激素通过增强HBV DNA的复制和转录促进HCC的发生[24],而女性体内雄激素水平较低,本研究结果显示女性HCC患者有较高的Ct-HBx蛋白阳性表达比例,具体机制尚不清楚。推测可能的原因是P53突变导致雌激素受体水平下降,从而致使雌激素的保护作用减弱,使得HBV整合增多而引起Ct-HBx蛋白表达增多[25-26]。多数BCLC分期为B、C期的患者存在肿瘤数目较多、肿瘤直径较大的病理特征[27],间接表明患者肝脏内存有较大面积及数量的癌组织,而肝癌组织中Ct-HBx蛋白过表达,因此本研究肝癌组织中Ct-HBx阳性表达的BCLC B、C期患者所占比例较高。肿瘤标志物CA19-9的存在和量变通常提示肿瘤的发生和分化[28],而肿瘤的复发和转移导致Ct-HBx蛋白表达增多,因此本研究肝癌组织中Ct-HBx蛋白阳性表达的CA19-9异常患者所占比例较高。抗病毒治疗具有增强病毒清除和抑制病毒复制的作用,从而抑制HCC的发生和发展[29],进而降低Ct-HBx蛋白的表达,因此本研究肝癌组织中Ct-HBx蛋白阳性表达的未接受抗病毒治疗的患者所占比例较高。本研究分组分析发现,Ct-HBx蛋白在癌和癌旁组织中的表达情况分别与性别和肿瘤分化程度有关。由于样本的选择偏倚和较小的样本数量,其他病理参数与Ct-HBx表达的关系有待进一步研究。
本研究生存分析结果显示,肝癌组织中Ct-HBx蛋白阳性表达组和阴性表达组3年总生存率和无瘤生存率差异均无统计学意义;癌和癌旁组织均为阴性表达组术后3年无瘤生存率高于癌组织阴性表达且癌旁组织阳性表达组(P=0.050 1),即当Ct-HBx蛋白在肝癌组织阴性表达时,Ct-HBx蛋白在癌旁组织中的阳性表达可能降低无瘤生存率。由于Ct-HBx蛋白可促进细胞增殖和恶性转化[21-23],推测当癌旁组织中Ct-HBx过表达时,可能促进肝细胞过度增殖和恶性转化,促使肿瘤复发。因此,可通过分析癌旁组织中Ct-HBx蛋白的表达情况,推测HCC患者术后体内剩余肝脏组织Ct-HBx蛋白的表达情况,判断残留HCC的增殖情况及引发患者术后肿瘤复发的可能性,从而预测患者术后的生存情况。此外,本研究还发现Ct-HBx蛋白在癌和癌旁组织均为阳性表达组与在癌组织阳性表达且癌旁组织阴性表达组3年总生存率和无瘤生存率差异均无统计学意义,但由于样本数量较小(癌和癌旁组织均为阳性表达的患者病例仅15例),该结论仍有待进一步验证。
综上所述,Ct-HBx蛋白表达是患者术后生存的独立危险因素。当肝癌组织中Ct-HBx蛋白阴性表达时,癌旁组织中Ct-HBx蛋白的表达情况可能与HCC患者术后预后有关,可作为预测术后肿瘤生存和复发的分子标志物。本研究存在一定的局限性,后续我们将收集更多的样本对本研究结果进行补充验证。
| [1] |
SIEGEL R, MA J, ZOU Z, JEMAL A. Cancer statistics, 2014[J]. CA Cancer J Clin, 2014, 64: 9-29. DOI:10.3322/caac.21208 |
| [2] |
WALLACE M C, PREEN D, JEFFREY G P, ADAMS L A. The evolving epidemiology of hepatocellular carcinoma:a global perspective[J]. Expert Rev Gastroenterol Hepatol, 2015, 9: 765-779. DOI:10.1586/17474124.2015.1028363 |
| [3] |
CHOO S P, TAN W L, GOH B K P, TAI W M, ZHU A X. Comparison of hepatocellular carcinoma in Eastern versus Western populations[J]. Cancer, 2016, 122: 3430-3446. DOI:10.1002/cncr.v122.22 |
| [4] |
BRAY F, FERLAY J, SOERJOMATARAM I, SIEGEL R L, TORRE L A, JEMAL A. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68: 394-424. DOI:10.3322/caac.v68.6 |
| [5] |
陈万青, 孙可欣, 郑荣寿, 张思维, 曾红梅, 邹小农, 等. 2014年中国分地区恶性肿瘤发病和死亡分析[J]. 中国肿瘤, 2018, 27: 1-14. |
| [6] |
ZHU R X, SETO W K, LAI C L, YUEN M F. Epidemiology of hepatocellular carcinoma in the Asia-Pacific region[J]. Gut Liver, 2016, 10: 332-339. |
| [7] |
LI Y, CHANG S C, GOLDSTEIN B Y, SCHEIDER W L, CAI L, YOU N C, et al. Green tea consumption, inflammation and the risk of primary hepatocellular carcinoma in a Chinese population[J]. Cancer Epidemiol, 2011, 35: 362-368. DOI:10.1016/j.canep.2011.01.005 |
| [8] |
KULIK L M, CHOKECHANACHAISAKUL A. Evaluation and management of hepatocellular carcinoma[J]. Clin Liver Dis, 2015, 19: 23-43. DOI:10.1016/j.cld.2014.09.002 |
| [9] |
AHN S M, JANG S J, SHIM J H, KIM D, HONG S M, SUNG C O, et al. Genomic portrait of resectable hepatocellular carcinomas:implications of RB1 and FGF19 aberrations for patient stratification[J]. Hepatology, 2014, 60: 1972-1982. DOI:10.1002/hep.v60.6 |
| [10] |
AL-QAHTANI A A, AL-ANAZI M R, NAZIR N, GHAI R, ABDO A A, SANAI F M, et al. Hepatitis B virus (HBV) X gene mutations and their association with liver disease progression in HBV-infected patients[J]. Oncotarget, 2017, 8: 105115-105125. |
| [11] |
SHIH C, YANG C C, CHOIJILSUREN G, CHANG C H, LIOU A T. Hepatitis B virus[J]. Trends Microbiol, 2018, 26: 386-387. DOI:10.1016/j.tim.2018.01.009 |
| [12] |
CHEN Z, TANG J, CAI X, HUANG Y, GAO Q, LIANG L, et al. HBx mutations promote hepatoma cell migration through the Wnt/β-catenin signaling pathway[J]. Cancer Sci, 2016, 107: 1380-1389. DOI:10.1111/cas.2016.107.issue-10 |
| [13] |
林丛, 杨冬, 姜颖, 贺福初. HBx参与肝细胞癌发生发展调控的分子机制[J]. 中国生物化学与分子生物学报, 2013, 29: 704-710. |
| [14] |
SILLEM M, HAHN U, CODDINGTON C C 3rd, GORDON K, RUNNEBAUM B, HODGEN G D. Ectopic growth of endometrium depends on its structural integrity and proteolytic activity in the cynomolgus monkey (Macaca fascicularis) model of endometriosis[J]. Fertil Steril, 1996, 66: 468-473. DOI:10.1016/S0015-0282(16)58521-5 |
| [15] |
YIN J, LI N, HAN Y, XUE J, DENG Y, SHI J, et al. Effect of antiviral treatment with nucleotide/nucleoside analogs on postoperative prognosis of hepatitis B virus-related hepatocellular carcinoma:a two-stage longitudinal clinical study[J]. J Clin Oncol, 2013, 31: 3647-3655. DOI:10.1200/JCO.2012.48.5896 |
| [16] |
侯晓玫.突变型HBx在HCC发生发展中的致癌作用及机制研究[D].上海: 第二军医大学, 2017.
|
| [17] |
张倩倩, 李卫华, 李慧, 张志翔, 卫建筠. 羧基端截短乙肝病毒x蛋白和加帽蛋白B在肝癌组织中的表达及临床意义[J]. 广州医科大学学报, 2017, 45: 1-5. |
| [18] |
LI W, LI M, LIAO D, LU X, GU X, ZHANG Q, et al. Carboxyl-terminal truncated HBx contributes to invasion and metastasis via deregulating metastasis suppressors in hepatocellular carcinoma[J]. Oncotarget, 2016, 7: 55110-55127. |
| [19] |
蔡庆. 145例肝细胞癌根治性切除术后复发相关因素的临床分析[D].广州: 南方医科大学, 2016.
|
| [20] |
吴忱思, 吴建华, 赵乐, 王英南, 张瑞星. HBV X区基因突变与原发性肝癌预后的关系[J]. 河北医科大学学报, 2018, 39: 508-513. DOI:10.3969/j.issn.1007-3205.2018.05.004 |
| [21] |
NG K Y, CHAI S, TONG M, GUAN X Y, LIN C H, CHING Y P, et al. C-terminal truncated hepatitis B virus X protein promotes hepatocellular carcinogenesis through induction of cancer and stem cell-like properties[J]. Oncotarget, 2016, 7: 24005-24017. |
| [22] |
HUANG Y, TAI A W, TONG S, LOK A S. HBV core promoter mutations promote cellular proliferation through E2F1-mediated upregulation of S-phase kinase-associated protein 2 transcription[J]. J Hepatol, 2013, 58: 1068-1073. DOI:10.1016/j.jhep.2013.01.014 |
| [23] |
刘晓红, 朱明华, 曹晓哲, 郑建明, 陈颖. HBx蛋白羧基端缺失对肝癌细胞生物学行为的影响[J]. 癌症, 2005, 24: 1213-1219. |
| [24] |
CHIU C M, YEH S H, CHEN P J, KUO T J, CHANG C J, CHEN P J, et al. Hepatitis B virus X protein enhances androgen receptor-responsive gene expression depending on androgen level[J]. Proc Natl Acad Sci USA, 2007, 104: 2571-2578. DOI:10.1073/pnas.0609498104 |
| [25] |
LI C L, YEH K H, LIU W H, CHEN C L, CHEN D S, CHEN P J, et al. Elevated p53 promotes the processing of miR-18a to decrease estrogen receptor-α in female hepatocellular carcinoma[J]. Int J Cancer, 2015, 136: 761-770. DOI:10.1002/ijc.29052 |
| [26] |
LI C L, LI C Y, LIN Y Y, HO M C, CHEN D S, CHEN P J, et al. Androgen receptor enhances hepatic telomerase reverse transcriptase gene transcription after hepatitis B virus integration or point mutation in promoter region[J]. Hepatology, 2019, 69: 498-512. DOI:10.1002/hep.30201 |
| [27] |
BRUIX J, SHERMAN M; Practice Guidelines Committee, American Association for the Study of Liver Diseases. Management of hepatocellular carcinoma[J]. Hepatology, 2005, 42: 1208-1236. DOI:10.1002/hep.v42:5 |
| [28] |
陆国飞, 黄振鹏, 梁健, 邓鑫. 肿瘤标志物在消化系统恶性肿瘤诊断中的应用研究进展[J]. 湖南中医杂志, 2016, 32: 174-176. |
| [29] |
杨帆, 刘文斌, 陈蕾, 谭晓洁, 曹广文. 抗乙肝病毒治疗对肝细胞癌进化发育过程的阻滞作用[J]. 第二军医大学学报, 2014, 35: 1293-1298. YANG F, LIU W B, CHEN L, TAN X J, CAO G W. Anti-HBV treatment delays development and evolution of HCC[J]. Acad J Sec Mil Med Univ, 2014, 35: 1293-1298. |
 2019, Vol. 40
2019, Vol. 40


