2. 上海中冶医院心血管内科, 上海 200941
2. Department of Cardiovasology, Shanghai Zhongye Hospital, Shanghai 200941, China
缺血性心肌病是威胁人类健康的主要原因,心肌缺血可导致心肌细胞凋亡,研究显示心肌细胞凋亡参与了心肌梗死后心室重构、心功能不全[1],而抑制心肌细胞凋亡可改善心肌梗死后心功能不全[2]。细胞凋亡受包括P53和线粒体信号通路在内的多种信号通路的调控[3]。既往研究显示Wnt/β-catenin信号通路在心脏疾病中起重要作用,在血管紧张素Ⅱ诱导的心肌肥厚模型中,Wnt1、Wnt2、Wnt2b、Wnt3、Wnt3a、Wnt5a、Wnt5b、Wnt9a、β-连环蛋白(β-catenin)的mRNA表达水平均升高,提示Wnt/β-catenin信号通路被激活[4]。然而,关于P53及Wnt/β-catenin信号通路在心肌缺血环境下的变化尚不完全清楚。本研究应用CCK-8法、5-乙炔基-2’-脱氧尿苷(5-ethynyl-2’-deoxyuridine,EdU)实验检测血清剥夺对心肌细胞增殖的影响,应用流式细胞术检测血清剥夺对心肌细胞凋亡及线粒体膜电位的影响,应用蛋白质印迹法检测血清剥夺对心肌细胞中P53及Wnt/β-catenin信号通路的影响,以揭示血清剥夺对心肌细胞增殖和凋亡的影响及可能的机制,为寻找干预心肌缺血的靶点提供可能的方向。
1 材料和方法 1.1 细胞培养与实验分组人心肌细胞AC16由海军军医大学(第二军医大学)长海医院心血管内科实验室提供,用含10%胎牛血清(fetal bovine serum,FBS)的DMEM培养液在培养箱中贴壁传代培养,培养条件为37 ℃、5% CO2。待细胞达到85%融合后,用胰酶消化,将细胞分为血清剥夺组(细胞在无FBS的DMEM培养液中培养)、对照组(细胞在含10% FBS的DMEM培养液中培养)并继续培养48 h。
1.2 试剂CCK-8细胞活性检测试剂盒、EdU细胞增殖检测试剂盒、Annexin Ⅴ-FITC细胞凋亡检测试剂盒、线粒体膜电位检测试剂盒均购自碧云天生物技术公司。β-Actin、caspase-9、Bcl-2、P53、β-catenin抗体均购自碧云天生物技术公司。增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)、cyclin D1、Wnt5a、Axis抑制蛋白1(Axis inhibition protein 1,Axin1)、蓬乱蛋白2(dishevelled 2,Dvl2)、蓬乱蛋白3(dishevelled 3,Dvl3)、低密度脂蛋白受体相关蛋白6(low-density lipoprotein receptor-related protein 6,LRP6)抗体均购自美国Cell Signaling公司。FBS购自美国Gibco公司。
1.3 CCK-8法检测细胞生长活力细胞达到85%融合后,胰酶消化、计数,以每孔8×103个细胞的密度接种于96孔板并继续培养24 h。血清剥夺组于无FBS的DMEM培养液中继续培养48 h,对照组于含10% FBS的DMEM培养液中继续培养48 h。处理结束后,吸除原来培养液,每孔加入用DMEM配制的CCK-8溶液100 μL并继续于培养箱中孵育2 h,孵育结束后用酶标仪在450 nm波长处测定光密度(D)值。
1.4 EdU实验检测细胞增殖及DNA合成按照EdU细胞增殖检测试剂盒说明书进行操作。以每孔3×104个细胞的密度将细胞接种于24孔板并继续培养24 h,再经血清剥夺或正常培养48 h,然后加入20 μmol/L EdU工作液并于室温下继续孵育2 h,4%多聚甲醛室温下固定15 min,加入200 μL Click反应液室温避光孵育30 min,最后用Hoechst33342染料进行细胞核染色,荧光显微镜下拍照。采用ImageJ软件计算EdU阳性细胞百分比。
1.5 流式细胞术检测细胞凋亡以每孔2×105个细胞的密度将细胞接种于6孔板并继续培养24 h。细胞经血清剥夺或正常培养48 h后,按照Annexin Ⅴ-FITC细胞凋亡检测试剂盒说明书进行标记、室温避光孵育20 min,然后用流式细胞仪(CytoFLEX,美国Beckman Coulter公司)完成细胞凋亡水平的检测。
1.6 流式细胞术检测血清剥夺对线粒体膜电位影响以每孔2×105个细胞的密度将细胞接种于6孔板并继续培养24 h。细胞经血清剥夺或正常培养48 h后,吸除培养液,加入1 mL JC-1染色工作液继续于37 ℃培养箱中孵育20 min,然后用流式细胞术检测、分析线粒体膜电位水平。
1.7 蛋白质印迹分析用RIPA溶液提取细胞蛋白并行十二烷基硫酸钠聚丙烯酰胺凝胶电泳,经转膜、封闭等处理后,加入一抗在4 ℃下过夜孵育,加入辣根过氧化物酶标记的二抗室温孵育2 h,显色并拍照。用ImageJ软件量化分析条带灰度,以目的蛋白与内参蛋白的灰度值的比值代表蛋白相对表达量。
1.8 统计学处理应用GraphPad软件进行统计学分析。数据采用x±s表示,两组间比较采用两样本t检验。检验水准(α)为0.05。
2 结果 2.1 血清剥夺对人心肌细胞AC16增殖及DNA合成的影响人心肌细胞AC16经血清剥夺或正常培养48 h后,CCK-8实验结果显示,对照组D值为1.93±0.01,血清剥夺组D值为1.08±0.08,后者是前者的55.8%,两组比较差异有统计学意义(P<0.01)。人心肌细胞AC16经血清剥夺或正常培养48 h后,EdU实验检测结果见图 1。经ImageJ软件分析,对照组EdU阳性细胞百分比为(16.15±1.52)%,血清剥夺组EdU阳性细胞百分比为(10.61±0.21)%,血清剥夺组DNA合成水平下降为对照组的65.6%,两组比较差异有统计学意义(P<0.05)。
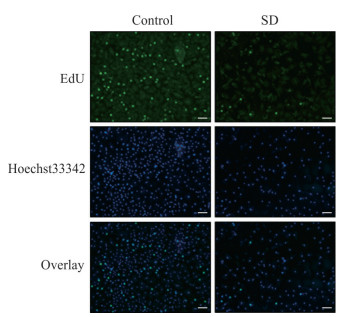
|
图 1 血清剥夺对人心肌细胞AC16 DNA合成的影响 Fig 1 Influence of serum deprivation on DNA synthesis of human cardiomyocytes AC16 SD: Serum-deprivation group. Scale bar=100 μm |
2.2 血清剥夺对人心肌细胞AC16凋亡的影响
人心肌细胞AC16经血清剥夺或正常培养48 h后,流式细胞术分析结果显示血清剥夺组细胞凋亡水平升高,其中对照组的细胞凋亡率为(6.34±0.47)%,血清剥夺组的细胞凋亡率为(56.83±1.90)%,后者是前者的8.9倍,两组比较差异有统计学意义(P<0.01)。见图 2。
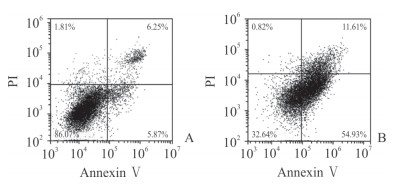
|
图 2 流式细胞术检测血清剥夺对人心肌细胞AC16凋亡的影响 Fig 2 Influence of serum deprivation on apoptosis of human cardiomyocytes AC16 by flow cytometry A: Control group; B: Serum-deprivation group. PI: Propidium iodide |
2.3 血清剥夺对人心肌细胞AC16线粒体膜电位的影响
人心肌细胞AC16经血清剥夺或正常培养48 h后,对照组中高线粒体膜电位细胞百分比为(65.25±1.45)%,血清剥夺组高线粒体膜电位细胞百分比为(54.97±4.33)%,血清剥夺组心肌细胞线粒体膜电位下降,但两组比较差异无统计学意义(P>0.05)。流式细胞术检测结果见图 3。
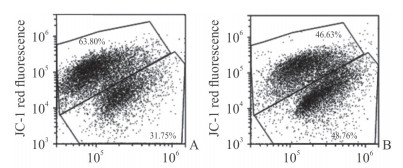
|
图 3 流式细胞术检测血清剥夺对人心肌细胞AC16线粒体膜电位的影响 Fig 3 Influence of serum deprivation on mitochondrial membrane potential of human cardiomyocytes AC16 by flow cytometry A: Control group; B: Serum-deprivation group |
2.4 血清剥夺对人心肌细胞AC16中P53信号通路的影响
人心肌细胞AC16经血清剥夺或正常培养48 h后,与对照组比较,血清剥夺组caspase-9蛋白表达水平升高了32.4%(0.58±0.01 vs 0.44±0.01,P<0.01)、Bcl-2蛋白表达水平降低了44.4%(0.15±0.01 vs 0.28±0.01,P<0.05),同时血清剥夺导致P53蛋白表达水平降低了29.7%(0.55±0.02 vs 0.78±0.03,P<0.05)、PCNA蛋白表达水平降低了42.1%(0.39±0.01 vs 0.68±0.01,P<0.01)、cyclin D1蛋白表达水平降低了40.1%(0.44±0.01 vs 0.74±0.01,P<0.01)。见图 4。结果提示血清剥夺可诱导人心肌细胞AC16凋亡并抑制P53信号通路。
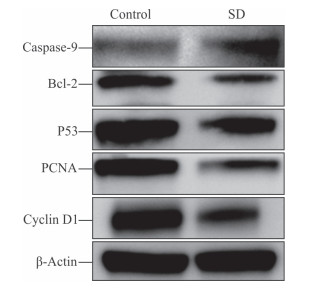
|
图 4 蛋白质印迹分析检测血清剥夺对人心肌细胞AC16中P53信号通路的影响 Fig 4 Influence of serum deprivation on P53 signaling pathway in human cardiomyocytes AC16 by Western blotting SD: Serum-deprivation; PCNA: Proliferating cell nuclear antigen |
2.5 血清剥夺对人心肌细胞AC16中Wnt/β-catenin信号通路的影响
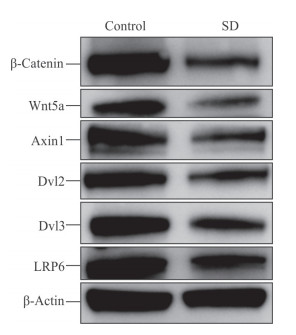
人心肌细胞AC16经血清剥夺或正常培养48 h后,与对照组比较,血清剥夺组心肌细胞中β-catenin蛋白表达水平降低了48.6%(0.49±0.01 vs 0.96±0.02,P<0.01)、Wnt5a蛋白表达水平降低了21.8%(0.43±0.02 vs 0.55±0.01,P<0.05),Axin1蛋白表达水平降低了52.9%(0.39±0.02 vs 0.83±0.04,P<0.05)、Dvl2蛋白表达水平降低了54.3%(0.38±0.01 vs 0.84±0.01,P<0.01)、Dvl3蛋白表达水平降低了52.9%(0.40±0.02 vs 0.86±0.01,P<0.01)、LRP6蛋白表达水平降低了32.9%(0.68±0.03 vs 1.01±0.01,P<0.05)。见图 5。结果提示血清剥夺可抑制人心肌细胞AC16中Wnt/β-catenin信号通路。
|
图 5 蛋白质印迹分析检测血清剥夺对人心肌细胞AC16中Wnt/β-catenin信号通路的影响 Fig 5 Influence of serum deprivation on Wnt/β-catenin signaling pathway in human cardiomyocytes AC16 by Western blotting SD: Serum-deprivation; Axin1: Axis inhibition protein 1; Dvl2:Dishevelled 2; Dvl3: Dishevelled 3; LRP6: Low-density lipoprotein receptor-related protein 6 |
3 讨论
既往研究显示心肌细胞凋亡在多种心脏疾病中起重要作用,包括心肌梗死、心功能不全等[1, 5]。Caspase家族蛋白在细胞凋亡过程中发挥重要作用,caspase家族蛋白主要以酶原的形式存在,激活后的caspase家族蛋白如激活后的caspase-9可引起caspase级联反应,进而水解蛋白底物,引起细胞凋亡[6]。Bcl-2蛋白可抑制细胞凋亡,当其表达降低时促进细胞凋亡。本研究应用血清剥夺模拟心肌缺血,经流式细胞术检测证实血清剥夺48 h后诱导了心肌细胞的凋亡。蛋白质印迹分析显示,血清剥夺促进了caspase-9蛋白的表达,同时降低了Bcl-2蛋白的表达,进一步证实血清剥夺诱导了心肌细胞的凋亡。
细胞凋亡受多种信号通路的调控,线粒体介导的凋亡、死亡受体介导的凋亡、内质网介导的凋亡均在凋亡调控中起重要作用[1]。本研究中,血清剥夺降低了心肌细胞的线粒体膜电位,表明血清剥夺可能导致心肌细胞线粒体功能紊乱。Bonavita等[7]研究显示,缺氧、营养因子缺乏可导致心肌细胞线粒体膜电位降低、线粒体功能紊乱,与本研究结果一致。P53信号通路在细胞凋亡中同样起重要调控作用,多种损伤因素可促进P53的表达,并进一步促进Bcl-2家族中促凋亡蛋白的表达,最终促进caspase-9等蛋白的表达并启动凋亡[7]。本研究中,蛋白质印迹分析发现血清剥夺导致P53蛋白表达的降低,表明血清剥夺抑制了心肌细胞中P53信号通路,提示血清剥夺诱导的凋亡可能通过P53以外的信号通路进行调控,血清剥夺诱导心肌细胞凋亡的确切机制需进一步探究。
本实验中,CCK-8及EdU实验发现血清剥夺抑制了心肌细胞的活力及DNA合成,蛋白质印迹分析发现血清剥夺导致细胞中PCNA蛋白表达下降,提示血清剥夺抑制了心肌细胞增殖。哺乳动物Wnt信号通路由19种Wnt蛋白配体、10种Fzd受体和两种LRP受体组成,既往研究显示Wnt信号通路在细胞分化、增殖、凋亡过程中具有重要作用[8-9]。已有研究显示,激活小鼠胚胎心肌中Wnt/β-catenin信号通路可通过激活下游信号分子cyclin D2促进小鼠胚胎心肌细胞增殖,抑制Wnt/β-catenin信号通路则可抑制小鼠胚胎心肌细胞增殖[10]。不同的刺激因素对心肌细胞中的Wnt/β-cateinin信号通路的影响不同。本实验发现,经血清剥夺处理48 h后,心肌细胞β-catenin蛋白的表达降低,同时Wnt/β-cateinin信号通路下游的靶分子cyclin D1蛋白的表达受到抑制,血清剥夺也抑制了β-cateinin上游Wnt5a细胞膜配体蛋白及LRP6细胞膜受体蛋白的表达,此外Dvl2、Dvl3、Axin1蛋白表达也受到了抑制,表明血清剥夺抑制了心肌细胞中Wnt/β-cateinin信号通路,提示血清剥夺抑制心肌细胞增殖可能与抑制Wnt/β-cateinin信号通路有关。
综上所述,在血清剥夺模拟心肌细胞缺血模型中,血清剥夺抑制了心肌细胞增殖并诱导细胞凋亡,同时血清剥夺抑制了心肌细胞中Wnt/β-catenin信号通路,血清剥夺对心肌细胞增殖的抑制可能与抑制Wnt/β-cateinin信号通路有关,提示Wnt/β-cateinin信号通路可作为干预心肌缺血的潜在靶点。但血清剥夺诱导心肌细胞凋亡的确切调控机制仍不清楚,需进一步深入研究。
| [1] |
TERINGOVA E, TOUSEK P. Apoptosis in ischemic heart disease[J]. J Transl Med, 2017, 15: 87. DOI:10.1186/s12967-017-1191-y |
| [2] |
LUO K, LONG H B, XU B C. Reduced apoptosis after acute myocardial infarction by simvastatin[J]. Cell Biochem Biophys, 2015, 71: 735-740. DOI:10.1007/s12013-014-0257-1 |
| [3] |
ULUKAYA E, ACILAN C, YILMAZ Y. Apoptosis:why and how does it occur in biology?[J]. Cell Biochem Funct, 2011, 29: 468-480. DOI:10.1002/cbf.1774 |
| [4] |
ZHAO Y, WANG C, WANG C, HONG X, MIAO J, LIAO Y, et al. An essential role for Wnt/β-catenin signaling in mediating hypertensive heart disease[J]. Sci Rep, 2018, 8: 8996-9010. DOI:10.1038/s41598-018-27064-2 |
| [5] |
ANDREKA P, NADHAZI Z, MUZES G, SZANTHO G, VANDOR L, KONYA L, et al. Possible therapeutic targets in cardiac myocyte apoptosis[J]. Curr Pharm Des, 2004, 10: 2445-2461. DOI:10.2174/1381612043383908 |
| [6] |
易铁男, 周云峰, 伍钢. Caspase家族与细胞凋亡的研究进展[J]. 国外医学:肿瘤学分册, 2001, 28: 39-42. |
| [7] |
BONAVITA F, STEFANELLI C, GIORDANO E, COLUMBARO M, FACCHINI A, BONAFÈ F, et al. H9c2 cardiac myoblasts undergo apoptosis in a model of ischemia consisting of serum deprivation and hypoxia:inhibition by PMA[J]. FEBS Lett, 2003, 536: 85-91. DOI:10.1016/S0014-5793(03)00029-2 |
| [8] |
COHEN E D, TIAN Y, MORRISEY E E. Wnt signaling:an essential regulator of cardiovascular differentiation, morphogenesis and progenitor self-renewal[J]. Development, 2008, 135: 789-798. DOI:10.1242/dev.016865 |
| [9] |
YE X, LIN J, LIN Z, XUE A, LI L, ZHAO Z, et al. Axin1 up-regulated 1 accelerates stress-induced cardiomyocytes apoptosis through activating Wnt/β-catenin signaling[J]. Exp Cell Res, 2017, 359: 441-448. DOI:10.1016/j.yexcr.2017.08.027 |
| [10] |
YE B, HOU N, XIAO L, XU Y, BOYER J, XU H, et al. APC controls asymmetric Wnt/β-catenin signaling and cardiomyocyte proliferation gradient in the heart[J]. J Mol Cell Cardiol, 2015, 89(Pt B): 287-296. |
 2019, Vol. 40
2019, Vol. 40


