2. 上海中医药大学附属曙光医院急诊创伤外科, 上海 201203
2. Department of Emergency and Traumatic Surgery, Shuguang Hospital, Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China
流行病学调查显示, 近年来我国结肠癌发病率和死亡率均有升高的趋势[1]。肠道代谢与微环境稳态失衡是结肠肿瘤发病的关键因素, 高脂饮食可以增加肝脏胆汁分泌, 使结肠中胆汁酸的浓度升高, 从而导致肠道微环境改变。研究发现胆汁酸可以影响结肠癌的发病风险[2], 法尼酯X受体(farnesoid X receptor, FXR)是胆汁酸的核受体, 通过调控一系列基因的表达调节细胞内胆汁酸浓度, 参与胆汁酸的肠肝循环, 在糖、胆汁酸、胆固醇等物质的代谢过程中起重要作用[3]。肠道上皮细胞的增殖、代谢及基因表达的平衡是细胞转化的关键因素, 当细胞代谢平衡被破坏时, 可能会引起炎症甚至诱发肿瘤。FXR与结肠癌密切相关, 其激活后可抑制结肠癌细胞的生长, 其在结肠癌组织中的表达水平与患者预后有关[4]。目前FXR抑制结肠癌细胞生长浸润的相关机制尚不明确, 因此我们设计以下实验进行探讨。
1 材料和方法 1.1 细胞、试剂与实验动物人结肠癌细胞株HT-29购自上海慧颖生物科技有限公司, 胎牛血清(fetal bovine serum, FBS)、DMEM培养液和磷酸盐缓冲液购自美国Gibco公司, 四甲基偶氮唑盐(methyl thiazolyl tetrazolium, MTT)购自美国Sigma公司, FXR特异性激动剂GW4064购自英国Tocris公司, 细胞划痕实验专用培养插件培养皿购自德国IBIDI公司, TRIzol抽提试剂盒购自美国Invitrogen公司, 反转录试剂盒购自美国Fermentas公司, PCR试剂盒购自日本TaKaRa公司, 基质细胞衍生因子1(stromal cell-derived factor 1, SDF-1) ELISA检测试剂盒购自美国R & D公司。裸鼠购自上海斯莱克实验动物有限责任公司[生产许可证号:SCXK (沪)2017-0005]。
1.2 细胞培养HT-29细胞培养于含10% FBS的DMEM培养液中, 在37℃、5% CO2的培养箱中培养, 当细胞融合度达到70%~80%时用0.05%胰酶消化传代。
1.3 MTT法检测结肠癌细胞增殖情况将GW4064溶解于DMSO, 制成不同浓度的GW4064溶液, 将HT-29细胞悬液按7×103/孔的密度接种于96孔板, 用含10% FBS的DMEM培养液培养24 h后, 将培养液换成含1% FBS的DMEM培养液(每孔200 μL)。将细胞分为7组, 分别加入不同浓度的GW4064(0、0.1、1、3、5、7、10 μmol/L), 每组重复5孔。培养72 h后, 各孔分别加入20 μL 5 g/L的MTT, 继续培养4 h。然后弃培养液, 各孔内均加入150 μL DMSO, 用酶标仪检测570 nm波长处光密度(D)值。计算细胞活力和细胞半数抑制浓度(half maximal inhibitory, IC50)。
1.4 于相差显微镜下观察细胞形态学变化将HT-29细胞悬液按1×105/孔的密度接种于12孔板。用含10% FBS的DMEM培养液培养24 h后, 将培养液换成含1% FBS的DMEM培养液(每孔500 μL)。将细胞分为3组, 分别加入不同浓度的GW4064(0、1、5 μmol/L), 培养24 h后, 用相差显微镜(Nikon Eclips TE300)在20×的视野下观察细胞的形态学变化。
1.5 细胞划痕实验检测细胞浸润能力将消化好的HT-29细胞按3×105/孔的密度接种于6孔板, 注意不要晃动培养皿, 以防止细胞贴壁不均匀。用含10% FBS的DMEM培养液培养24 h后, 撕除细胞划痕插件培养皿底部的保护胶带, 将培养液换成含1% FBS的DMEM培养液1 mL并将细胞分为2组, 分别加入不同浓度的GW4064(0、1 μmol/L)处理24 h后, 采用IBIDI公司的伤口愈合分析软件统计细胞的迁移距离。
1.6 PCR检测细胞中FXR、SDF-1 mRNA的表达将HT-29细胞悬液以4×105/孔的密度接种于6孔板中并分为3组, 分别加入不同浓度的GW4064(0、1、5 μmol/L)处理24 h后, 提取RNA, 用反转录试剂盒反转录合成cDNA。以2 μg cDNA为模板, 加入引物进行PCR。引物序列:内参照GAPDH上游引物5′-GCA CCG TCA AGG CTG AGA AC-3′, 下游引物5′-TGG TGA AGA CGC CAG TGG A-3′; FXR上游引物5′-AAC AAT CCA AGG AGG TAG AAG AC-3′, 下游引物5′-GAA GAA ATC CAG GAA ACT AAG AG-3′; SDF-1上游引物5′-GCA GCC TTT CTC TTC TTC TGT C-3′, 下游引物5′-ACT CCA AAC TGT GCC CTT CA-3′。反应条件:95℃ 1 min; 95℃ 30 s, 55℃ 30 s, 共40个循环; 72℃ 1 min。取5 μL PCR产物与DNA上样缓冲液混匀后放入凝胶中电泳, 恒压80 V, 50 min后用紫外灯观察, 并用凝胶扫描仪进行拍照。用BandScan 5.0软件分析电泳条带灰度值, 以目的基因与内参基因灰度值的比值表示目的基因的相对表达量。
1.7 ELISA法检测细胞培养上清液中SDF-1的表达将HT-29细胞悬液按1×105/孔的密度接种于24孔板并分为4组, 分别加入不同浓度的GW4064(0、1、5、7 μmol/L), 培养24 h后, 取细胞培养上清液100 μL, 用ELISA试剂盒检测SDF-1水平。具体步骤为:在各反应孔中加入100 μL一抗溶液, 置37℃ 1 h, 用磷酸盐缓冲液洗涤2次; 在各反应孔中加入新鲜稀释的酶标抗体100 μL, 37℃ 1 h, 用磷酸盐缓冲液洗涤2次; 在各反应孔中加入临用时配制的四甲基联苯胺(tetramethylbenzidine, TMB)底物溶液200 μL, 37℃ 30 min; 在各反应孔中加入硫酸50 μL, 用酶标仪测定450 nm波长处D值, 计算SDF-1的相对表达量。
1.8 裸鼠皮下肿瘤种植模型的建立在无菌环境下, 用乙醇消毒接种部位, 将预先配制好的含1×107个HT-29细胞的细胞悬液接种于裸鼠体侧稍靠上的部位, 2周后随机分为对照组和GW4064组, 每组10只。GW4064处理组给予GW4064灌胃, 30 mg/kg, 每4 d 1次; 对照组同法给予等体积DMSO。给药16 d后处死小鼠, 处死前4 h除正常饮食外不再给药。处死后取出肿瘤组织拍照、测量体积, 用PCR法检测肿瘤组织中FXR及SDF-1 mRNA的表达。
1.9 统计学处理应用SPSS 15.0软件进行数据分析。呈正态分布的计量资料以x±s表示, 多组间比较采用单因素方差分析, 两组间比较采用两样本t检验。检验水准(α)为0.05。
2 结果 2.1 结肠癌细胞增殖结果0、0.1、1、3、5、7、10 μmol/L GW4064组HT-29细胞活力分别为(101.80±2.50)%、(96.64±2.33)%、(76.43±3.81)%、(61.70±4.31)%、(47.72±5.21)%、(5.34±3.57)%、(2.61±2.11)%, 其中1、3、5、7、10 μmol/L GW4064组细胞活力与对照组(0 μmol/L)相比差异均有统计学意义(P均 < 0.05);72 h细胞IC50为4.83 μmol/L。表明GW4064对HT-29细胞的生长产生抑制作用, 并呈现剂量依赖关系, 即随着浓度增加, GW4064对HT-29细胞生长的抑制作用增强, 当GW4064浓度超过5 μmol/L时细胞活力急剧下降, 细胞毒性增加。
2.2 细胞形态学变化0、1、5 μmol/L GW4064处理HT-29细胞24 h后, 随着GW4064浓度的增加, 细胞收缩变圆, 从瘦长的细胞向表皮样细胞转变, 表明细胞生长浸润受到抑制。见图 1。

|
图 1 GW4064处理后结肠癌细胞HT-29的形态学改变 Fig 1 Morphological changes of colon cancer cell HT-29 after GW4064 treatment A:Control (0 μmol/L GW4064) group; B:1 μmol/L GW4064 group; C:5 μmol/L GW4064 group |
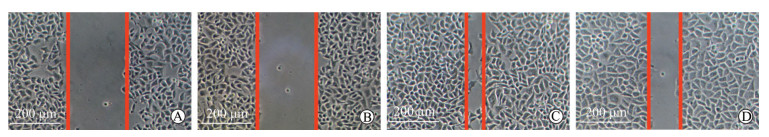
2.3 细胞划痕实验结果
0 μmol/L (对照组)和1 μmol/L GW4064分别处理HT-29细胞24 h后, 细胞迁移距离分别为(150.00±6.35)μm、(97.00±13.21)μm, 两组比较差异有统计学意义(P < 0.05)。见图 2。
|
图 2 细胞划痕实验结果 Fig 2 Results of cell scratch test A, C:Control (0 μmol/L GW4064) group; B, D:1 μmol/L GW4064 group; A, B:0 h; C, D:24 h |
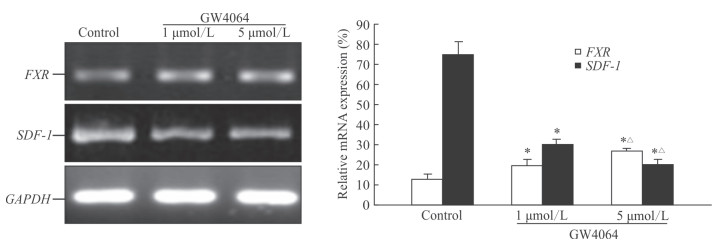
2.4 细胞中FXR、SDF-1 mRNA表达
PCR检测结果(图 3)显示, 用不同浓度的GW4064处理HT-29细胞24 h后, 1、5 μmol/L GW4064组FXR、SDF-1 mRNA的表达与对照组(0 μmol/L)相比差异均有统计学意义(P均 < 0.05), 1 μmol/L GW4064组和5 μmol/L GW4064组间FXR mRNA、SDF-1 mRNA的表达差异均有统计学意义(P均 < 0.05)。表明FXR mRNA表达呈剂量依赖性增加, 而SDF-1 mRNA表达却呈剂量依赖性降低。
|
图 3 PCR检测GW4064对结肠癌细胞HT-29中FXR、SDF-1 mRNA表达的影响 Fig 3 Effects of GW4064 on mRNA expression levels of FXR and SDF-1 in colon cancer cell HT-29 by PCR FXR:Farnesoid X receptor; SDF-1:Stromal cell-derived factor 1;GAPDH:Glyceraldehyde-3-phosphate dehydrogenase.*P < 0.05 vs control (0 μmol/L GW4064) group; △P < 0.05 vs 1 μmol/L GW4064 group.n=3, x±s |
2.5 细胞培养上清液中SDF-1的表达
0、1、5、7 μmol/L GW4064处理HT-29细胞24 h后, 细胞培养上清液中SDF-1的表达量分别为(100.00±2.41)%、(94.42±7.35)%、(73.25±6.11)%和(24.18±10.33)%, 表明SDF-1的表达随着GW4064浓度的增加而下降。1、5、7 μmol/L GW4064组与对照组(0 μmol/L)比较, 差异均有统计学意义(P均 < 0.05)。
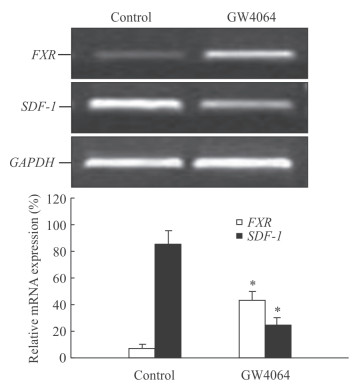
2.6 裸鼠肿瘤种植模型结果见图 4。对照组(DMSO)及GW4064组肿瘤体积分别为(840.31±172.96) mm3、(266.14±107.16) mm3, 两组比较差异有统计学意义(P < 0.05)。PCR检测结果(图 5)显示, GW4064组肿瘤组织中FXR mRNA表达升高, 而SDF-1 mRNA表达降低, 与对照组(DMSO)比较差异均有统计学意义(P均 < 0.05)。

|
图 4 裸鼠肿瘤种植结果 Fig 4 Tumor implantation in nude mice |
|
图 5 荷瘤小鼠肿瘤组织中FXR、SDF-1 mRNA的表达 Fig 5 mRNA expression of FXR and SDF-1 in tumor tissues of tumor-bearing mice FXR:Farnesoid X receptor; SDF-1:Stromal cell-derived factor 1;GAPDH:Glyceraldehyde-3-phosphate dehydrogenase.*P < 0.05 vs control (DMSO) group.n=3, x±s |
3 讨论
我国结直肠癌发病率由2000年的16.1/10万上升至2013年的17.06/10万[1]。目前结肠癌多采用以外科手术为主的多学科治疗, 但仍有大量患者死于结肠癌转移。即使行结肠癌根治术, 依然有25%~40%的患者发生异时性肝转移[5]。因此, 进一步阐明结肠癌的浸润转移机制成为当务之急。
近年来, 机体代谢及微环境与肿瘤关系的研究逐渐成为热点, 而FXR与肠道的代谢及微环境均相关[6], 故FXR在结直肠癌中的作用也成为研究方向。在FXR基因敲除小鼠模型中, 小鼠发生慢性结肠炎、癌变风险明显提高; 但激活FXR可以降低慢性肠炎小鼠模型肠道上皮细胞增殖及炎症[7-8]。De Gottardi等[9]研究发现, 结肠腺瘤、结肠癌组织与正常结肠黏膜相比, FXR mRNA的表达下降, 且FXR表达的高低与结肠癌的分型及分期明显相关。Lax等[10]研究也进一步证实, 结肠癌的分期及患者预后与FXR的表达呈负相关。在前期研究中, 我们对人胆管细胞癌与正常胆管组织中FXR的表达进行了比较, 也得到了相似的结果[11]。Smith等[12]研究表明, 应用牛磺脱氧胆酸可以抑制小鼠肠道腺瘤的形成, 并且可促进小异二聚体伴侣(small heterodimer partner, Shp)、纤维母细胞生长因子15(fibroblast growth factor 15, FGF15)及肠胆汁酸结合蛋白(ileal bile acid binding protein, IBABP)的表达, 而这些蛋白的表达均由FXR调控。本研究结果也证实FXR的表达与结肠癌生长呈负向关系, 通过GW4064激活FXR表达, 细胞浸润生长受到抑制, 细胞活力下降, 细胞形态发生改变。
肿瘤细胞的生长、转移与周围微环境有关, 微环境的构成是由基质细胞决定。SDF-1是重要的基质细胞衍生因子, 通过自分泌或旁分泌的环路刺激细胞增殖, 并可协同巨噬细胞迁移抑制因子(macrophage migration inhibitory factor, MIF)促进结肠癌细胞的生长和浸润转移[13]。Margolin等[14]在结肠癌转移小鼠模型中研究发现, 基质细胞可以促进肿瘤细胞的转移, 但敲除SDF-1基因后, 该作用被显著抑制。Wang等[15]研究发现, SDF-1通过激活整合素αvβ6及细胞外调节蛋白激酶/E26转录因子1(extracellular regulated protein kinsase/E26 transformation specifc 1, ERK/Ets-1)信号通路促进结肠癌肝转移。Ma等[16]发现沉默SDF-1基因, 可以通过丝裂原活化蛋白激酶/磷脂酰肌醇3激酶/激活蛋白1(mitogen-activated protein kinase/phosphoinositide 3 kinase/activator protein 1, MAPK/PI3K/AP-1)信号通路显著抑制结肠癌细胞的生长、浸润和迁移。SDF-1还可以协同CXC趋化因子配体6(CXC chemokine ligand 6, CXCL6)激活磷脂酰肌醇3激酶/蛋白激酶B/雷帕霉素靶蛋白(phosphoinositide 3 kinase/protein kinase B/mammalian target of rapamycin, PI3K/Akt/mTOR)通路促进结肠癌细胞的迁移[17]。Stanisavljević等[18]通过分析结肠癌患者肿瘤组织中SDF-1与CXC趋化因子受体4(CXC chemokine receptor 4, CXCR4)的表达发现, 预后差的患者肿瘤组织细胞核中CXCR4高表达、细胞质中SDF-1低表达, 而且SDF-1和CXCR4在结肠癌细胞的表达差异可作为结肠癌TNM分期Ⅲ期患者的预后指标。由上述研究结果可见, SDF-1在结肠癌的生长和转移中起重要作用。
本研究应用GW4064激活FXR后, 分别在mRNA水平与蛋白水平上检测了SDF-1的表达, 结果表明SDF-1表达受到抑制, 并呈剂量依赖性。将GW4064作用于裸鼠成瘤模型, 进一步验证了FXR与SDF-1表达的变化与肿瘤生长的关系。由此我们认为, GW4064通过激活FXR的表达抑制结肠癌细胞的生长浸润, FXR可能是通过降低SDF-1的表达起作用。Peng等[19]研究证实GW4064通过FXR作用于结肠癌细胞, 可以抑制结肠癌的形成及生长, 这与本研究结果一致。高脂饮食可导致结肠癌风险增加, 刺激肝脏合成分泌胆盐增多, 使结肠内胆汁酸浓度增加, 肠道内胆汁酸平衡被破坏。而FXR可以平衡结肠细胞胆汁酸水平, 激活FXR可以促进胆汁酸的重吸收, 胆汁酸水平增高后抑制了结肠细胞表达FXR[20], 从而促进结肠细胞的增殖转化。
综上所述, 本研究结果表明GW4064可以抑制结肠癌细胞的浸润生长。其可能机制为通过激活FXR降低了SDF-1的表达, 从而抑制了结肠癌细胞的生长浸润。提示GW4064有望成为治疗结肠癌浸润、转移的重要化学药物, 但其深入机制尚需进一步研究。
| [1] |
ZHENG Z X, ZHENG R S, ZHANG S W, CHEN W Q. Colorectal cancer incidence and mortality in China, 2010[J]. Asian Pac J Cancer Prev, 2014, 15: 8455-8460. DOI:10.7314/APJCP.2014.15.19.8455 |
| [2] |
OCVIRK S, O'KEEFE S J. Influence of bile acids on colorectal cancer risk:potential mechanisms mediated by diet-gut microbiota interactions[J]. Curr Nutr Rep, 2017, 6: 315-322. DOI:10.1007/s13668-017-0219-5 |
| [3] |
DI CIAULA A, WANG D Q, MOLINA-MOLINA E, LUNARDI BACCETTO R, CALAMITA G, PALMIERI V O, et al. Bile acids and cancer:direct and environmental-dependent effects[J]. Ann Hepatol, 2017, 16(Suppl 1:s3-105): s87-s105. |
| [4] |
KOUTSOUNAS I, GIAGINIS C, THEACHARIS S. Farnesoid X receptor (FXR) from normal to malignant state[J]. Histol Histopathol, 2012, 27: 835-853. |
| [5] |
LALMAHOMED Z S, BRÖKER M E, VAN HUIZEN N A, COEBERGH VAN DEN BRAAK R R, DEKKER L J, RIZOPOULOS D, et al. Hydroxylated collagen peptide in urine as biomarker for detecting colorectal liver metastases[J]. Am J Cancer Res, 2016, 6: 321-330. |
| [6] |
GADALETA R M, CARIELLO M, SABBÀ C, MOSCHETTA A. Tissue-specific actions of FXR in metabolism and cancer[J]. Biochim Biophys Acta, 2015, 1851: 30-39. DOI:10.1016/j.bbalip.2014.08.005 |
| [7] |
MODICA S, MURZILLI S, SALVATORE L, SCHMIDT D R, MOSCHETTA A. Nuclear bile acid receptor FXR protects against intestinal tumorigenesis[J]. Cancer Res, 2008, 68: 9589-9594. DOI:10.1158/0008-5472.CAN-08-1791 |
| [8] |
MARAN R R, THOMAS A, ROTH M, SHENG Z, ESTERLY N, PINSON D, et al. Farnesoid X receptor deficiency in mice leads to increased intestinal epithelial cell proliferation and tumor development[J]. J Pharmacol Exp Ther, 2009, 328: 469-477. DOI:10.1124/jpet.108.145409 |
| [9] |
DE GOTTARDI A, TOURI F, MAURER C A, PEREZ A, MAURHOFER O, VENTRE G, et al. The bile acid nuclear receptor FXR and the bile acid binding protein IBABP are differently expressed in colon cancer[J]. Dig Dis Sci, 2004, 49: 982-989. DOI:10.1023/B:DDAS.0000034558.78747.98 |
| [10] |
LAX S, SCHAUER G, PREIN K, KAPITAN M, SILBERT D, BERGHOLD A, et al. Expression of the nuclear bile acid receptor/farnesoid X receptor is reduced in human colon carcinoma compared to nonneoplastic mucosa independent from site and may be associated with adverse prognosis[J]. Int J Cancer, 2012, 130: 2232-2239. DOI:10.1002/ijc.v130.10 |
| [11] |
张超峰, 王坚. 法尼酯X受体在胆管癌中的表达特点[J]. 外科理论与实践, 2009, 14: 171-173. |
| [12] |
SMITH D L, KESHAVAN P, AVISSAR U, AHMED K, ZUCJER S D. Sodium taurocholate inhibits intestinal adenoma formation in APCMin/+ mice, potentially through activation of the farnesoid X receptor[J]. Carcinogenesis, 2010, 31: 1100-1109. DOI:10.1093/carcin/bgq050 |
| [13] |
SHIN H N, MOON H H, KU J L. Stromal cell-derived factor-1α and macrophage migration-inhibitory factor induce metastatic behavior in CXCR4-expressing colon cancer cells[J]. Int J Mol Med, 2012, 30: 1537-1543. DOI:10.3892/ijmm.2012.1141 |
| [14] |
MARGOLIN D A, MYERS T, ZHANG X, BERTONI D M, REUTER B A, OBOKHARE I, et al. The critical roles of tumor-initiating cells and the lymph node stromal microenvironment in human colorectal cancer extranodal metastasis using a unique humanized orthotopic mouse model[J]. FASEB J, 2015, 29: 3571-3581. DOI:10.1096/fj.14-268938 |
| [15] |
WANG B, WANG W, NIU W, LIU E, LIU X, WANG J, et al. SDF-1/CXCR4 axis promotes directional migration of colorectal cancer cells through upregulation of integrin αvβ6[J]. Carcinogenesis, 2014, 35: 282-291. DOI:10.1093/carcin/bgt331 |
| [16] |
MA J, SU H, YU B, GUO T, GONG Z, QI J, et al. CXCL12 gene silencing down-regulates metastatic potential via blockage of MAPK/PI3K/AP-1 signaling pathway in colon cancer[J]. Clin Transl Oncol, 2018, 20: 1035-1045. DOI:10.1007/s12094-017-1821-0 |
| [17] |
MA J C, SUN X W, SU H, CHEN Q, GUO T K, LI Y, et al. Fibroblast-derived CXCL12/SDF-1α promotes CXCL6 secretion and co-operatively enhances metastatic potential through the PI3K/Akt/mTOR pathway in colon cancer[J]. World J Gastroenterol, 2017, 23: 5167-5178. DOI:10.3748/wjg.v23.i28.5167 |
| [18] |
STANISAVLJEVIĆ L, AßMUS J, STORLI K E, LEH S M, DAHL O, MYKLEBUST M P. CXCR4, CXCL12 and the relative CXCL12-CXCR4 expression as prognostic factors in colon cancer[J]. Tumour Biol, 2016, 37: 7441-7452. DOI:10.1007/s13277-015-4591-8 |
| [19] |
PENG Z, RAUFMAN J P, XIE G. Src-mediated cross-talk between farnesoid X and epidermal growth factor receptors inhibits human intestinal cell proliferation and tumorigenesis[J/OL]. PLoS One, 2012, 7: e48461. doi: 10.1371/journal.pone.0048461.
|
| [20] |
MASSAFRA V, VAN MIL S W C. Farnesoid X receptor:a "homeostat" for hepatic nutrient metabolism[J]. Biochim Biophys Acta, 2018, 1864: 45-59. DOI:10.1016/j.bbadis.2017.10.003 |
 2019, Vol. 40
2019, Vol. 40


