果糖摄入过量可导致肥胖、高脂血症、胰岛素抵抗等,是2型糖尿病、非酒精性脂肪肝病、心血管疾病的重要危险因素[1]。碳水化合物反应元件结合蛋白(carbohydrate response element-binding protein,ChREBP)是调节果糖和脂质代谢的重要转录因子,属于碱性螺旋-环-螺旋-亮氨酸锌指(basic helix-loop-helix-leucine zipper, bHLH-ZIP)转录因子家族成员,能够识别靶基因中的E-box序列。ChREBP本身含有几个不同的功能区,包括位于氨基端的核定位信号、1个多聚脯氨酸区以及位于羧基端与DNA结合的螺旋-环-螺旋/锌指区,其与共作用因子Max样蛋白X(Max-like protein X,MLX)形成异二聚体后才能发挥转录调节作用[2],参与果糖分解、糖酵解、糖异生、脂质从头合成等代谢通路中许多关键酶的表达调控[3-4]。ChREBP在肝脏组织、脂肪组织、小肠组织、肌肉组织及胰岛β细胞中高表达[5],其分为ChREBP-α和ChREBP-β两种亚型,能够感受细胞内碳水化合物的变化,调节糖酵解和脂质合成等相关代谢酶的基因转录[6]。在低糖水平时ChREBP-α的表达被抑制,而当细胞内的碳水化合物水平升高时,ChREBP-α则通过转录激活活性更高的ChREBP-β而发挥作用[6]。本实验室前期研究结果表明,锌指蛋白ZBTB20是ChREBP-α的转录激活因子,参与调节肝脏的脂质从头合成[7]。鉴于目前有关ChREBP的功能研究大多是基于全身敲除模型或者腺病毒介导的基因干扰,不同组织中ChREBP的生理功能尚不清楚。本研究拟利用Cre/loxP系统建立ChREBP的条件性基因敲除小鼠模型,为探寻ChREBP的体内功能奠定基础。
1 材料和方法 1.1 主要材料 1.1.1 质粒、菌株与动物含ChREBP基因组的细菌人工染色体(bacterial artificial chromosome,BAC)克隆bMQ-164K10购自英国Source BioScience公司。质粒(pL-452、pL-451、pBR322-2S、pBR322-MK)、菌株EL-350和用于提供胚胎干细胞(embryonic stem cell,ES细胞)及用于假孕的C57BL/6J*129S3雌性小鼠[实验动物生产许可证号:SCXK(沪)2017-0010,使用许可证号:SYXK(沪)2017-0012]均由上海南方模式生物研究中心提供。
Flp转基因小鼠、白蛋白(albumin,Alb)启动子调控的Cre转基因小鼠(Alb-Cre小鼠)和野生型C57BL/6J小鼠均引自美国Jax动物公司[8],在本实验室繁殖饲养[实验动物使用许可证号为SYXK(沪)2014-0028]。饲养条件:SPF级动物房,室内温度控制在25 ℃,湿度控制在40%~60%,光照周期为12 h光照/12 h黑暗。
1.1.2 试剂BAC DNA抽提试剂盒购自德国Qiagen公司。ES细胞培养所需的DMEM培养液(高糖,ES细胞级)和胎牛血清(ES细胞级)购自美国Gibco BRL公司,遗传霉素(geneticin,G418)、丙氧鸟苷和白血病抑制因子(leukemia inhibitory factor,LIF)购自美国Sigma公司。兔抗ChREBP多克隆抗体(货号sc-33764)购自美国Santa Cruz公司,辣根过氧化物酶(horseradish peroxidase,HRP)标记羊抗兔IgG二抗(货号111-035-003)购自美国Jackson公司,鼠抗β-actin多克隆抗体(货号60008-1-Ig)购自美国Proteintech公司,HRP标记羊抗鼠IgG二抗(货号115-035-003)购自美国Jackson公司。PrimerStar GXL DNA聚合酶为日本TaKaRa公司产品。
1.2 ChREBP打靶载体的构建 1.2.1 敲除外显子的选择为设计条件基因打靶载体,首先分析了小鼠ChREBP基因组的结构特点。ChREBP基因含有17个外显子,其中第8外显子长185 bp,编码氨基端的61个氨基酸;其上、下游两侧的内含子分别为4.5 kb和3.6 kb。据此推测,敲除第8外显子可造成残留下游编码序列的移码,从而达到去除ChREBP蛋白的目的。因此,本研究选择ChREBP基因第8外显子为条件敲除的靶向外显子。
1.2.2 预打靶载体的构建以ChREBP的BAC质粒为模板,利用PCR分别扩增ChREBP基因组DNA的片段A和B,引物序列见表 1。100 μL PCR体系含模板DNA(BAC质粒)2 μL、5×磷酸盐缓冲液20 μL、2 mmol/L dNTP 7 μL、2 mol/L引物4 μL,PrimerStar GXL DNA聚合酶1 μL;用水补足100 μL。反应条件:98 ℃ 52 min;98 ℃ 15 s,58 ℃ 45 s,72 ℃ 30 s,共30个循环;72 ℃ 5 min。将扩增得到的A、B片段分别用HindⅢ/XhoⅠ和XhoⅠ/BamHⅠ双酶切后,同时克隆到pBR322-2S载体的HindⅢ/BamHⅠ位点,获得ChREBP基因组DNA的取获载体pRV-ChREBP。将该载体和BAC克隆转入菌株EL-350,通过细菌内的同源重组[9],获得含有横跨A、B片段ChREBP基因组DNA的预打靶载体,记为pBR322-ChREBP。
|
|
表 1 ChREBP打靶载体引物序列 Tab 1 Primer sequences of ChREBP targeting vector |
1.2.3 loxP-neo-loxP片段的插入
以含有loxP-neo-loxP基因的质粒pL-452为模板,利用PCR获得包含ChREBP基因组C和D的loxP-neo-loxP基因片段(各长80 bp),引物序列见表 1,然后经过EL-350菌株内的同源重组敲入到上述获得的预打靶载体pBR322-ChREBP中,得到打靶载体pBR322-MK-ChREBP,经限制性内切酶及测序鉴定。将含有pBR322-MK-ChREBP质粒的EL-350菌株经阿拉伯糖诱导Cre重组酶表达,以去除质粒pL-452引入的neo基因,这样在ChREBP的第8外显子上游只保留1个loxP位点。
1.2.4 Frt-neo-Frt片段的插入以含有Frt-neo-Frt基因的质粒pL-451为模板,利用PCR获得包含ChREBP基因组E和F的Frt-neo-Frt片段(各长80 bp),引物序列见表 1,与上述去neo基因的质粒共同转入EL-350菌株,经过同源重组,构建打靶载体pBR322-MK-ChREBP-KO,并经限制性内切酶及测序鉴定。
1.3 ES细胞的基因打靶与筛选 1.3.1 ES细胞培养培养皿以0.1%明胶包被后接种经丝裂霉素C处理的滋养层细胞(每个10 cm盘接种2×106个滋养层细胞),过夜培养后即可接种ES细胞。ES细胞完全培养液为DMEM培养液(含1 mol/L β-巯基乙醇、2 mmol/L谷氨酰胺、0.1 mmol/L非必需氨基酸、100 U/mL青霉素、50 mg/L链霉素、15% ES级别胎牛血清和1 000 U/mL LIF)。
1.3.2 ES细胞电穿孔DNA转染处于对数生长期的ES细胞加0.125%胰蛋白酶-EDTA消化并计数,加适量磷酸盐缓冲液使细胞密度达到约1.5×107/mL。取0.8 mL上述ES细胞悬液,加入约35 μg经NotⅠ线性化的pBR322-MK-ChREBP-KO质粒DNA,混匀后转移至无菌电穿孔杯中,以240 V、500 μF的电参数进行电穿孔,重新悬浮后平均分配到3个已铺好滋养层细胞的10 cm培养皿中培养。
1.3.3 正负药物筛选ES细胞在电穿孔24 h后换含有选择药物G418(300 mg/L)和丙氧鸟苷(2 mol/L)的培养液进行选择性培养,每天更换培养液,经7~8 d选择性培养,抗性ES细胞长成肉眼可见的克隆时即可进行挑取。
1.3.4 双抗性细胞克隆的挑取与培养挑取抗性克隆放入含有30 μL 0.1%胰蛋白酶-EDTA的96孔板(凹底)中消化约3 min,轻轻吹打,使细胞分散,后转移至96孔培养板中培养,待细胞生长至60%~80%融合后取大部分细胞冻存,剩余细胞继续培养至100%融合后用于提取基因组DNA。
1.3.5 ES细胞同源重组克隆的PCR鉴定在长满ES细胞的96孔板中吸去培养液,每孔加入80 μL裂解液(含1 mg/L蛋白酶K),56 ℃过夜消化后加入无水乙醇,常规提取基因组DNA,溶于100 μL Tris-EDTA缓冲液中。在ChREBP同源重组臂外侧和neo基因中分别设计引物,鉴定打靶载体的5′、3′同源臂与细胞基因组的同源重组情况。引物序列见表 2。所用的DNA聚合酶为PrimeSTAR GXL。反应条件为:98 ℃2 min;98 ℃ 20 s,64 ℃ 30 s,68 ℃ 2 min,共35个循环;68 ℃ 2 min。PCR产物大小分别约为3.4 kb和4.9 kb。
|
|
表 2 ChREBP基因型引物序列 Tab 2 Primer sequences for ChREBP genotypes |
1.3.6 ES细胞的囊胚注射及胚胎移植
注射时采用的是无LIF的DMEM完全培养液,每枚囊胚注射15个左右的ES细胞。注射后的囊胚培养于无LIF的DMEM完全培养液中,37 ℃、5% CO2条件下培养1 h左右,然后将注射后的胚胎移植到2.5 d假孕雌鼠(C57BL/6J*129S3小鼠)子宫中,每侧移植8~10枚。
1.4 条件敲除小鼠的繁育与鉴定 1.4.1 首建鼠的繁育及neo基因去除挑选毛色嵌合度>50%的雄性嵌合鼠与野生C57BL/6J雌鼠交配,获得ES细胞来源的首建鼠。同ES细胞鉴定方法,用PCR方法鉴定阳性杂合子雌鼠。将杂合子小鼠与flp转基因小鼠进行交配,利用flp介导的Frt重组,去除杂合子小鼠基因组中的neo基因表达框;筛选不含neo和flp基因后代小鼠,记为ChREBPflox/+小鼠。
1.4.2 条件敲除小鼠构建将ChREBPflox/+小鼠与肝脏特异性表达的Alb-Cre小鼠交配,最终获得ChREBPflox/flox; Alb-Cre纯合子小鼠。
1.4.3 小鼠基因型鉴定取4周龄小鼠尾巴,提取基因组DNA进行PCR鉴定。针对第8外显子的下游loxP位点设计ChREBP基因型PCR鉴定引物(表 2),可从野生型、重组的等位基因中分别扩增出593 bp和681 bp的PCR产物。PCR反应条件:95 ℃ 1 min;95 ℃ 15 s,54 ℃ 15 s,72 ℃ 30 s,共30个循环;72℃ 5 min。Neo和Cre的基因型鉴定方法参见文献[8]。
1.4.4 小鼠肝脏ChREBP敲除鉴定取4周龄的小鼠肝脏及小肠组织,提取基因组DNA进行PCR鉴定。针对第8外显子设计ChREBP基因型PCR鉴定引物(表 2),可从野生型等位基因中扩增出363 bp的PCR产物,而基因敲除小鼠中由于肝脏中存在一部分非肝脏细胞,只能扩增出较弱的条带。PCR反应条件:95 ℃ 1 min;95 ℃ 20 s,60 ℃ 30 s,72 ℃ 30 s,共40个循环;72 ℃ 5 min。
2 结果 2.1 ChREBP打靶载体的构建及鉴定利用ChREBP的BAC克隆和细菌内同源重组,将含ChREBP基因第8、9外显子及两侧部分内含子的基因组DNA克隆至含有负性选择标志基因胸苷激酶蛋白(thymidine kinase,TK)表达元件的pBR322-2S质粒,得到预打靶载体pBR322-ChREBP。进一步通过PCR和细菌内同源重组,在该载体的ChREBP基因第8外显子上游引入loxP位点,在其下游插入Frt-neo-Frt-loxP元件,从而构建成ChREBP的条件打靶载体pBR322-MK-ChREBP-KO(图 1),并经限制性内切酶的酶切分析及DNA测序鉴定正确。
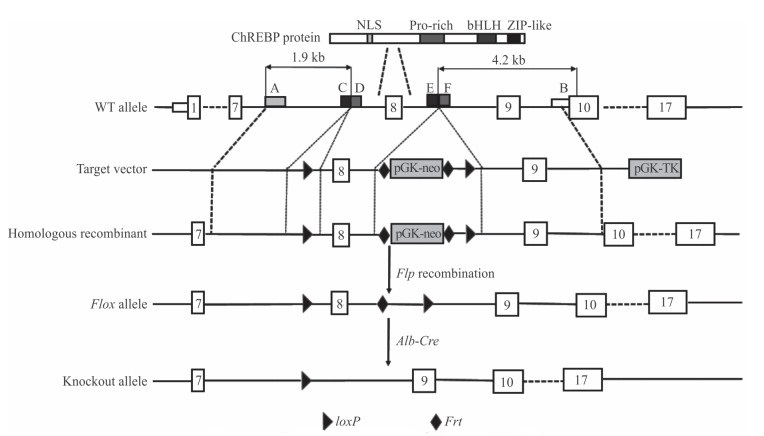
|
图 1 ChREBP基因打靶路线图 Fig 1 Schematic demonstration for ChREBP targeting strategy A, B: Homologous arms for obtaining the ChREBP genomic DNA fragment; C, D: Homologous arms for insertion of the loxP-neo-loxP fragment; E, F: Homologous arms for insertion of the Frt-neo-Frt fragment. ChREBP: Carbohydrate response element-binding protein; NLS: Nuclear localization signal; Pro-rich: Proline-rich; b-HLH: Basic helix-loop-helix; ZIP: Zipper; Alb: Albumin; WT: Wild type; neo: Neomycin resistance cassette; TK: Thymidine kinase |
2.2 ES细胞的基因打靶与同源重组鉴定
打靶载体DNA经NotⅠ酶切线性化后,通过电穿孔转染ES细胞,经正负筛选获得抗性克隆88个。对其基因组DNA在打靶载体5′和3′同源臂与细胞基因组的同源重组情况进行PCR扩增鉴定,结果在5个候选克隆中检测到2个同源臂均发生同源重组,分别为B1、B2、D2、D6和E10(图 2)。对同源重组的PCR产物经酶切和DNA测序鉴定,表明上述ES细胞克隆为正确的同源重组克隆,用于后续显微注射和囊胚移植。
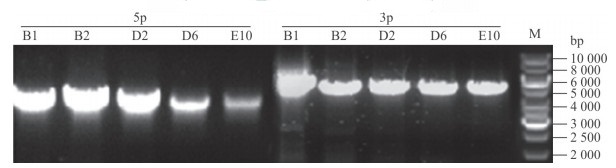
|
图 2 同源重组阳性ES细胞克隆的PCR基因型鉴定 Fig 2 Identification of homologous recombinant positive ES clones by PCR genotyping ES cell: Embryonic stem cell; 5p: 5′Homologous recombination arm; 3p: 3′Homologous recombination arm; M: DNA ladder marker. B1, B2, D2, D6, E10: Clones with correct homologous recombination of both homologous arms |
2.3 首建鼠的获得与繁育
先后分别注射上述5株ES细胞克隆至268枚囊胚,并将胚胎移植至26只受体假孕雌鼠,得到8只F0代小鼠。从毛色判断,其中4只雄性小鼠嵌合度>50%。将嵌合雄鼠与野生C57BL/6J雌鼠交配,其中分别来自ES细胞克隆B2、D2的2只嵌合鼠产生F1代灰鼠23只。经PCR鉴定,其中5只为阳性杂合子小鼠(图 3),从而获得可以种系传代的基因工程小鼠,记为ChREBPflox-neo/+ 小鼠。为去除neo基因,将该F1代杂合子小鼠与flp转基因小鼠交配,获得同时携带flp与ChREBPflox-neo的子代小鼠,通过鼠尾基因组DNA的PCR检测,证实neo基因被成功去除,将不含neo基因的ChREBP重组等位基因记为ChREBPflox/+(图 4A)。进一步与C57BL6/J小鼠交配,获得不含有flp的ChREBPflox/+小鼠。
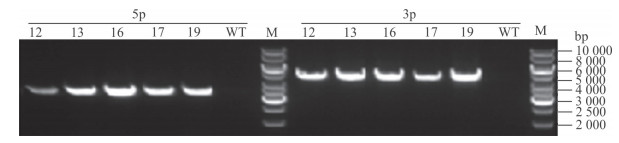
|
图 3 F1代小鼠ChREBP基因重组的PCR基因型鉴定 Fig 3 Identification of recombinant ChREBP gene in F1 mice by PCR genotyping ChREBP: Carbohydrate response element-binding protein; 5p: 5′Homologous recombination arm; 3p: 3′Homologous recombination arm; WT: Wild type; M: DNA ladder marker. 12, 13, 16, 17, 19:F1 mice with ChREBPflox-neo/+ genotype |
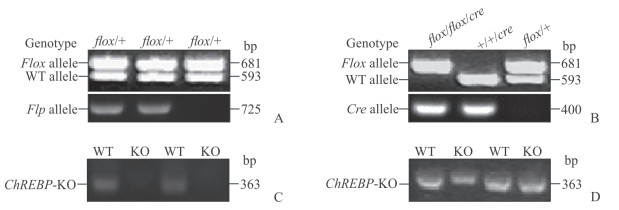
|
图 4 小鼠基因型和ChREBP基因敲除PCR鉴定结果 Fig 4 PCR genotyping and ChREBP gene knockout results of mice A: Identification of neo gene deletion in mice by PCR genotyping; B: Identification of ChREBP gene deletion in mice by PCR genotyping; C: Identification of ChREBP gene deletion in the liver of mice by PCR; D: Identification of ChREBP gene deletion in the intestine of mice by PCR. ChREBP: Carbohydrate response element-binding protein; WT: Wild type; KO: Knockout |
2.4 条件敲除小鼠的建立
将ChREBPflox/+小鼠与Alb-Cre小鼠进行交配,获得ChREBPflox/+; Alb-Cre杂合小鼠;然后,通过杂合子与杂合子小鼠的交配获得ChREBPflox/flox; Alb-Cre纯合子小鼠,即为ChREBP的肝脏特异性敲除小鼠。为便于快速的批量基因型分析,本研究针对第8外显子下游的loxP位点设计了基因型鉴定引物,可分别从野生型和重组的ChREBP等位基因中扩增出593 bp、681 bp的DNA条带(图 4B),结合Cre的鉴定结果,可快速判断小鼠的基因型。另外,提取肝脏及小肠组织基因组DNA,针对第8外显子设计引物进行PCR,结果显示ChREBP基因在肝脏中被特异性敲除,而肠道中的ChREBP基因则不受影响(图 4C、4D)。
3 讨论自2001年ChREBP被发现以来,对ChREBP的生理功能的研究一直在持续向前推进。在以往对小鼠ChREBP全身敲除模型的研究中发现,全身ChREBP敲除小鼠对果糖不耐受,糖酵解及脂肪酸合成能力减弱[10],肝脏糖原堆积[5]。近年研究发现,肝脏ChREBP在介导肝脏免受毒性损伤方面发挥重要作用[11];脂肪中的ChREBP缺失会导致全身的胰岛素抵抗,并使葡萄糖转运受损[12];肠道中ChREBP的缺失则会导致果糖吸收障碍和不耐受[13],这些结果表明ChREBP在体内糖脂代谢中发挥着重要的生理功能。此外,ChREBP也对肿瘤的发生、发展有着重要的影响。例如, 在人结肠癌细胞系HTC116中抑制ChREBP可导致p53激活[14];在前列腺癌中,ChREBP的激活与肿瘤细胞的增殖扩散有关[15];而在白血病中,ChREBP则可促进白血病细胞的分化从而减少白血病的发生、发展。这些结果提示ChREBP在不同的细胞中对肿瘤的发生、发展有着不同的作用,ChREBP的体内功能具有复杂多样性。
为了更好地研究ChREBP在体内的生物学功能,本研究利用Cre/loxP系统建立了ChREBP的条件敲除小鼠模型。Cre/loxP系统源于F1噬菌体,通过Cre重组酶特异性识别loxP位点并切割位于2个loxP之间的DNA序列,达到敲除某个基因的目的[16]。这种方法不仅可以实现对某种组织特定基因的敲除,并且具有敲除效率高、应用范围广、胚胎致死率低的优点[17],因而其在动物基因敲除方面应用广泛。ES细胞法是目前制备转基因动物的常用方法。ES细胞是从早期胚胎和原始性腺中分离出来的一类细胞,具有体外无限增殖、多向分化、自我更新的特点。将外源性基因通过电穿孔等方法导入ES细胞后,分选获得克隆正确、生长较好的ES细胞,将其注射入小鼠胚泡中可发育形成嵌合体小鼠,再经过杂交即可获得纯合子小鼠。在本研究中,我们采用ES细胞法构建ChREBP转基因小鼠。首先利用A、B 2个同源臂在体外将包含第8号外显子的长片段克隆至取获载体,构建了预打靶载体,然后分别利用C、D和E、F这4个小同源臂分别将loxP位点以及Frt-neo-Frt片段引入,构建成打靶载体pBR322-MK-ChREBP-KO,之后将构建好的打靶载体通过电穿孔法转入到ES细胞,通过正负性筛选获得正确的同源重组克隆并进行鉴定,挑选正确的克隆进行囊胚注射后移植入假孕雌鼠子宫中,获得嵌合鼠后继续进行交配繁殖,获得纯合子Flox小鼠后,将其与Alb-Cre小鼠交配,即实现了在小鼠肝脏组织敲除ChREBP。
本研究利用Cre/loxP系统成功建立了ChREBP条件性基因敲除小鼠模型,为揭示不同组织中ChREBP的生理功能和病理学意义提供了重要手段。
| [1] |
LIM J S, MIETUS-SNYDER M, VALENTE A, SCHWARZ J M, LUSTIG R H. The role of fructose in the pathogenesis of NAFLD and the metabolic syndrome[J]. Nat Rev Gastroenterol Hepatol, 2010, 7: 251-264. DOI:10.1038/nrgastro.2010.41 |
| [2] |
STOECKMAN A K, MA L, TOWLE H C. Mlx is the functional heteromeric partner of the carbohydrate response element-binding protein in glucose regulation of lipogenic enzyme genes[J]. J Biol Chem, 2004, 279: 15662-15669. DOI:10.1074/jbc.M311301200 |
| [3] |
IIZUKA K, HORIKAWA Y. ChREBP:a glucose-activated transcription factor involved in the development of metabolic syndrome[J]. Endocr J, 2008, 55: 617-624. DOI:10.1507/endocrj.K07E-110 |
| [4] |
周露婷, 章卫平. 转录因子碳水化合物反应元件结合蛋白对肝脏糖脂代谢的调节作用[J]. 第二军医大学学报, 2011, 32: 318-322. ZHOU L T, ZHANG W P. Regulatory role of carbohydrate response element binding protein on hepatic glycolysis and lipogenesis[J]. Acad J Sec Mil Med Univ, 2011, 32: 318-323. |
| [5] |
IIZUKA K, BRUICK R K, LIANG G, HORTON J D, UYEDA K. Deficiency of carbohydrate response element-binding protein (ChREBP) reduces lipogenesis as well as glycolysis[J]. Proc Natl Acad Sci USA, 2004, 101: 7281-7286. DOI:10.1073/pnas.0401516101 |
| [6] |
HERMAN M A, PERONI O D, VILLORIA J, SCHÖN M R, ABUMRAD N A, BLÜHER M, et al. A novel ChREBP isoform in adipose tissue regulates systemic glucose metabolism[J]. Nature, 2012, 484: 333-338. DOI:10.1038/nature10986 |
| [7] |
LIU G, ZHOU L, ZHANG H, CHEN R, ZHANG Y, LI L, et al. Regulation of hepatic lipogenesis by the zinc finger protein Zbtb20[J]. Nat Commun, 2017, 8: 14824. DOI:10.1038/ncomms14824 |
| [8] |
XIE Z, ZHANG H, TSAI W, ZHANG Y, DU Y, ZHONG J, et al. Zinc finger protein ZBTB20 is a key repressor of alpha-fetoprotein gene transcription in liver[J]. Proc Natl Acad Sci USA, 2008, 105: 10859-10864. DOI:10.1073/pnas.0800647105 |
| [9] |
李玲, 国蓉, 常绪生, 印慨, 张晔, 刘志民, 等. 利用细菌内同源重组技术构建胰岛β细胞特异性表达Cre重组酶的基因敲入打靶载体[J]. 第二军医大学学报, 2014, 35: 185-190. LI L, GUO R, CHANG X S, YIN K, ZHANG Y, LIU Z M, et al. Generation of islet β cell-specific Cre recombinase targeting vector by homologous recombination in bacteria[J]. Acad J Sec Mil Med Univ, 2014, 35: 185-190. |
| [10] |
ISHⅡ S, ⅡZUKA K, MILLER B C, UYEDA K. Carbohydrate response element binding protein directly promotes lipogenic enzyme gene transcription[J]. Proc Natl Acad Sci USA, 2004, 101: 15597-15602. DOI:10.1073/pnas.0405238101 |
| [11] |
ZHANG D, TONG X, VANDOMMELEN K, GUPTA N, STAMPER K, BRADY G F, et al. Lipogenic transcription factor ChREBP mediates fructose-induced metabolic adaptations to prevent hepatotoxicity[J]. J Clin Invest, 2017, 127: 2855-2867. DOI:10.1172/JCI89934 |
| [12] |
VIJAYAKUMAR A, ARYAL P, WEN J, SYED I, VAZIRANI R P, MORAES-VIEIRA P M, et al. Absence of carbohydrate response element binding protein in adipocytes causes systemic insulin resistance and impairs glucose transport[J]. Cell Rep, 2017, 21: 1021-1035. DOI:10.1016/j.celrep.2017.09.091 |
| [13] |
KIM M, ASTAPOVA I I, FLIER S N, HANNOU S A, DORIDOT L, SARGSYAN A, et al. Intestinal, but not hepatic, ChREBP is required for fructose tolerance[J]. JCI Insight, 2017, 2: pii:96703. DOI:10.1172/jci.insight.96703 |
| [14] |
TONG X, ZHAO F, MANCUSO A, GRUBER J J, THOMPSON C B. The glucose-responsive transcription factor ChREBP contributes to glucose-dependent anabolic synthesis and cell proliferation[J]. Proc Natl Acad Sci USA, 2009, 106: 21660-21665. DOI:10.1073/pnas.0911316106 |
| [15] |
ATALA A. Re:inhibition of the hexosamine biosynthetic pathway promotes castration-resistant prostate cancer[J]. J Urol, 2017, 197: 403. DOI:10.1016/j.juro.2016.11.022 |
| [16] |
GU H, ZOU Y R, RAJEWSKY K. Independent control of immunoglobulin switch recombination at individual switch regions evidenced through Cre-loxP-mediated gene targeting[J]. Cell, 1993, 73: 1155-1164. DOI:10.1016/0092-8674(93)90644-6 |
| [17] |
KÜHN R, SCHWENK F. Advances in gene targeting methods[J]. Curr Opin Immunol, 1997, 9: 183-188. DOI:10.1016/S0952-7915(97)80133-1 |
 2019, Vol. 40
2019, Vol. 40


