2. 福建中医药大学药学院, 福州 350122;
3. 浙江中医药大学药学院生药学教研室, 杭州 310053
2. School of Pharmacy, Fujian University of Traditional Chinese Medicine, Fuzhou 350122, Fujian, China;
3. Department of Pharmacognosy, School of Pharmacy, Zhejiang Chinese Medical University, Hangzhou 310053, Zhejiang, China
巴戟天为茜草科植物巴戟天(Morinda officinalis How.)的干燥根,主产于我国广东、广西和福建,具有补肾阳、强筋骨、祛风湿的作用[1-2]。研究表明,巴戟天含有多糖、寡糖、环烯醚萜苷和蒽醌类化学成分,具有抗抑郁、免疫调节、抗骨质疏松、抗类风湿性关节炎、抗炎镇痛和抗氧化等多种生物活性[3-7]。巴戟天中环烯醚萜苷类成分(Morinda officinalis iridoid glycosides,MOIG)的含量较高,可达到2.0%左右,且具有抗炎镇痛、抗类风湿性关节炎、抗骨质疏松等多种药理作用[8-10]。特别是MOIG中的水晶兰苷可抑制去卵巢和脂多糖(lipopolysaccharide,LPS)诱导的小鼠骨丢失[11],显示出抗骨质疏松和抗炎作用。然而,关于MOIG的富集和纯化研究尚未见报道。因此,本实验在课题组前期研究[12]的基础上,应用大孔吸附树脂富集MOIG,并评价其对破骨细胞性骨吸收的作用,为MOIG的开发利用提供科学依据。
1 材料和方法 1.1 仪器Agilent 1100型高效液相色谱仪(包括四元泵、手动进样器、柱温箱、DAD检测器),美国Agilent公司;AG285型电子分析天平,瑞士Mettler-Toledo公司;DHG-9145A型电热恒温鼓风干燥箱,上海一恒科技有限公司;W2-100SP型旋转蒸发仪,上海申生科技有限公司;HYG-A型全温摇瓶柜,苏州培英实验设备有限公司;ELX800型连续波长酶标仪,美国Bio-Tek公司;DMI3000B型Leica倒置荧光显微镜,成贯仪器(上海)有限公司;TDL80-2B型台式离心机,上海安亭科学仪器制造厂。
1.2 试药与试剂巴戟天药材采自广东肇庆,由海军军医大学(第二军医大学)药学院生药学教研室张巧艳教授鉴定为茜草科植物巴戟天(Morinda officinalis How.)的干燥根。水晶兰苷标准品(批号:Z09D6X7027,纯度>98%)和去乙酰基车叶草苷酸标准品(批号:Z26D6B8130,纯度>98%)购于上海源叶生物科技有限公司。胎牛血清(fetal bovine serum,FBS),美国Gibco公司;萘酚AS-BI磷酸钠,美国Sigma公司;小鼠可溶性核因子κB受体活化因子配体(soluble receptor activator of nuclear factor κB ligand,sRANKL)和巨噬细胞集落刺激因子(macrophage colony stimulating factor,M-CSF),美国PeproTech公司;Triton X-100,上海索莱宝科技有限公司;CCK-8试剂盒,大连美仑生物技术有限公司;抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,TRAP)染色试剂盒,南京建成生物工程研究所;牛血清白蛋白(bovine serum albumin,BSA),上海碧云天生物技术有限公司;α-MEM培养液,天津灏洋生物制品科技有限公司;甲醇、乙腈为色谱纯;其他试剂均为国产分析纯试剂。AB-8、ADS-17、D101、HPD400、HPD600、HP20、S-8型大孔树脂,沧州宝恩吸附材料科技有限公司;SP850型大孔树脂,北京绿百草科技发展有限公司;XDA-1、XDA-16型大孔树脂,西安蓝晓科技新材料股份有限公司。
1.3 MOIG的含量测定将巴戟天药材粉碎至粗粉,过2号筛,用70%乙醇渗漉提取,以0.8 BV/h(1 BV=80 mL)的流速收集16 BV渗漉液。渗漉液减压浓缩后加适量水定容至质量浓度为1.0 g/mL,备用。
精密称取水晶兰苷标准品和去乙酰基车叶草苷酸标准品适量,用初始流动相分别制备成浓度为840 μg/mL和626 μg/mL的对照品储备液。
参考本课题组前期建立的高效液相色谱(high-performance liquid chromatography,HPLC)法[12]进行测定。艾杰尔Venusil MP C18色谱柱(250 mm×4.6 mm,5 µm);以乙腈(A)-0.2%磷酸+0.01 mol/L磷酸氢二钠缓冲盐(B)为流动相,梯度洗脱0~12 min(1%~2% A),检测波长为235 nm,流速为1.0 mL/min,柱温为25 ℃,进样量为20 µL。各个目标峰分离度>1.5。水晶兰苷和去乙酰基车叶草苷酸分别在3.28~420 μg/mL和2.45~313 μg/mL浓度范围内线性关系良好(相关系数分别为0.999 9和1.000 0)。方法学考察结果表明精密度、重复性、样品溶液稳定性、加样回收率均符合含量测定要求。
1.4 MOIG供试品溶液的制备取1.3项制备的质量浓度为1.0 g/mL的巴戟天提取液300 mL,定容至质量浓度为0.5 g/mL的供试品溶液(MOIG质量浓度为9.57 mg/mL)。
1.5 大孔树脂型号选择 1.5.1 树脂的预处理取AB-8、ADS-17、D101、HPD400、HPD600、HP20、S-8、SP850、XDA-1和XDA-16型大孔树脂适量,分别用乙醇浸泡24 h充分溶胀后,用95%乙醇冲洗,直至洗出液按1︰3比例加水无白色浑浊现象,再用水洗至无醇味。依次用5% HCl水溶液浸泡4 h,再用蒸馏水洗至中性,继用5% NaOH水溶液重复以上操作,备用。
1.5.2 静态吸附-解吸附性能的考察取已处理的AB-8、ADS-17、D101、HPD400、HPD600、HP20、S-8、SP850、XDA-1和XDA-16型大孔树脂各5 g置于250 mL的锥形瓶中,加入MOIG质量浓度为9.57 mg/mL的供试品溶液50 mL,于恒温摇床中振荡24 h后,将吸附饱和的树脂用50 mL纯水振荡24 h、50 mL 95%乙醇振摇24 h进行解吸附。按1.3项方法测定解析液中MOIG的含量,重复3次,计算树脂的平均吸附量和解吸附率。
1.6 XDA-1型大孔树脂富集MOIG的性能考察 1.6.1 上样液质量浓度分别取5 g XDA-1型大孔树脂置于5个250 mL锥形瓶中,分别加入MOIG质量浓度为19.15、15.32、11.49、7.66、3.83 mg/mL的供试品溶液50 mL,于恒温摇床中振荡4 h后,按1.3项方法测定溶液中MOIG的质量浓度,重复3次,计算树脂平均吸附量以确定最佳上样液质量浓度。
1.6.2 pH条件取已处理好的XDA-1型大孔树脂,加入用盐酸和氨水调至pH值分别为1.0、3.0、5.0、7.0、9.0的MOIG(质量浓度为19.15 mg/mL)供试品溶液,于恒温摇床中振荡4 h,按1.3项方法测定溶液中MOIG的吸附量,重复3次,计算树脂平均吸附量以确定pH值。
1.6.3 静态吸附动力学取5 g XDA-1型大孔树脂置于250 mL锥形瓶中,加50 mL MOIG质量浓度为19.15 mg/mL的供试品溶液,室温振荡,分别于1、3、5、7、9、11、13、24 h时按1.3项方法测定上样液中MOIG的质量浓度,重复3次,计算树脂对MOIG的平均比吸附量,以确定完全吸附时间。
1.6.4 上样流速取5份MOIG质量浓度为19.15 mg/mL的供试品溶液各35 mL,分别以1.0、2.0、3.0、4.0 BV/h的流速通过装有30 g树脂的柱子,按1.3项方法测定过柱液中MOIG的含量,重复3次,计算树脂的平均吸附率,以确定最佳上样流速。
1.6.5 柱径高比取5份1 BV体积的MOIG供试品溶液(质量浓度为19.15 mg/mL),以2.0 BV/h的流速分别通过径高比为1︰3、1︰5、1︰7、1︰9、1︰11的树脂柱,收集过柱液,按1.3项方法测定过柱液中MOIG的含量,重复3次,计算树脂的平均吸附率,以确定最佳径高比。
1.6.6 上样量取XDA-1型大孔树脂,按径高比1︰7装柱(树脂70 g,柱体积80 mL),以2.0 BV/h的流速加入MOIG供试品溶液,每20 mL收集1份流出液,按1.3项方法测定流出液中MOIG的质量浓度,绘制泄露曲线,以选择最大上样量。
1.6.7 洗脱溶剂按上述优化条件,取MOIG供试品溶液进行试验。吸附完毕后,依次用水和10%、30%、50%乙醇洗脱(体积流量为2.0 BV/h),收集各洗脱液7 BV,按1.3项方法测定MOIG的质量浓度,重复3次,计算平均累积洗脱率,以确定最优洗脱溶剂。
1.6.8 洗脱流速按上述优化条件,取MOIG质量浓度为19.15 mg/mL的供试品溶液50 mL通过径高比为1︰7的大孔树脂柱,先用7 BV的水洗脱,再用10%乙醇以1.0、2.0、3.0、4.0 BV/h的流速洗脱,收集并按1.3项方法检测洗脱液中MOIG的质量浓度,重复3次,计算平均洗脱率,以确定最佳洗脱流速。
1.6.9 洗脱溶剂用量按上述优化条件,取MOIG供试品溶液进行试验。吸附完毕后,先用7 BV的水洗脱,再用10%乙醇洗脱,洗脱流速为3.0 BV/h,每1 BV收集1份洗脱液,按1.3项方法检测洗脱液中MOIG的质量浓度,重复3次,以确定最佳洗脱溶剂用量。
1.6.10 验证试验按优选条件进行验证:上样液中MOIG的质量浓度为19.15 mg/mL,pH值为1.0,树脂柱的径高比为1︰7,上样流速为2.0 BV/h,上样体积为0.75 BV,树脂吸附11 h后用7 BV水洗脱以除去其他成分,10%乙醇以3.0 BV/h流速进行洗脱,收集10%乙醇洗脱部位,减压浓缩得MOIG。进行3次平行试验和3次放大试验,按1.3项方法分别测定样品中水晶兰苷和去乙酰基车叶草苷酸的含量,计算转移率。
1.7 MOIG对破骨细胞的作用 1.7.1 MOIG溶液配制精密称取按1.6.10项方法制备得到的MOIG 5 mg,置于10 mL容量瓶中,用磷酸盐缓冲液(phosphate buffered saline,PBS)溶解,定容,得到质量浓度为0.5 mg/mL的储备液。
1.7.2 破骨细胞的诱导与培养取6周龄雄性C57BL/6小鼠[购自上海斯莱克实验动物有限责任公司,许可证号:SCXK(沪)2012-0002],脱颈椎处死后,用75%乙醇浸泡5~10 min。超净台中取下胫骨和股骨,用5 mL注射器吸取α-MEM培养液将骨髓腔内的骨髓细胞冲出,收集冲洗液,225×g离心10 min,细胞用PBS冲洗2次,得新鲜骨髓单核细胞[13]。用含5 ng/mL M-CSF和10% FBS的α-MEM培养液培养细胞,于37 ℃、5% CO2培养箱中培养24 h。将未贴壁细胞转移至离心管中,225×g离心10 min,收集底部细胞用含30 ng/mL M-CSF和10% FBS的α-MEM培养液培养,以1×105/mL(MTT实验)、1×106/mL(TRAP染色)细胞密度接种于96孔板中。第3天换含30 ng/mL M-CSF和50 ng/mL sRANKL及10% FBS的α-MEM培养液培养,每3 d换液1次,8 d后破骨细胞分化成熟。
1.7.3 破骨细胞形态观察及鉴定按照文献[14]方法,用TRAP染色试剂盒对诱导的破骨细胞进行染色。
1.7.4 MTT破骨细胞增殖测定[15]破骨细胞以1×105/mL细胞密度接种于96孔板中。第3天换含30 ng/mL M-CSF和1.7.1项MOIG储备液稀释得到质量浓度为0.1、1、10 μg/mL的MOIG的培养液,2 d后称取MTT 50 mg溶于10 mL PBS中,避光震荡30 min,0.22 μm滤膜过滤除菌,分装于避光离心管中,4 ℃保存、备用。细胞中加入100 μL无血清α-MEM培养液和10 μL CCK-8试剂,37 ℃、5% CO2条件下培养1 h后,于450 nm波长处测定光密度(D)值。
1.7.5 破骨细胞TRAP活性的测定[16-17]破骨细胞以1×106/mL细胞密度接种于96孔板中。第3天换含30 ng/mL M-CSF和50 ng/mL sRANKL及1.7.1项MOIG储备液稀释得到质量浓度为0.04、0.4、4 μg/mL的MOIG的培养液,第9天弃去旧液,加入1% Triton X-100 20 μL室温破细胞膜30 min后,加入反应液100 μL(0.02 g对硝基苯基磷酸二钠,用去离子水溶解,加入0.1 g酒石酸钾钠,加水溶解至7.5 mL,HCl调节pH至3.5,加水定容至10 mL),于37 ℃孵育30 min后,迅速加入1 mol/L NaOH溶液100 μL终止反应,于405 nm波长处测定D值。以对硝基苯酚溶液作标准线,TRAP活性用每孔破骨细胞生成的对硝基苯酚的纳摩尔数表示。
1.8 统计学处理应用GraphPad Prism 5.0软件进行统计学分析,实验数据以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。检验水准(α)为0.05。
2 结果 2.1 树脂型号的选择大孔树脂AB-8、ADS-17、D101、HPD400、HPD600、HP20、S-8、SP850、XDA-1和XDA-16的静态吸附-解吸附性能的结果如表 1所示,XDA-1型大孔树脂对MOIG的吸附量为(38.29±1.31)mg/g,水的解吸附率较小,为(19.00±0.82)%,而95%乙醇的解吸附率较大,为(75.09±2.36)%,故选择XDA-1型大孔树脂富集MOIG。
|
|
表 1 10种大孔树脂对MOIG的吸附量和解吸附率 Tab 1 Adsorption capacity and desorption rate of 10 macroporous resins for MOIG |
2.2 XDA-1型大孔树脂富集MOIG的性能考察 2.2.1 上样液质量浓度
上样液中MOIG质量浓度为19.15、15.32、11.49、7.66、3.83 mg/mL时,XDA-1型大孔树脂吸附量分别为(70.40±1.13)、(62.44±2.29)、(53.78±0.83)、(37.09±1.12)、(20.42±0.31)mg/g,故选择最佳质量浓度为19.15 mg/mL(按生药计1.0 g/mL)。
2.2.2 pH条件上样液的pH值分别为1.0、3.0、5.0、7.0、9.0时,XDA-1型大孔树脂对MOIG的吸附量分别为(95.42±0.71)、(76.63±0.64)、(74.19±0.61)、(71.18±1.09)、(62.16±0.33)mg/g,表明随着pH值的降低,XDA-1型大孔树脂对MOIG的吸附量增加,当pH值降到1.0时树脂的吸附量最大,故选择上样液的pH值为1.0。
2.2.3 静态吸附动力学XDA-1型大孔树脂在不同时间点吸附MOIG的结果见图 1。XDA-1型大孔树脂在1 h内的吸附速率很快,3 h后开始变缓,11 h基本稳定,此时总的比吸附量为(90.18±0.44)mg/g,因此确定树脂吸附11 h后进行洗脱。
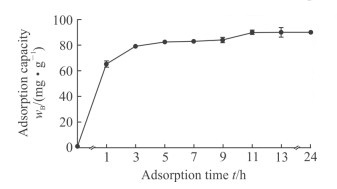
|
图 1 XDA-1型大孔树脂在不同时间点对 Fig 1 Adsorption capacity of XDA-1 macroporous resin for MOIG at different time points MOIG: Morinda officinalis iridoid glycosides. n=3, x±s |
2.2.4 上样流速
当上样流速为1.0、2.0、3.0、4.0 BV/h时,XDA-1型大孔树脂对MOIG的吸附率分别为(91.01±0.43)%、(90.62±0.38)%、(84.21±1.77)%、(81.55±0.90)%,表明吸附率随上样流速的增大而降低。当上样流速在1.0 BV/h和2.0 BV/h时吸附率均较大,综合分析选择上样流速为2.0 BV/h。
2.2.5 柱径高比MOIG供试品溶液以2.0 BV/h的流速分别通过径高比为1︰3、1︰5、1︰7、1︰9、1︰11的XDA-1型大孔树脂柱时,其对MOIG的吸附率分别为(79.18±0.84)%、(88.01±2.64)%、(93.04±1.05)%、(96.90±0.51)%、(97.48±0.05)%,表明随着径高比的增大吸附率逐渐增加,当径高比大于1︰7时吸附率增加变缓,考虑实际操作的难度最终选择径高比为1︰7。
2.2.6 上样量结果显示,当上样量为0.75 BV时MOIG基本被树脂吸附,当上样量大于0.75 BV时开始出现泄露,上样量为7 BV时达到动态平衡,最大动态吸附量为(97.28±1.94)mg/g,为确保吸附完全,选择最大上样量为0.75 BV。见图 2。
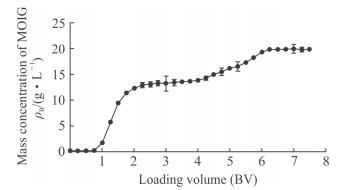
|
图 2 上样量考察 Fig 2 Investigation of loading amount 1 BV=80 mL. MOIG: Morinda officinalis iridoid glycosides; BV: Bed volume. n=3, x±s |
2.2.7 洗脱溶剂
结果显示,水和10%、30%、50%乙醇的累积洗脱率分别为(18.62±1.11)%、(94.85±0.95)%、(98.59±1.07)%、(98.74±1.09)%,10%乙醇可以将大部分的MOIG从XDA-1型大孔树脂洗脱,故确定10%乙醇为洗脱溶剂。
2.2.8 洗脱流速和溶剂用量用10%乙醇以1.0、2.0、3.0、4.0 BV/h的流速洗脱时,MOIG的洗脱率分别为(80.03±2.07)%、(78.36±0.90)%、(77.09±1.56)%、(72.78±2.62)%,1.0~3.0 BV/h下降趋势缓慢,至4.0 BV/h时下降趋势增加,故选择3.0 BV/h作为最佳洗脱流速。
通过监测每1 BV洗脱液中MOIG的质量浓度,发现7 BV以后的洗脱液中MOIG含量极少,故确定洗脱剂用量为7 BV(图 3)。
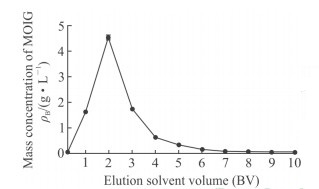
|
图 3 洗脱溶剂用量考察 Fig 3 Investigation of elution solvent volume 1 BV=80 mL. MOIG: Morinda officinalis iridoid glycosides. BV: Bed volume. n=3, x±s |
2.2.9 验证试验
3次平行试验和放大试验的结果(表 2)表明,MOIG经XDA-1型大孔树脂纯化后,MOIG中水晶兰苷和去乙酰基车叶草苷酸的总含量达54%以上,表明该优选工艺稳定、可靠。
|
|
表 2 XDA-1型大孔树脂富集MOIG的相关参数 Tab 2 Related parameters of XDA-1 macroporous resin enriching MOIG |
2.3 MOIG对破骨细胞的作用 2.3.1 MOIG对破骨细胞增殖的影响
成熟的破骨细胞经TRAP染色后,破骨细胞呈油煎鸡蛋形,细胞质染成紫色,细胞内可见多个细胞核,呈现圆形和椭圆形(图 4)。MOIG给药浓度分别为0.1、1、10 µg/mL,给药后测得的D值分别为1.11±0.14、1.11±0.18、1.11±0.13,未给药组细胞D值为1.03±0.12,表明任一质量浓度的MOIG对破骨细胞的增殖均无明显影响。
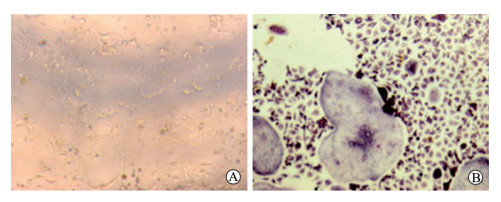
|
图 4 成熟破骨细胞(A)和TRAP染色破骨细胞(B) Fig 4 Mature osteoclasts (A) and TRAP staining osteoclasts (B) TRAP: Tartrate-resistant acid phosphatase. Original magnification: ×100 |
2.3.2 MOIG对破骨细胞TRAP活性的影响
结果显示,空白对照组破骨细胞TRAP活性为100.01±13.92,0.04、0.4、4 µg/mL MOIG给药后测得的TRAP活性分别为62.85±16.80、50.29±1.42、53.13±10.41,分别比空白对照组降低37.16%(P<0.05)、49.71%(P<0.01)、46.88%(P<0.01)。表明MOIG可抑制破骨细胞TRAP活性,从而抑制了破骨细胞的骨吸收。
3 讨论MOIG的极性较大,易溶于水和乙醇,其中水晶兰苷和去乙酰基车叶草苷酸含量较高,二者属于同分异构体,理化性质相似,母核上均含有羧基,具有一定酸性。研究表明水晶兰苷单体在酸性条件下存放3 d时,有近6%转化为去乙酰基车叶草苷酸,而去乙酰基车叶草苷酸单体相对稳定[12, 18]。原药材经70%乙醇提取后水晶兰苷和去乙酰基车叶草苷酸含量的比值约为2︰1,经调pH值过大孔树脂富集后,所得MOIG中水晶兰苷和去乙酰基车叶草苷酸含量比值约为3︰2,研究表明仅有小部分水晶兰苷转化为去乙酰基车叶草苷酸[19]。本课题组进行的药效学实验表明巴戟天总提取物和MOIG均有抗骨质疏松作用,故水晶兰苷的部分转化并不影响MOIG的药效[11]。
本研究观察了AB-8、ADS-17、D101、HPD400、HP20、SP850、XDA-1和XDA-16等非极性树脂,以及S-8和HPD600等极性树脂对MOIG的吸附和解吸附作用,筛选合适的树脂型号。结合本课题组前期正交试验优化的MOIG提取工艺[11],本实验以水晶兰苷和去乙酰基车叶草苷酸为指标成分进行研究,结果表明XDA-1型大孔树脂能更好地富集MOIG,经大孔树脂富集后MOIG中水晶兰苷和去乙酰基车叶草苷酸的总含量达54%以上,浸膏得率为2%左右,转移率达60%以上。富集过程中除去了大量杂质,提高了所得物中MOIG的纯度,从而减少了药物剂量。
王玉磊[20]用大孔树脂、活性炭从巴戟天中分离纯化水晶兰苷,操作过程烦琐,且含量仅从2%提高到6%左右。彭朵花等[21]先用石油醚、乙酸乙酯、正丁醇萃取后,再经D101型大孔树脂富集,操作步骤复杂。而本实验用XDA-1型大孔树脂富集后,MOIG含量从原药材的2%提高至54%以上,且实际操作简单,工艺稳定。
本课题组前期研究表明,MOIG能减缓佐剂和Ⅱ型胶原诱导的大鼠类风湿性关节炎的发生和骨质丢失,显示出良好的抗骨质疏松和抗炎作用(未发表资料)。基于上述发现,我们进行了MOIG的富集研究,以期将其研制成防治炎症性骨丢失的药物。本实验研究了MOIG对破骨细胞的增殖和TRAP活性的影响,结果表明MOIG浓度在0.04~4 µg/mL范围内均能抑制破骨细胞TRAP活性,降低破骨细胞的骨吸收能力,抑制骨丢失,为本课题组后期研究MOIG对破骨细胞的作用和抗骨质疏松机制奠定了基础。而制备得到的MOIG中仅由其中的环烯醚萜苷类成分发挥药理作用还是其他成分同时发挥作用,有待于进一步深入研究。
综上所述,XDA-1型大孔树脂可用于富集MOIG,且其含量达54%以上,因此可将其制备成需要的药物剂型,为进一步的临床应用奠定了基础。MOIG对破骨细胞性骨吸收的抑制作用也为将中药巴戟天开发成抗骨质疏松的中药新药提供了科学依据。
| [1] |
国家药典委员会.中华人民共和国药典[S].一部.北京: 中国医药科技出版社, 2015: 81.
|
| [2] |
ZHANG J H, XIN H L, XU Y M, SHEN Y, HE Y Q, HSIEN-YEH, et al. Morinda officinalis How.-a comprehensive review of traditional uses, phytochemistry and pharmacology[J]. J Ethnopharmacol, 2018, 213: 230-255. DOI:10.1016/j.jep.2017.10.028 |
| [3] |
XU L Z, XU D F, HAN Y, LIU L J, SUN C Y, DENG J H, et al. BDNF-GSK-3β-β-catenin pathway in the mPFC is involved in antidepressant-like effects of Morinda officinalis oligosaccharides in rats[J]. Int J Neuropsychopharmacol, 2017, 20: 83-93. |
| [4] |
QIU Z K, LIU C H, GAO Z W, HE J L, LIU X, WEI Q L, et al. The inulin-type oligosaccharides extract from Morinda officinalis, a traditional Chinese herb, ameliorated behavioral deficits in an animal model of post-traumatic stress disorder[J]. Metab Brain Dis, 2016, 31: 1143-1149. DOI:10.1007/s11011-016-9853-7 |
| [5] |
LIANG J, LIANG J W, HAO H R, LIN H, WANG P, WU Y F, et al. The extracts of Morinda officinalis and its hairy roots attenuate dextran sodium sulfate-induced chronic ulcerative colitis in mice by regulating inflammation and lymphocyte apoptosis[J]. Front Immunol, 2017, 8: 905-922. DOI:10.3389/fimmu.2017.00905 |
| [6] |
LEE Y K, BANG H J, OH J B, WHANG W K. Bioassay-guided isolated compounds from Morinda officinalis inhibit Alzheimer's disease pathologies[J]. Molecules, 2017, 22: E1638. DOI:10.3390/molecules22101638 |
| [7] |
ZHANG H L, LI J, XIA J M, LIN S Q. Antioxidant activity and physicochemical properties of an acidic polysaccharide from Morinda officinalis[J]. Int J Biol Macromol, 2013, 58: 7-12. DOI:10.1016/j.ijbiomac.2013.03.031 |
| [8] |
WANG F, WU L, LI L, CHEN S. Monotropein exerts protective effects against IL-1β-induced apoptosis and catabolic responses on osteoarthritis chondrocytes[J]. Int Immunopharmacol, 2014, 23: 575-580. DOI:10.1016/j.intimp.2014.10.007 |
| [9] |
ZHANG Z G, ZHANG Q Y, YANG H, LIU W, ZHANG N D, QIN L P, et al. Monotropein isolated from the roots of Morinda officinalis increases osteoblastic bone formation and prevents bone loss in ovariectomized mice[J]. Fitoterapia, 2016, 110: 166-172. DOI:10.1016/j.fitote.2016.03.013 |
| [10] |
SHIN J S, YUN K J, CHUNG K S, SEO K H, PARK H J, CHO Y W, et al. Monotropein isolated from the roots of Morinda officinalis ameliorates proinflammatory mediators in RAW 264.7 macrophages and dextran sulfate sodium (DSS)-induced colitis via NF-κB inactivation[J]. Food Chem Toxicol, 2013, 53: 263-271. DOI:10.1016/j.fct.2012.12.013 |
| [11] |
HE Y Q, YANG H, SHEN Y, ZHANG J H, ZHANG Z G, LIU L L, et al. Monotropein attenuates ovariectomy and LPS-induced bone loss in mice and decreases inflammatory impairment on osteoblast through blocking activation of NF-κB pathway[J]. Chem Biol Interact, 2018, 291: 128-136. DOI:10.1016/j.cbi.2018.06.015 |
| [12] |
张建花, 许月明, 何玉琼, 宋洪涛, 杜娟, 张巧艳. 巴戟天环烯醚萜苷类成分含量测定和提取方法的研究[J]. 药学实践杂志, 2017, 35: 328-333. DOI:10.3969/j.issn.1006-0111.2017.04.010 |
| [13] |
HONG J M, KANG K S, YI H G, KIM S Y, CHO D W. Electromagnetically controllable osteoclast activity[J]. Bone, 2014, 62: 99-107. DOI:10.1016/j.bone.2014.02.005 |
| [14] |
SONG T F, LIN T, MA J, GUO L, ZHANG L, ZHOU X H, et al. Regulation of TRPV5 transcription and expression by E2/ERα signalling contributes to inhibition of osteoclastogenesis[J]. J Cell Mol Med, 2018, 22: 4738-4750. DOI:10.1111/jcmm.13718 |
| [15] |
GRELA E, KOZŁOWSKA J, GRABOWIECKA A. Current methodology of MTT assay in bacteria-a review[J]. Acta Histochem, 2018, 120: 303-311. DOI:10.1016/j.acthis.2018.03.007 |
| [16] |
YAN X T, LEE S H, LI W, JANG H D, KIM Y H. Terpenes and sterols from the fruits of Prunus mume and their inhibitory effects on osteoclast differentiation by suppressing tartrate-resistant acid phosphatase activity[J]. Arch Pharm Res, 2015, 38: 186-192. DOI:10.1007/s12272-014-0389-2 |
| [17] |
张乃丹, 蒋益萍, 薛黎明, 韩婷, 张巧艳, 辛海量. 仙茅酚苷类成分促进成骨细胞骨形成和抑制破骨细胞骨吸收[J]. 第二军医大学学报, 2016, 37: 562-568. ZHANG N D, JIANG Y P, XUE L M, HAN T, ZHANG Q Y, XIN H L. Phenolic glycosides in Curculigo orchioides promotes osteoblastic bone formation and inhibits osteoclastic bone resorption[J]. Acad J Sec Mil Med Univ, 2016, 37: 562-568. |
| [18] |
王玉磊, 黄世敬, 迟德军, 李强, 雷海民, 崔翰明. 巴戟天中主要环烯醚萜苷的稳定性研究[J]. 中国实验方剂学杂志, 2011, 17: 65-68. |
| [19] |
SHEN Y, ZHANG Q, WU Y B, HE Y Q, HAN T, ZHANG J H, et al. Pharmacokinetics and tissue distribution of monotropein and deacetyl asperulosidic acid after oral administration of extracts from Morinda officinalis root in rats[J/OL]. BMC Complement Altern Med, 2018, 18: 288. doi: 10.1186/s12906-018-2351-1.
|
| [20] |
王玉磊.巴戟天中主要环烯醚萜苷的研究[D].北京: 北京中医药大学, 2011.
|
| [21] |
彭朵花, 周芳, 欧阳文, 杜方麓. 巴戟天中水晶兰苷的提取分离及其含量测定[J]. 中南药学, 2008, 16: 705-707. |
 2019, Vol. 40
2019, Vol. 40


