2. 徐州医科大学附属医院病理科, 徐州 221002;
3. 徐州医科大学基础医学院病理学教研室, 徐州 221004
2. Department of Pathology, The Affiliated Hospital of Xuzhou Medical University, Xuzhou 221002, Jiangsu, China;
3. Department of Pathology, College of Biomedical Science, Xuzhou Medical University, Xuzhou 221004, Jiangsu, China
胃癌是消化系统常见的恶性肿瘤, 在世界范围内其发病率位居所有肿瘤的第4位[1], 病死率位居所有肿瘤的第2位[2]。胃癌起病隐匿, 早期缺乏特异性临床表现, 多数患者就诊时已属中晚期, 因此, 寻找生物分子学标志物对于胃癌的诊断和预后判断非常重要。细胞因子信号转导抑制分子1(suppressor of cytokine signaling 1, SOCS1)由Starr等[3]于1997年发现, 其可负性调节酪氨酸激酶(Janus kinase, JAK)-信号转导和转录激活因子(signal transducer and activator of transcription, STAT)通路, 同时可抑制白细胞介素(interleukin, IL)-6、IL-7、IL-15及干扰素等多种细胞因子信号转导过程。近年来, SOCS1与肿瘤的关系逐步受到重视。本研究采用组织芯片技术和免疫组织化学染色方法探讨SOCS1在人胃癌组织中的表达, 分析其与胃癌患者临床病理参数的关系, 探讨其在胃癌患者预后中的意义。
1 资料和方法 1.1 组织标本67例胃癌及癌旁组织均来自徐州医科大学附属医院病理科2009年病理活组织检查标本, 所有标本均经甲醛溶液固定、石蜡包埋处理, 患者临床资料齐备。病理诊断结果均经2名及以上病理科医师确认。67例胃癌患者中男47例, 女20例; 年龄23~85岁, 其中 < 55岁者18例、≥55岁者49例。组织学类型:高分化腺癌3例, 中分化腺癌25例, 低分化腺癌39例; 伴有淋巴结转移者45例, 无淋巴结转移者22例。所有患者均无术前放射治疗和化学治疗史。
1.2 组织芯片构建采用Mitogen Minicore全自动组织芯片仪(英国)制作组织芯片, 取样针直径1.0 mm, 组织芯间距1.0 mm。每例胃癌及癌旁组织标本各穿取4个复孔, 以防染色过程中脱失。待所有组织标本种植于空白受体蜡块后, 对受体蜡块中组织标本排序、记录后进行连续切片。
1.3 免疫组织化学染色方法及结果判定应用SP法进行SOCS1蛋白的免疫组织化学染色。兔抗人SOCS1多克隆抗体购自北京博奥森生物技术有限公司(bs-0113R), 磷酸盐缓冲液、乙二胺四乙酸浓缩液(pH 8.0, 1:50)、SP试剂盒和DAB显色液均购自北京中杉金桥生物技术有限公司。组织切片经60℃烤片、常规脱蜡、乙二胺四乙酸高压抗原修复后, 以3% H2O2阻断内源性过氧化物酶15 min, 滴加一抗(1:100), 4℃冰箱过夜。次日取出湿盒, 室温放置1 h后滴加SP试剂盒中的试剂1及试剂2, 均于37℃孵育30 min; 每一步骤完成均以磷酸盐缓冲液洗3 min×3次。最后DAB显色20 s至8 min, 镜下控制, 适时流水冲洗终止显色反应。常规苏木精复染, 中性树胶封固。采用磷酸盐缓冲液代替一抗作空白对照, 用非免疫血清代替一抗作阴性对照。
在光学显微镜下观察免疫组织化学染色结果。SOCS1蛋白以细胞质呈棕黄色颗粒为阳性。阳性细胞百分比评分:阳性细胞百分比 < 25%记1分, ≥25%且 < 50%记2分, ≥50%且 < 75%记3分, ≥75%记4分。染色强度评分:染色强度分为弱、中、强3个等级, 分别记1、2、3分。免疫组织化学染色结果判定以阳性细胞百分比评分和染色强度评分的乘积为最终结果:>3分为阳性, ≤3分为阴性[4]。
1.4 统计学处理应用SPSS16.0软件进行统计学分析。计数资料以例数和百分数表示。SOCS1蛋白阳性在胃癌组织与癌旁组织、胃癌不同临床病理参数之间表达差异的比较采用四格表χ2检验; 根据SOCS1蛋白表达情况将患者分为阳性组和阴性组, 绘制Kaplan-Meier生存曲线, 采用log-rank检验比较两组患者的生存情况; 采用Cox比例风险回归模型分析SOCS1蛋白表达与患者预后的关系。检验水准(α)为0.05。
2 结果 2.1 胃癌及癌旁组织中SOCS1蛋白的表达胃癌与癌旁组织中SOCS1蛋白的表达主要定位于细胞质(图 1)。67例胃癌组织中54例SOCS1蛋白呈阳性表达, 阳性率为80.6%;67例癌旁组织中41例SOCS1蛋白呈阳性表达, 阳性率为61.2%。两组SOCS1蛋白阳性表达率差异有统计学意义(P=0.022)。
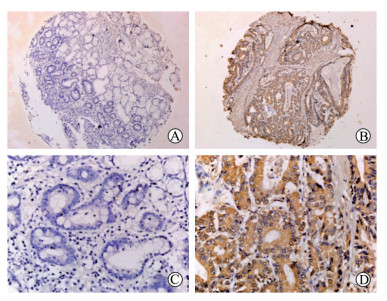
|
图 1 免疫组织化学染色检测SOCS1蛋白在胃癌及癌旁组织中的表达 A, C:癌旁正常组织; B, D:胃癌组织.SOCS1:细胞因子信号转导抑制分子1.Original magnification:×4(A, B); ×40(C, D) |
2.2 SOS1蛋白表达与胃癌患者临床病理参数间的关系
SOCS1蛋白表达阳性患者的淋巴结转移率高于阴性表达患者[74.1%(40/54) vs 38.5(5/13), P < 0.05];SOCS1蛋白阳性表达与患者性别、年龄、肿瘤TNM分期、肿瘤分化程度、肿瘤浸润深度无关(P均>0.05)。见表 1。
|
|
表 1 SOCS1蛋白表达与胃癌患者临床病理参数间的关系 |
2.3 SOCS1蛋白表达与胃癌患者预后的关系
根据SOCS1蛋白表达情况将患者分为阳性组和阴性组, 绘制Kaplan-Meier生存曲线, log-rank检验结果显示SOCS1蛋白阳性表达组患者的总生存率低于阴性表达组(P=0.027, 图 2)。单变量Cox比例风险回归模型分析结果(表 2)显示, SOCS1蛋白表达、肿瘤TNM分期、肿瘤浸润深度及有无淋巴结转移与患者预后有关; 多变量Cox比例风险回归模型分析结果(表 2)显示, SOCS1蛋白表达和肿瘤TNM分期是胃癌患者的独立预后因素。
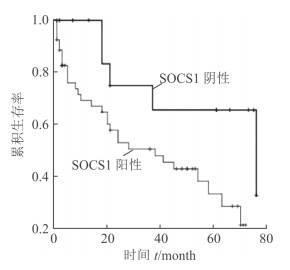
|
图 2 SOCS1蛋白表达与胃癌患者生存期的关系 SOCS1:细胞因子信号转导抑制分子1 |
|
|
表 2 单变量及多变量Cox比例风险回归模型分析SOCS1蛋白表达与胃癌患者预后的关系 |
3 讨论
SOCS1在多种肿瘤中表达异常, 且在不同的肿瘤中具有不同的功能。研究发现, SOCS1在发生脑转移的黑素瘤组织中表达降低, 而在其原发的黑素瘤组织中表达升高[5]。SOCS1在前列腺癌中可通过调控细胞周期蛋白及其激酶而发挥抑制前列腺癌细胞增殖的作用[6], 并且在肝癌、胰腺癌、急性髓系白血病及多发性骨髓瘤中低表达[7-8]。然而, 也有研究发现SOCS1在皮肤基底细胞癌中的表达较正常皮肤组织高, 且其通过抑制干扰素促进肿瘤生长[9]; SOCS1在恶性黑素瘤组织中高表达, 在黑素瘤细胞MV3和A357中沉默SOCS1表达后, 可抑制细胞增殖并且促进细胞凋亡[10]; SOCS1在乳腺癌组织中的表达较正常乳腺组织高, 其在乳腺癌中的阳性表达率高达94%[11]; SOCS1在慢性髓细胞白血病患者的外周血中高表达, 且其表达与患者化学治疗耐药有关[12]。
有关SOCS1在胃癌中表达和意义的研究较少, Li等[13]研究结果表明SOCS1在胃癌组织中低表达, 并且与患者预后不良有关。本研究结果表明, SOCS1蛋白在胃癌组织中高表达, 生存分析结果证实SOCS1蛋白阳性表达患者的总生存率低于阴性表达患者, 并且SOCS1蛋白可以作为胃癌患者预后判断的独立指标, 表明SOCS1在胃癌中发挥促肿瘤的作用。本研究结果与Li等[13]研究结果不一致, 考虑与以下因素有关:(1) SOCS1蛋白的免疫组织化学染色结果的评分标准不同。两项研究中阳性细胞百分比的评分及染色强度评分均不同, 这可能导致Li等[13]的研究中阴性表达的部分结果与本研究中阳性表达的部分结果重叠。(2)两项研究的组织标本来源不同。研究显示胃癌的发病具有地域分布的特点, 不同国家、不同地域胃癌的发病率及存活率均存在差异[14]。这种不同国家和地域导致的差异与种族、饮食习惯、环境及是否伴有幽门螺杆菌感染有关[15-16]。胃癌中SOCS1蛋白的表达是否也与这些因素有关值得探索。
本研究还发现, SOCS1蛋白的阳性表达与胃癌的淋巴结转移有关。Li等[17]研究发现, SOCS1蛋白及mRNA在黑素瘤中的表达与患者的临床分期、肿瘤侵袭及转移密切相关。Huang等[18]在研究胰腺侵袭及转移的机制中发现, miR-155可通过调节SOCS1激活STAT3调控胰腺癌的侵袭及转移。而大量研究结果表明STAT3在胃癌中高表达, 且其可通过调节血管内皮生长因子的表达参与调控胃癌的发展[19-20]。因此, 我们推测SOCS1蛋白在胃癌中的阳性表达与淋巴结转移有关的机制可能与STAT3和血管内皮生长因子有关, 但尚需进一步研究证实。
总之, 本研究结果显示SOCS1蛋白在胃癌组织中高表达, SOCS1蛋白阳性表达患者的总生存率低于阴性表达患者, 提示SOCS1在胃癌中发挥促肿瘤的作用; SOCS1蛋白阳性表达与胃癌的淋巴结转移有关, 可以作为胃癌患者预后判断的独立指标。SOCS1参与调控胃癌发展的具体分子机制有待进一步研究。
| [1] |
FERLAY J, SHIN H R, BRAY F, FORMAN D, MATHERS C, PARKIN D M. Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008[J]. Int J Cancer, 2010, 127: 2893-2917. DOI:10.1002/ijc.v127:12 |
| [2] |
JEMAL A, BRAY F, CENTER M M, FERLAY J, WARD E, FORMAN D. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61: 69-90. DOI:10.3322/caac.v61:2 |
| [3] |
STARR R, WILLSON T A, VINEY E M, MURRAY L J, RAYNER J R, JENKINS B J, et al. A family of cytokine-inducible inhibitors of signalling[J]. Nature, 1997, 387: 917-921. DOI:10.1038/43206 |
| [4] |
REMMELE W, STEGNER H E. Recommendation for uniform definition of an immunoreactive score (IRS) for immunohistochemical estrogen receptor detection (ER-ICA) in breast cancer tissue[J]. Pathologe, 1987, 8: 138-140. |
| [5] |
HU Q, QIN X, QIAN G, JIANG S, LI H, JIANG M, et al. SOCS1 silencing can break high-dose dendritic cell immunotherapy-induced immune tolerance[J]. Mol Med Rep, 2008, 1: 61-70. |
| [6] |
NEUWIRT H, PUHR M, SANTER F R, SUSANI M, DOPPLER W, MARCIAS G, et al. Suppressor of cytokine signaling (SOCS)-1 is expressed in human prostate cancer and exerts growth-inhibitory function through down-regulation of cyclins and cyclin-dependent kinases[J]. Am J Pathol, 2009, 174: 1921-1930. DOI:10.2353/ajpath.2009.080751 |
| [7] |
ZHANG J, LI H, YU J P, WANG S E, REN X B. Role of SOCS1 in tumor progression and therapeutic application[J]. Int J Cancer, 2012, 130: 1971-1980. DOI:10.1002/ijc.27318 |
| [8] |
NISHIDA N, KUDO M, NAGASAKA T, IKAI I, GOEL A. Characteristic patterns of altered DNA methylation predict emergence of human hepatocellular carcinoma[J]. Hepatology, 2012, 56: 994-1003. |
| [9] |
LANER-PLAMBERGER S, WOLFF F, KASER-EICHBERGER A, SWIERCZYNSKI S, HAUSER-KRONBERGER C, FRISCHAUF A M, et al. Hedgehog/GLI signaling activates suppressor of cytokine signaling 1(SOCS1) in epidermal and neural tumor cells[J/OL]. PLoS One, 2013, 8: e75317. doi: 10.1371/journal.pone.0075317.
|
| [10] |
YU S J, LONG Z W. Effect of SOCS1 silencing on proliferation and apoptosis of melanoma cells: an in vivo and in vitro study[J/OL]. Tumour Biol, 2017, 39: 1010428317694315. doi: 10.1177/1010428317694315.
|
| [11] |
SMOLKOVA B, MEGO M, HORVATHOVA KAJABOVA V, CIERNA Z, DANIHEL L, SEDLACKOVA T, et al. Expression of SOCS1 and CXCL12 proteins in primary breast cancer are associated with presence of circulating tumor cells in peripheral blood[J]. Transl Oncol, 2016, 9: 184-190. DOI:10.1016/j.tranon.2016.03.004 |
| [12] |
ROMAN-GOMEZ J, JIMENEZ-VELASCO A, CASTILLEJO J A, CERVANTES F, BARRIOS M, COLOMER D, et al. The suppressor of cytokine signaling-1 is constitutively expressed in chronic myeloid leukemia and correlates with poor cytogenetic response to interferon-alpha[J]. Haematologica, 2004, 89: 42-48. |
| [13] |
LI G, XU J, WANG Z, YUAN Y, LI Y, CAI S, et al. Low expression of SOCS-1 and SOCS-3 is a poor prognostic indicator for gastric cancer patients[J]. J Cancer Res Clin Oncol, 2015, 141: 443-452. DOI:10.1007/s00432-014-1838-5 |
| [14] |
TORRE L A, SIEGEL R L, WARD E M, JEMAL A. Global cancer incidence and mortality rates and trends-an update[J]. Cancer Epidemiol Biomarkers Prev, 2016, 25: 16-27. DOI:10.1158/1055-9965.EPI-15-0578 |
| [15] |
FAKHRAEI F, HAGHSHENAS M R, HOSSEINI V, RAFIEI A, NAGHSHVAR F, ALIZADEH-NAVAEI R. Detection of human papillomavirus DNA in gastric carcinoma specimens in a high-risk region of Iran[J]. Biomed Rep, 2016, 5: 371-375. DOI:10.3892/br.2016.728 |
| [16] |
KONTUREK P C, KONTUREK S J, BRZOZOWSKI T. Gastric cancer and Helicobacter pylori infection[J]. J Physiol Pharmacol, 2006, 57. |
| [17] |
LI Z, METZE D, NASHAN D, MÜLLER-TIDOW C, SERVE H L, POREMBA C, et al. Expression of SOCS-1, suppressor of cytokine signalling-1, in human melanoma[J]. J Invest Dermatol, 2004, 123: 737-745. DOI:10.1111/j.0022-202X.2004.23408.x |
| [18] |
HUANG C, LI H, WU W, JIANG T, QIU Z. Regulation of miR-155 affects pancreatic cancer cell invasiveness and migration by modulating the STAT3 signaling pathway through SOCS1[J]. Oncol Rep, 2013, 30: 1223-1230. DOI:10.3892/or.2013.2576 |
| [19] |
WANG X Y, WANG L L, ZHENG X, MENG L N, LYU B, JIN H F. Expression of p-STAT3 and vascular endothelial growth factor in MNNG-induced precancerous lesions and gastric tumors in rats[J]. World J Gastrointest Oncol, 2016, 8: 305-313. DOI:10.4251/wjgo.v8.i3.305 |
| [20] |
WU P, WU D, ZHAO L, HUANG L, SHEN G, HUANG J, et al. Prognostic role of STAT3 in solid tumors:a systematic review and meta-analysis[J]. Oncotarget, 2016, 7: 19863-19883. |
 2019, Vol. 40
2019, Vol. 40


