缺血和缺氧是神经损害并导致神经功能障碍的重要原因,其本质是细胞因氧糖缺乏发生的能量枯竭及一系列瀑布样损伤效应。急性的缺血、缺氧多发生于缺血性脑卒中,而缺血半暗带是处于缺血、缺氧状态下尚具有挽救希望的组织区域,若不能在时间窗内及时恢复有效血流灌注往往会发展为不可逆性神经坏死[1]。而慢性缺血、缺氧,如脑动脉慢性狭窄和闭塞等导致的持续脑低灌注使脑组织长时间处于缺血、缺氧状态,可引起神经损伤和凋亡并逐渐破坏神经网络的结构和功能完整性[2]。p75神经营养素受体(p75 neurotrophin receptor,p75NTR)被认为对神经元的存活、分化等有重要作用,并可能参与了众多神经系统疾病的发生和发展[3],但关于在缺血、缺氧情况下p75NTR在神经元中的表达变化及其作用尚不清楚。因此,本实验基于培养的人神经母细胞瘤细胞SH-SY5Y在体外构建氧糖剥夺(oxygen-glucose deprivation, OGD)模型,模拟体内缺氧、缺血环境,并研究在缺氧、缺血条件下p75NTR表达的变化及其在细胞损伤中的作用。
1 材料和方法 1.1 材料与仪器SH-SY5Y细胞株购自中国科学院上海细胞库。DMEM培养液购于美国HyClone公司;四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)检测试剂盒、乳酸脱氢酶(lactate dehydrogenase,LDH)活力检测试剂盒、Annexin Ⅴ/碘化丙啶凋亡检测试剂盒均购自上海碧云天公司;兔抗p75NTR单克隆抗体购自英国Abcam公司,β-肌动蛋白(β-actin)抗体及LM11A-31(小分子非肽类p75NTR竞争性配体)购自美国Sigma公司。三气培养箱购自美国Thermo Scientific公司,酶标仪购自美国BioTek公司,Cytomics FC 500型流式细胞仪购自美国Beckman公司。
1.2 SH-SY5Y细胞OGD模型建立与分组参照相关文献[4-5],采用三气培养箱进行细胞培养。选择生长状态良好的SH-SY5Y细胞,用经多聚赖氨酸包被的可拆卸式96孔板,以每孔5×103细胞加入100 μL无血清、无糖或含葡萄糖1 000 mg/L的DMEM培养液进行培养。OGD细胞模型建立方法:细胞用无血清、无糖DMEM培养液,置于三气培养箱(1% O2、5% CO2、94% N2,37 ℃)中培养,分别在培养0、3、6、12、24 h时采用MTT法检测细胞存活率,并测定培养液中LDH释放活力,以判断OGD模型是否建立成功并确定最佳干预时间。SH-SY5Y细胞OGD模型建立成功后进行分组干预,设立对照组、OGD组和OGD + LM11A-31组。对照组细胞用无血清、含葡萄糖1 000 mg/L的DMEM培养液,置于5% CO2、37 ℃常规培养箱中培养。OGD + LM11A-31组LM11A-31干预浓度为100 nmol/L。每组设6个平行复孔,实验重复3次。
1.3 MTT法检测细胞存活率与LDH释放活力测定参考试剂盒说明书进行操作。MTT检测方法:将噻唑蓝5 mg/mL加入培养液中继续孵育4 h,换甲臜结晶溶解液,用酶标仪测定570 nm波长处光密度(D570)值。细胞存活率(%) = (实时D570/0 h D570)×100%,定义0 h相应对照细胞存活率为100%。LDH释放活力测定方法:在细胞上清液中加入LDH检测工作液,室温下避光孵育30 min,用酶标仪测定490 nm波长处光密度(D490)值。LDH释放活力值= (样品D490 -空白对照孔D490)/(标准品D490 -空白对照孔D490)×标准品LDH活力值。
1.4 流式细胞术检测细胞凋亡根据说明书,将5×105/孔的细胞培养板在200×g离心5 min,移除大部分上清液(悬浮有大量细胞碎片)后,加入结合缓冲液200 μL、浓度为20 μg/mL异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的Annexin Ⅴ 10 μL和浓度为50 μg/mL的碘化丙啶5 μL,室温下避光孵育30 min,0.25%胰酶消化后重悬细胞,移至样品管并检测。
1.5 蛋白质印迹法检测蛋白表达收集培养板内细胞,裂解、离心并取上清,BCA法测定蛋白含量。蛋白质印迹法主要步骤:加样后电泳、转膜,5%脱脂奶粉溶液常温下封闭1 h,4 ℃过夜孵育兔抗p75NTR单克隆抗体(稀释比例1 : 2 000)、β-actin(1 : 1 000)一抗,次日洗膜后加入二抗常温孵育1 h,ECL法显影。采用ImageJ软件测定灰度值。
1.6 统计学处理采用SPSS 18.0软件进行统计学分析。呈正态分布的计量资料以x±s表示,多组间比较采用单因素方差分析,事后两两比较采用Bonferroni法(校正后的P′ = P值×检验次数)。检验水准(α)为0.05。
2 结果 2.1 SH-SY5Y细胞OGD模型的建立OGD组细胞存活率随OGD干预时间延长逐渐降低[3、6、12、24 h细胞存活率分别为(95.82±2.72)%、(82.70±2.10)%、(55.70±4.02)%、(27.07±6.09)%],而LDH释放活力随OGD干预时间延长逐渐升高[0、3、6、12、24 h时分别为(47.98±4.58)、(77.07±6.89)、(162.70±20.11)、(342.97±31.90)、(454.85±38.97)U/L],差异均有统计学意义(F = 171.5、153.9,P均<0.05);多重比较显示OGD组任意两个时间点之间细胞存活率和LDH释放活力差异均有统计学意义(Bonferroni法,P′均<0.05)。对照组在细胞存活率和LDH释放活性方面均未显示随时间而变化的趋势。见图 1。结果提示在OGD干预后细胞存活率和损伤程度都随时间延长而显著增加,说明OGD模型成功建立。

|
图 1 OGD条件下人神经母细胞瘤细胞系SH-SY5Y细胞存活率和LDH释放活力变化 Fig 1 Viability and LDH activity of human neuroblastoma cell line SH-SY5Y cells under OGD condition OGD: Oxygen-glucose deprivation; LDH: Lactate dehydrogenase. Bonferroni test. *P′ < 0.05 vs any other time point in OGD group. n = 3, x±s |
2.2 3组细胞存活率和LDH释放活力的比较
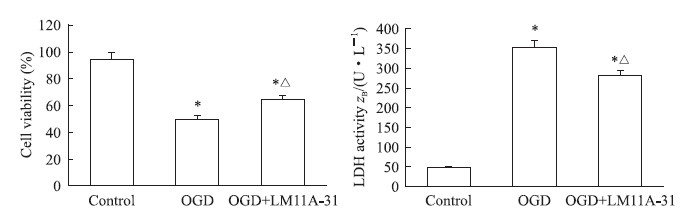
细胞培养12 h时,对照组、OGD组和OGD + LM11A-31组细胞存活率分别为(94.80±4.06)%、(50.34±5.55)%和(64.68±4.59)%,3组间差异有统计学意义(F = 67.94,P<0.05);多重比较显示OGD组细胞存活率低于对照组(Bonferroni法,P′<0.05),而LM11A-31处理细胞后OGD + LM11A-31组高于OGD组(Bonferroni法,P′<0.05)。细胞培养12 h时,对照组、OGD组和OGD + LM11A-31组LDH释放活力分别为(46.93±5.49)、(353.09±30.67)和(282.20±25.60)U/L,3组间差异有统计学意义(F = 142.10,P<0.05);多重比较显示OGD组LDH释放活力高于对照组(Bonferroni法,P′<0.05),而LM11A-31处理细胞后OGD + LM11A-31组低于OGD组(Bonferroni法,P′<0.05)。以上结果进一步验证了OGD模型的可靠性。见图 2。
|
图 2 各组人神经母细胞瘤细胞系SH-SY5Y细胞存活率和LDH释放活力 Fig 2 Viability and LDH activity of human neuroblastoma cell line SH-SY5Y cells in each group OGD: Oxygen-glucose deprivation; LDH: Lactate dehydrogenase. LM11A-31: A non-peptide competitive p75NTR ligand. Bonferroni test. *P' < 0.05 vs control group; △P' < 0.05 vs OGD group. n = 3, x±s |
2.3 3组细胞凋亡检测结果比较
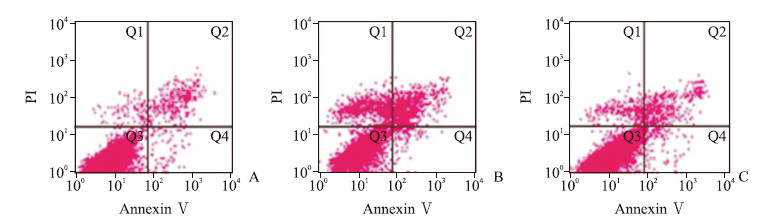
流式细胞术检测结果显示,对照组、OGD组和OGD + LM11A-31组凋亡细胞比例(Q2 + Q4)分别为(1.82±0.45)%、(14.98±2.59)%和(7.36±1.98)%,3组间差异有统计学意义(F = 36.28,P<0.05);多重比较显示OGD组凋亡细胞比例高于对照组(Bonferroni法,P′<0.05),而LM11A-31处理细胞后OGD + LM11A-31组低于OGD组(Bonferroni法,P′<0.05)。见图 3。
|
图 3 流式细胞术检测各组人神经母细胞瘤细胞系SH-SY5Y细胞的凋亡情况 Fig 3 Apoptosis of human neuroblastoma cell line SH-SY5Y cells in each group detected by flow cytometry A: Control group; B: OGD group; C: OGD+LM11A-31 group. PI: Propidium iodide; OGD: Oxygen-glucose deprivation. LM11A-31: A non-peptide competitive p75NTR ligand |
2.4 3组细胞中p75NTR蛋白表达水平比较
蛋白质印迹法检测结果显示,对照组、OGD组和OGD + LM11A-31组p75NTR相对表达量(p75NTR灰度值/β-actin灰度值)分别为0.06±0.01、0.41±0.02和0.19±0.03,3组间差异有统计学意义(F = 221.20,P<0.05);多重比较显示OGD组p75NTR相对表达量高于对照组(Bonferroni法,P′<0.05),而LM11A-31处理细胞后OGD + LM11A-31组p75NTR相对表达量也高于对照组(Bonferroni法,P′<0.05),但低于OGD组(Bonferroni法,P′<0.05)。见图 4。

|
图 4 蛋白质印迹法检测各组人神经母细胞瘤细胞系SH-SY5Y细胞中p75NTR蛋白表达 Fig 4 Protein expression of p75NTR of human neuroblastoma cell line SH-SY5Y cells in each group detected by Western blotting p75NTR: p75 neurotrophin receptor; OGD: Oxygen-glucose deprivation. LM11A-31: A non-peptide competitive p75NTR ligand. Bonferroni test. *P' < 0.05 vs control group; △P' < 0.05 vs OGD group. n = 3, x±s |
3 讨论
缺血、缺氧与多种神经系统疾病有关。缺血缺氧性损害常发生于急慢性脑血管病,特别是慢性脑动脉狭窄导致的低灌注或局部脑缺血往往会由于持续缺血、缺氧状态而引发症状性神经损害。这种慢性缺血、缺氧还见于存在低灌注状态的晚期阿尔茨海默病和帕金森病等神经退行性疾病,并被认为与神经元减少、皮质萎缩及认知损害相关[6-7]。因此,若能够在早期降低或延缓慢性缺血缺氧性神经损害将有助于神经系统疾病的治疗。
OGD是目前常用的体外模拟机体缺血和缺氧的方法,主要通过低糖或无糖培养和缺氧环境实现。缺氧环境可采用化学或物理方法实现,如Padmanabha等[8]采用氯化钴(CoCl2)的化学方法建立0.5%~2.0%氧浓度的缺氧环境;而更多学者推荐通过密闭装置实现物理缺氧,以更贴近实际地模拟体内缺氧,且便于控制缺氧程度和减少化学物质对培养液性质的干扰[9-10]。本实验采用三气培养箱建立缺氧环境,配合无血清(为避免影响LDH活力检测准确性)和无糖的培养液实现OGD模型的建立。SH-SY5Y细胞是人骨转移灶的神经母细胞瘤细胞系SK-N-SH经3次克隆后的亚细胞系,在形态、神经化学和电生理学方面均具有与神经元相似的特性[11]。该细胞处于不同生长状态、不同培养环境时,对于不同损伤因素的反应有较大差异。一项对采用SH-SY5Y细胞和不同方法造成细胞损伤模型相关研究的meta分析显示,过氧化氢、缺氧、葡萄糖剥夺和谷氨酸兴奋性毒性能对细胞造成29%~58%的损伤效应,不同的实验环境和相关参数也可能产生不同的效应,甚至导致模型建立失败[12]。在本实验中,随着OGD干预时间延长,SH-SY5Y细胞存活率逐渐下降,培养液中LDH释放活力逐渐增高,说明细胞损伤、死亡与OGD之间存在时间-效应关系,也由此确认了OGD模型的成功建立,后续的分组实验结果再次验证了OGD干预后细胞损伤。
缺血、缺氧对细胞造成损伤的机制主要与线粒体功能障碍、氧自由基损伤、兴奋性氨基酸毒性和炎症反应等一系列能够启动凋亡的关键因素有关[13]。有学者利用基因芯片对局灶性脑缺血模型大鼠皮质基因表达谱进行分析,结果显示在责任血管闭塞仅6 h后1 174个目标基因中有71个基因表达出现显著变化,其中代谢相关基因、细胞通讯相关基因和信号转导相关基因表达下调,而应激反应相关基因表达增加[14],这提示缺血、缺氧引发基因水平的改变,从而参与应激或炎症过程而加重自身细胞的损伤,那么是否可以在这段时间内通过特定靶点的干预而延迟或改善损伤效应呢?p75NTR属于肿瘤坏死因子受体超家族成员,能够通过多条信号通路(如c-Jun氨基末端激酶/p53/B淋巴细胞瘤-2基因关联X蛋白通路、核因子κB通路和神经酰胺通路等)引起炎症等损伤效应,并可能参与了多种神经系统疾病的发生[3, 15]。基于大鼠脑缺血模型的研究发现脑缺血后脑组织中p75NTR的表达上调,且这种上调与损伤程度有关[16],通过对大鼠缺血性视网膜损伤的研究也发现了这种与损伤有关的p75NTR上调现象[17]。但是,对于缺血、缺氧条件下p75NTR的表达变化及其对神经损伤影响的特点仍需进一步阐明。本实验结果显示,经过OGD干预后,神经细胞中p75NTR表达增加,提示其与OGD后细胞凋亡增多和存活率下降有关,而给予竞争性配体LM11A-31阻断后细胞损伤有所改善,且p75NTR表达有所降低,提示降低p75NTR的介导效应可能通过减少细胞损伤反馈性降低自身表达,反过来进一步减轻对细胞损伤的介导效应,这也是我们希望能够干预的环节。因此,我们设想,在缺血性脑卒中和慢性脑低灌注导致的神经损伤中脑内p75NTR的表达也可能增高,并通过某些信号通路介导神经细胞的损伤和凋亡,说明以p75NTR作为靶点延缓或改善这种损伤可能是一种有效的治疗策略,能为这类患者延缓疾病进展或争取更多的治疗窗口和时机。
综上所述,本实验结果初步证明了在OGD条件下神经细胞中p75NTR的表达变化,及其对细胞损伤、凋亡的作用,但可能仍需要进一步揭示这种变化和作用发生的潜在机制。
| [1] |
BARON J C. Protecting the ischaemic penumbra as an adjunct to thrombectomy for acute stroke[J]. Nat Rev Neurol, 2018, 14: 325-337. DOI:10.1038/s41582-018-0002-2 |
| [2] |
KAZUMATA K, THA K K, NARITA H, KUSUMI I, SHICHINOHE H, ITO M, et al. Chronic ischemia alters brain microstructural integrity and cognitive performance in adult moyamoya disease[J]. Stroke, 2015, 46: 354-360. DOI:10.1161/STROKEAHA.114.007407 |
| [3] |
ELSHAER S L, EL-REMESSY A B. Implication of the neurotrophin receptor p75NTR in vascular diseases:beyond the eye[J]. Expert Rev Ophthalmol, 2017, 12: 149-158. DOI:10.1080/17469899.2017.1269602 |
| [4] |
KAUSHAL V, SCHLICHTER L C. Mechanisms of microglia-mediated neurotoxicity in a new model of the stroke penumbra[J]. J Neurosci, 2008, 28: 2221-2230. DOI:10.1523/JNEUROSCI.5643-07.2008 |
| [5] |
HE C, STROINK A R, WANG C X. The role of DAPK-BimEL pathway in neuronal death induced by oxygen-glucose deprivation[J]. Neuroscience, 2014, 258: 254-262. DOI:10.1016/j.neuroscience.2013.11.024 |
| [6] |
THOMAS T, MINERS S, LOVE S. Post-mortem assessment of hypoperfusion of cerebral cortex in Alzheimer's disease and vascular dementia[J]. Brain, 2015, 138: 1059-1069. DOI:10.1093/brain/awv025 |
| [7] |
LIN W C, CHEN P C, HUANG C C, TSAI N W, CHEN H L, WANG H C, et al. Autonomic function impairment and brain perfusion deficit in Parkinson's disease[J/OL]. Front Neurol, 2017, 8: 246. doi: 10.3389/fneur.2017.00246.
|
| [8] |
PADMANABHA D, PADILLA P A, YOU Y J, BAKER K D. A HIF-independent mediator of transcriptional responses to oxygen deprivation in Caenorhabditis elegans[J]. Genetics, 2015, 199: 739-748. DOI:10.1534/genetics.114.173989 |
| [9] |
TASCA C I, DAL-CIM T, CIMAROSTI H. In vitro oxygen-glucose deprivation to study ischemic cell death[J]. Methods Mol Biol, 2015, 1254: 197-210. |
| [10] |
CHAO W H, LAI M Y, PAN H T, SHIU H W, CHEN M M, CHAO H M. Dendrobium nobile Lindley and its bibenzyl component moscatilin are able to protect retinal cells from ischemia/hypoxia by dowregulating placental growth factor and upregulating Norrie disease protein[J/OL]. BMC Complement Altern Med, 2018, 18: 193. doi: 10.1186/s12906-018-2256-z.
|
| [11] |
SHIPLEY M M, MANGOLD C A, SZPARA M L. Differentiation of the SH-SY5Y human neuroblastoma cell line[J/OL]. J Vis Exp, 2016(108): 53193. doi: 10.3791/53193.
|
| [12] |
LIU Y, EATON E D, WILLS T E, MCCANN S K, ANTONIC A, HOWELLS D W. Human ischaemic cascade studies using SH-SY5Y cells:a systematic review and meta-analysis[J]. Transl Stroke Res, 2018, 9: 564-574. DOI:10.1007/s12975-018-0620-4 |
| [13] |
RADAK D, KATSIKI N, RESANOVIC I, JOVANOVIC A, SUDAR-MILOVANOVIC E, ZAFIROVIC S, et al. Apoptosis and acute brain ischemia in ischemic stroke[J]. Curr Vasc Pharmacol, 2017, 15: 115-122. DOI:10.2174/1570161115666161104095522 |
| [14] |
KIM Y D, SOHN N W, KANG C, SOH Y. DNA array reveals altered gene expression in response to focal cerebral ischemia[J]. Brain Res Bull, 2002, 58: 491-498. DOI:10.1016/S0361-9230(02)00823-7 |
| [15] |
SHU Y H, LU X M, WEI J X, XIAO L, WANG Y T. Update on the role of p75NTR in neurological disorders:a novel therapeutic target[J]. Biomed Pharmacother, 2015, 76: 17-23. DOI:10.1016/j.biopha.2015.10.010 |
| [16] |
IRMADY K, JACKMAN K A, PADOW V A, SHAHANI N, MARTIN L A, CERCHIETTI L, et al. MiR-592 regulates the induction and cell death-promoting activity of p75NTR in neuronal ischemic injury[J]. J Neurosci, 2014, 34: 3419-3428. DOI:10.1523/JNEUROSCI.1982-13.2014 |
| [17] |
WEI Y, WANG N, LU Q, ZHANG N, ZHENG D, LI J. Enhanced protein expressions of sortilin and p75NTR in retina of rat following elevated intraocular pressure-induced retinal ischemia[J]. Neurosci Lett, 2007, 429(2/3): 169-174. |
 2019, Vol. 40
2019, Vol. 40


