2. 海军军医大学(第二军医大学)东方肝胆外科医院麻醉科, 上海 200438;
3. 中国人民解放军联勤保障部队 988 医院肝胆外科, 郑州 450042;
4. 中国人民解放军联勤保障部队988医院泌尿外科, 郑州 450042
2. Department of Anesthesiology, Eastern Hepatobiliary Surgery Hospital, Naval Medical University (Second Military Medical University), Shanghai 200438, China;
3. Department of Hepatobiliary Surgery, No. 988 Hospital of Logistic Support Forces of PLA, Zhengzhou 450042, Henan, China;
4. Department of Urology, No. 988 Hospital of Logistic Support Forces of PLA, Zhengzhou 450042, Henan, China
肾缺血/再灌注(ischemia/reperfusion)损伤是多种原因导致的肾急性缺血后血流再灌注引起的肾小管细胞非正常死亡,常见于腹部外伤、失血性休克、严重感染、肾移植等,是急性肾功能衰竭的常见诱因[1]。磷脂酰肌醇3 -激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)/内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)信号通路广泛参与了细胞能量代谢、氧化应激、细胞增殖等过程,在肝、脑、肺缺血/再灌注损伤中发挥重要作用,是介导缺血/再灌注损伤重要的细胞内途径之一[2]。同时PI3K能够促进磷酸化Akt(p-Akt)、磷酸化eNOS(p-eNOS)表达,因此p-Akt/Akt、p-eNOS/eNOS比值可反映PI3K/Akt/eNOS信号通路的活化程度[3]。瑞芬太尼(remifentanil)作为一种短效阿片类药物,能够通过抑制炎症反应、脂质过氧化及细胞凋亡等对心、肝、肾缺血/再灌注损伤发挥保护作用[4]。本研究考察了瑞芬太尼能否通过PI3K/Akt/eNOS信号通路对肾脏组织的炎症反应及细胞凋亡产生影响,从而减轻肾缺血/再灌注损伤。
1 材料和方法 1.1 实验动物、分组及试剂健康雄性C57/BL小鼠(体质量20~30 g)50只,购自海军军医大学(第二军医大学)实验动物中心[动物生产许可证号:SCXK(沪)2018-0006]。小鼠在12 h/12 h光照条件空调室内饲养,室温22~25 ℃,湿度40%~60%,自由进水和食物。将小鼠随机分为5组:假手术组、缺血/再灌注损伤组(I/R组)、缺血/再灌注损伤+ PI3K抑制剂LY294002处理组(I/R + LY294002组)、缺血/再灌注损伤+瑞芬太尼处理组(I/R + RF组)、缺血/再灌注损伤+ LY294002处理+瑞芬太尼处理组(I/R + RF + LY294002组),每组10只。
盐酸瑞芬太尼溶液(美国Sigma公司)用生理盐水稀释后,术中以1 μg/(kg·min)尾静脉泵注30 min;LY294002(美国Sigma公司)溶于二甲基亚砜(dimethyl sulfoxide,DMSO)后,术前1 h以0.2 mg/kg腹腔注射。实验中所用一抗包括兔抗PI3K单克隆抗体(英国Abcam公司,稀释比例1 : 1 000)、兔抗p-Akt多克隆抗体(英国Abcam公司,1 : 5 000)、兔抗Akt单克隆抗体(英国Abcam公司,1 : 1 000)、兔抗p-eNOS多克隆抗体(英国Abcam公司,1 : 5 000)、小鼠抗eNOS单克隆抗体(英国Abcam公司,1 : 1 000)、小鼠抗甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH;美国CST公司,1 : 5 000),二抗包括抗兔二抗(美国CST公司,稀释比例1 : 5 000)、抗小鼠二抗(美国CST公司,1 : 5 000)。小鼠肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素(interleukin,IL)-1β、IL-6、IL-10酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒均购自英国Abcam公司。
1.2 肾缺血/再灌注损伤模型的建立腹腔注射戊巴比妥钠(50 mg/kg)麻醉小鼠后,手术暴露双侧肾脏,分离两侧肾动脉、肾静脉,用无创动脉夹阻断双侧肾动脉60 min并观察肾脏颜色变化,随后松开动脉夹恢复血流。假手术组小鼠仅暴露双侧肾脏、分离肾动脉和肾静脉,不夹闭肾动脉。分层缝合切口,肌内注射青霉素预防切口感染。各组分别于手术结束6 h后取静脉血或肾脏组织进行相关检测。
1.3 肾功能测定各组小鼠取静脉血,使用Cobas Integra 800全自动生化分析仪(瑞士Roche公司)检测血尿素氮(blood urea nitrogen,BUN)、血肌酐(serum creatinine,SCr)水平。
1.4 蛋白质印迹法检测各组小鼠处死后取适量肾脏组织,加入RIPA裂解液超声匀浆后放入旋转摇床4 ℃下裂解1 h,于低温3 000×g离心20 min,取上清。采用BCA法测定蛋白质浓度,取30 μg蛋白样品高温变性,上样后60 V 30 min、90 V 120 min电泳,300 mA 100 min转膜。室温封闭2 h,加一抗,于4 ℃孵育过夜。次日洗膜后,加入二抗室温孵育2 h,洗膜后用Image Quant LAS4000数码成像仪(美国GE公司)观察、拍照。采用Photoshop软件测量蛋白质条带的灰度值,目的蛋白的相对含量=目的蛋白灰度值/GAPDH灰度值。
1.5 H-E染色取肾脏组织,用二甲苯固定30 min,100%、95%、85%、75%乙醇溶液分别脱水5 min。蒸馏水冲洗后加入苏木精染液染色10 min,放入1%盐酸溶液5 s后用蒸馏水冲洗。滴加伊红染液复染5 min,然后用上述不同浓度的乙醇溶液分别继续脱水2 min;加入二甲苯进行透明处理,滴加中性树脂进行封片,在光学显微镜下观察。
1.6 炎性因子测定取部分肾脏组织,用玻璃匀浆器匀浆,4 ℃ 3 000×g离心10 min,取上清液。分别按照TNF-α、IL-1β、IL-6、IL-10 ELISA试剂盒说明书配制相应标准品,分别将样本和各标准品加入相应孔中,每孔100 μL。标准品设2个复孔,样本设3个复孔,用封板胶纸严密封住反应孔,37 ℃孵育90 min后加入350 μL洗涤液,洗板3次。每孔中加入生物素化抗体工作液(每孔100 μL),37 ℃孵育60 min,洗板。每孔中加入酶结合物工作液(每孔100 μL),37 ℃孵育30 min,洗板。加入显色剂(每孔100 μL),37 ℃避光孵育20 min,加入终止液(每孔100 μL),混匀后即刻使用酶标仪测定450 nm波长处光密度值,根据各标准品得出的浓度曲线计算样本相应炎性因子浓度,取3个复孔平均值为最终浓度。
1.7 实时定量PCR检测取肾脏组织加入1 mL TRIzol试剂充分匀浆,转移至1.5 mL无RNA酶EP管中,室温静置10 min后加入0.2 mL氯仿,4 ℃ 3 000×g离心15 min,取上清液;加入等体积异丙醇,混匀后3 000×g离心10 min,弃上清;加入1 mL 75%乙醇溶液洗涤,3 000×g离心5 min,弃上清;加入无RNA酶水充分溶解;用分光光度计测量RNA浓度和纯度。反转录获得cDNA,反应条件:37 ℃ 15 min、85 ℃ 15 s、4 ℃ 10 min循环1次。以cDNA为模板,使用PCR仪进行扩增,反应条件:95 ℃ 15 min,95 ℃ 15 s、60 ℃ 15 s、72 ℃ 40 s循环40次。引物序列:Bcl2正义引物5′-GAT TGT GGC CTT CTT TGA GTT-3′,反义引物5′-AGT TCC ACA AAG GCA TCC CA-3′;半胱氨酸蛋白酶(Caspase)-3正义引物5′-AGT TGG ACC CAC CTT GTG AG-3′,反义引物5′-AGT CTG CAG CTC CTC CAC AT-3′;GAPDH正义引物5′-CCA CTC CTC CAC CTT TGA CG-3′,反义引物5′-TAG CCA AAT TCG TTG TCA TAC CAG G-3′。计算每个样本的ΔCt值,并比较相对表达量。
1.8 统计学处理使用SPSS 21.0软件进行统计学分析。数据以x±s表示,多组间比较采用单因素方差分析,然后进行Tukey检验。检验水准(α)为0.05。
2 结果 2.1 肾功能改变I/R组小鼠静脉血BUN、SCr水平升高,与假手术组相比差异均有统计学意义(P均<0.05),说明缺血/再灌注可导致小鼠肾功能损伤。I/R + RF组小鼠静脉血BUN、SCr水平均较I/R组降低,差异均有统计学意义(P均<0.05),而I/R + RF + LY294002组BUN、SCr与I/R + RF组相比有所回升,差异均有统计学意义(P均<0.05),提示术中应用瑞芬太尼在小鼠肾缺血/再灌注损伤中具有肾脏保护作用,而抑制PI3K能够减弱瑞芬太尼的保护作用。见图 1。
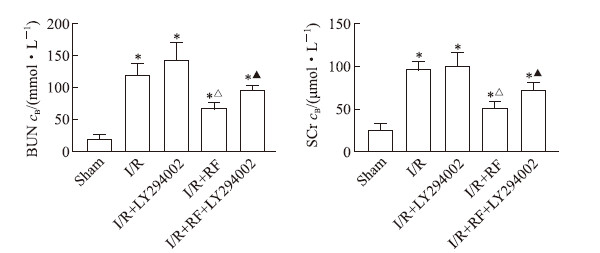
|
图 1 各组小鼠肾功能 Fig 1 Renal function of mice in each group LY294002 is a PI3K inhibitor. I/R: Ischemia/reperfusion; RF: Remifentanil; BUN: Blood urea nitrogen; SCr: Serum creatinine; PI3K: Phosphatidylinositol 3-kinase. *P < 0.05 vs sham group; △P < 0.05 vs I/R group; ▲P < 0.05 vs I/R + RF group. n = 10, x±s |
2.2 瑞芬太尼对PI3K/Akt/eNOS通路相关蛋白表达的影响
I/R组、I/R + LY294002组小鼠肾脏组织中PI3K的表达及p-Akt/Akt、p-eNOS/eNOS均较假手术组降低(P均<0.05),提示缺血/再灌注损伤可降低肾脏组织中PI3K、Akt、eNOS蛋白的表达。而I/R + RF组小鼠肾脏组织中PI3K的表达及p-Akt/Akt、p-eNOS/eNOS均较I/R组升高(P<0.05);经PI3K抑制剂LY294002处理后,I/R + RF + LY294002组小鼠p-eNOS/eNOS下降,与I/R + RF组相比差异有统计学意义(P<0.05)。提示瑞芬太尼能够增加PI3K、Akt、eNOS蛋白的表达。见图 2。
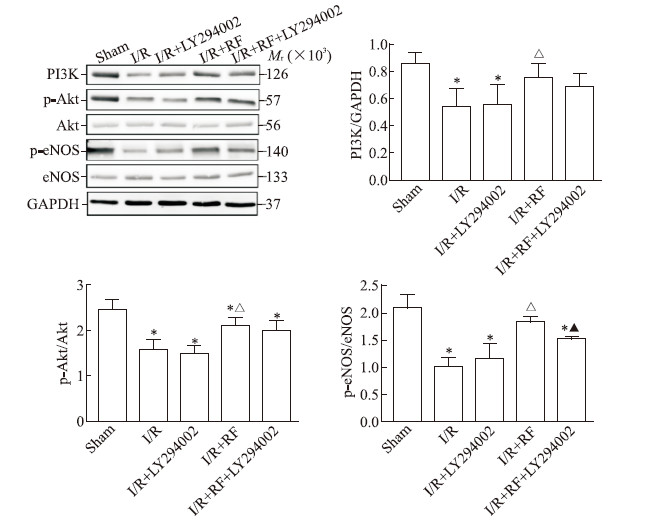
|
图 2 蛋白质印迹法分析小鼠肾脏组织中PI3K/Akt/eNOS通路相关蛋白的表达 Fig 2 PI3K/Akt/eNOS pathway-related protein expression in renal tissues of mice detected by Western blotting LY294002 is a PI3K inhibitor. PI3K: Phosphatidylinositol 3-kinase; p-Akt: Phosphorylated-protein kinase B; Akt: Protein kinase B; p-eNOS: Phosphorylated-endothelial nitric oxide synthase; eNOS: Endothelial nitric oxide synthase; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase; I/R: Ischemia/reperfusion; RF: Remifentanil. *P < 0.05 vs sham group; △P < 0.05 vs I/R group; ▲P < 0.05 vs I/R + RF group. n = 10, x±s |
2.3 瑞芬太尼通过PI3K/Akt/eNOS通路减轻肾炎症细胞及炎性因子的释放
如图 3所示,缺血/再灌注损伤小鼠肾脏组织炎症细胞募集多于假手术组,而应用瑞芬太尼后炎症细胞浸润减轻。如图 4所示,I/R组、I/R + LY294002组小鼠肾脏组织炎性因子TNF-α、IL-1β、IL-6、IL-10释放均多于假手术组(P均<0.05);应用瑞芬太尼后I/R + RF组小鼠肾脏组织中上述炎性因子的释放均减少,与I/R组相比差异均有统计学意义(P均<0.05),而LY294002处理后即I/R + RF + LY294002组瑞芬太尼减少IL-1β、IL-6释放的效应减弱,与I/R + RF组相比差异均有统计学意义(P均<0.05),提示瑞芬太尼通过增强PI3K/Akt/eNOS通路减轻肾缺血/再灌注损伤后的炎症反应。
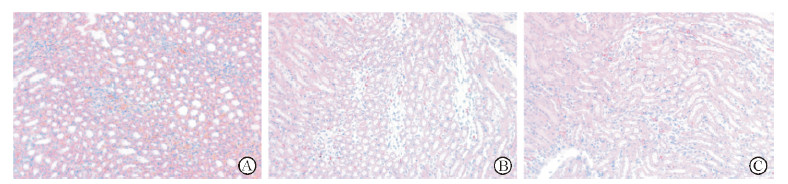
|
图 3 小鼠肾脏组织的H-E染色 Fig 3 H-E staining of renal tissues of mice A: Sham group; B: I/R group; C: I/R+RF group. I/R: Ischemia/reperfusion; RF: Remifentanil. Original magnification: ×400 |
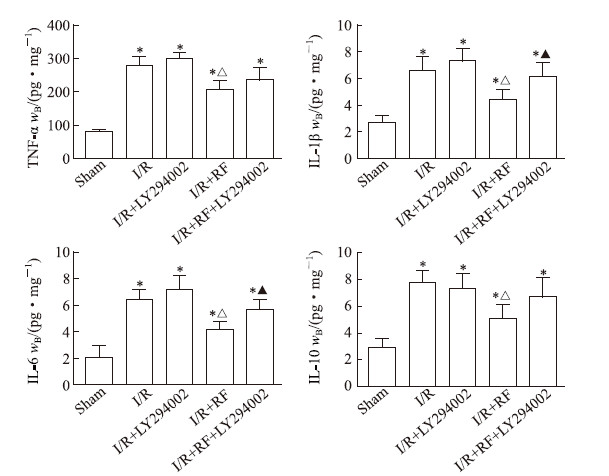
|
图 4 酶联免疫吸附试验检测小鼠肾脏组织中炎性因子的表达 Fig 4 Inflammatory factor expression in renal tissues of mice detected by enzyme-linked immunosorbent assay LY294002 is a PI3K inhibitor. I/R: Ischemia/reperfusion; RF: Remifentanil; PI3K: Phosphatidylinositol 3-kinase; TNF-α: Tumor necrosis factor α; IL: Interleukin. *P < 0.05 vs sham group; △P < 0.05 vs I/R group; ▲P < 0.05 vs I/R + RF group. n = 10, x±s |
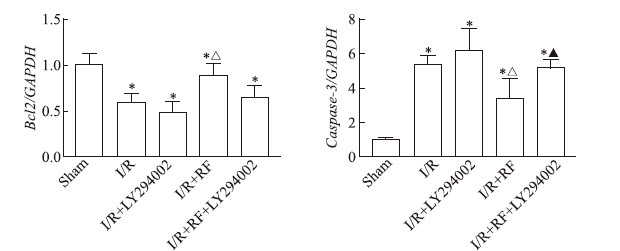
2.4 瑞芬太尼通过PI3K/Akt/eNOS通路减轻肾脏细胞凋亡
实时定量PCR结果显示,I/R组、I/R + LY294002组小鼠肾脏组织中抗凋亡因子Bcl2 mRNA的表达降低,而凋亡因子Caspase-3 mRNA表达增加,与假手术组相比差异均有统计学意义(P均<0.05)。瑞芬太尼处理后,I/R + RF组小鼠肾脏组织中Bcl2 mRNA表达较I/R组升高,Caspase-3 mRNA表达降低,差异均有统计学意义(P均<0.05)。给予PI3K抑制剂LY294002处理后,I/R + RF + LY294002组小鼠肾脏组织中Bcl2 mRNA的表达有所降低,但与I/R + RF组相比差异无统计学意义(P>0.05),而Caspase-3 mRNA表达升高且与I/R + RF组相比差异有统计学意义(P<0.05),提示瑞芬太尼通过增强PI3K/Akt/eNOS通路减轻肾脏缺血/再灌注损伤后的细胞凋亡。见图 5。
|
图 5 实时定量PCR分析小鼠肾脏组织中抗凋亡因子Bcl2和凋亡因子Caspase-3的mRNA表达 Fig 5 mRNA expression of anti-apoptotic factor Bcl2 and apoptotic factor Caspase-3 in renal tissues of mice detected by real-time quantitative PCR LY294002 is a PI3K inhibitor. I/R: Ischemia/reperfusion; RF: Remifentanil; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase; PI3K: Phosphatidylinositol 3-kinase. *P < 0.05 vs sham group; △P < 0.05 vs I/R group; ▲P < 0.05 vs I/R + RF group. n = 10, x±s |
3 讨论
随着肾移植、肾部分切除等手术日益增多,肾缺血/再灌注损伤在临床诊疗过程中难以避免。血流再灌注是导致肾损伤的主要因素,可引起急性肾小管坏死,甚至诱发肾功能衰竭,影响术后肾功能恢复,严重时可危及患者生命[5]。PI3K/Akt/eNOS通路属于酪蛋白激酶受体型信号转导通路,通过影响细胞内多种第二信使参与细胞增殖、血管新生等活动,并参与缺血/再灌注损伤过程中的多个重要环节[6]。本研究结果显示,瑞芬太尼通过增强Akt、eNOS磷酸化,减少肾脏组织中炎症细胞的募集和炎性因子的释放,以及上调抗凋亡因子Bcl2、减少凋亡因子Caspase-3的表达保护肾脏功能;然而,该作用可被PI3K抑制剂LY294002减弱。上述结果证明瑞芬太尼通过激活PI3K/Akt/eNOS信号通路减轻肾脏炎症反应和细胞凋亡而发挥肾脏保护作用。
eNOS广泛存在于内皮细胞中,是调控内皮源性一氧化氮产生的关键酶,而一氧化氮在促进细胞增殖、黏附、迁移和血管新生过程中发挥重要作用[7]。PI3K/Akt/eNOS通路能够通过调节凋亡相关蛋白的表达,调节细胞凋亡进程[8]。Akt激活后能够介导下游多条信号通路的激活,从而抑制线粒体通透性转运孔的开放,维持细胞膜的稳定性,减缓细胞凋亡。eNOS激活有助于改善血管功能和内皮细胞功能,促进血管新生。而LY294002作为PI3K抑制剂,通过抑制Akt苏氨酸和丝氨酸位点磷酸化,阻断PI3K/Akt通路的激活,从而导致eNOS活性降低,使其介导的细胞增殖、凋亡、炎症反应及免疫反应等功能受到影响[9]。
细胞凋亡是缺血/再灌注损伤过程中肾损伤的一个重要机制,炎性介质或氧自由基等通过激活Caspase-8或Caspase-9促进肾小管上皮细胞凋亡,两者又可激活Caspase-3引起DNA链断裂和基因突变,从而促进细胞凋亡。此外,促凋亡基因Bcl2关联X蛋白、Bcl2相关死亡促进因子、Bcl2同源拮抗蛋白等表达增加及抗凋亡基因Bcl2、Bcl-x等表达减少也可促进细胞凋亡[10]。在缺血状态下,肾小管上皮细胞内ATP过度消耗使线粒体Na+/K+离子通道受到抑制,线粒体内膜通透性增加,导致Ca2+内流增加及线粒体肿胀;同时缺氧能够损伤电子传递链中复合物的功能,易发生电子泄露和爆发性氧自由基堆积,影响细胞正常能量代谢,导致细胞释放凋亡因子、细胞色素C和凋亡诱导因子等,启动细胞凋亡[11]。
肾脏组织中的炎症反应、过度免疫应答是肾缺血/再灌注损伤的又一重要机制。再灌注过程中大量炎性因子释放入血、血管内皮细胞和白细胞表面黏附分子表达升高、白细胞过度激活等加剧了肾小管上皮细胞损伤。在炎症反应的过程中,巨噬细胞既发挥效应细胞的功能,又发挥抗原呈递细胞的作用。巨噬细胞活化后,吞噬病原体并释放多种重要炎性因子,如IL-1、IL-6、IL-10、IL-1β、TNF-α等[12]。正常情况下肾组织内巨噬细胞数量较少,但缺血后大量巨噬细胞随血流灌注进入肾组织并分泌细胞因子激活白细胞,诱发级联炎症反应[13]。
本研究结果显示,瑞芬太尼能通过PI3K/Akt/eNOS通路上调抗凋亡因子Bcl2 mRNA的表达,减少凋亡因子Caspase-3 mRNA的表达,保护细胞内DNA、线粒体的完整性,共同减缓细胞凋亡的进展;同时也可减轻肾脏组织内炎症细胞的募集,减少炎性因子释放,从而减轻肾脏炎症反应,从多个方面发挥肾脏保护作用。
综上所述,肾缺血/再灌注时肾脏组织发生炎症反应,细胞凋亡增加,使肾功能受损。瑞芬太尼能通过激活肾脏细胞中PI3K/Akt/eNOS通路减少炎症细胞的募集和炎性因子的释放,并增加抗凋亡因子、减少凋亡因子的表达,从而减缓细胞凋亡,发挥肾脏保护作用。本研究结果为肾脏手术患者围手术期合理使用镇痛药物瑞芬太尼提供了理论依据,同时为保护肾缺血/再灌注损伤患者围手术期肾功能提供了新的治疗靶点和思路。
| [1] |
CAI Y, XU H, YAN J, ZHANG L, LU Y. Molecular targets and mechanism of action of dexmedetomidine in treatment of ischemia/reperfusion injury[J]. Mol Med Rep, 2014, 9: 1542-1550. DOI:10.3892/mmr.2014.2034 |
| [2] |
WANG P, HE Y, LI D, HAN R, LIU G, KONG D, et al. Class Ⅰ PI3K inhibitor ZSTK474 mediates a shift in microglial/macrophage phenotype and inhibits inflammatory response in mice with cerebral ischemia/reperfusion injury[J/OL]. J Neuroinflammation, 2016, 13: 192. doi: 10.1186/s12974-016-0660-1.
|
| [3] |
PEKTAS M B, TURAN O, OZTURK BINGOL G, SUMLU E, SADI G, AKAR F. High glucose causes vascular dysfunction through Akt/eNOS pathway:reciprocal modulation by juglone and resveratrol[J]. Can J Physiol Pharmacol, 2018, 96: 757-764. DOI:10.1139/cjpp-2017-0639 |
| [4] |
YANG L Q, TAO K M, LIU Y T, CHEUNG C W, IRWIN M G, WONG G T, et al. Remifentanil preconditioning reduces hepatic ischemia-reperfusion injury in rats via inducible nitric oxide synthase expression[J]. Anesthesiology, 2011, 114: 1036-1047. DOI:10.1097/ALN.0b013e3182104956 |
| [5] |
NISHIKAWA H, TANIGUCHI Y, MATSUMOTO T, ARIMA N, MASAKI M, SHIMAMURA Y, et al. Knockout of the interleukin-36 receptor protects against renal ischemia-reperfusion injury by reduction of proinflammatory cytokines[J]. Kidney Int, 2018, 93: 599-614. DOI:10.1016/j.kint.2017.09.017 |
| [6] |
ARAB H H, SALAMA S A, MAGHRABI I A. Camel milk attenuates methotrexate-induced kidney injury via activation of PI3K/Akt/eNOS signaling and intervention with oxidative aberrations[J]. Food Funct, 2018, 9: 2661-2672. DOI:10.1039/C8FO00131F |
| [7] |
VIMALRAJ S, BHUVANESWARI S, LAKSHMIKIRUPA S, JYOTHSNA G, CHATTERJEE S. Nitric oxide signaling regulates tumor-induced intussusceptive-like angiogenesis[J]. Microvasc Res, 2018, 119: 47-59. DOI:10.1016/j.mvr.2018.04.001 |
| [8] |
GE L, LI C, WANG Z, ZHANG Y, CHEN L. Suppression of oxidative stress and apoptosis in electrically stimulated neonatal rat cardiomyocytes by resveratrol and underlying mechanisms[J]. J Cardiovasc Pharmacol, 2017, 70: 396-404. |
| [9] |
WEI Y, ZHOU J, YU H, JIN X. AKT phosphorylation sites of Ser473 and Thr308 regulate AKT degradation[J]. Biosci Biotechnol Biochem, 2019, 83: 429-435. DOI:10.1080/09168451.2018.1549974 |
| [10] |
HAO J, WEI Q, MEI S, LI L, SU Y, MEI C, et al. Induction of microRNA-17-5p by p53 protects against renal ischemia-reperfusion injury by targeting death receptor 6[J]. Kidney Int, 2017, 91: 106-118. DOI:10.1016/j.kint.2016.07.017 |
| [11] |
LI J, CHEN Q, HE X, ALAM A, NING J, YI B, et al. Dexmedetomidine attenuates lung apoptosis induced by renal ischemia-reperfusion injury through α2AR/PI3K/Akt pathway[J/OL]. J Transl Med, 2018, 16: 78. doi: 10.1186/s12967-018-1455-1.
|
| [12] |
ABOUTALEB N, JAMALI H, ABOLHASANI M, PAZOKI TOROUDI H. Lavender oil (Lavandula angustifolia) attenuates renal ischemia/reperfusion injury in rats through suppression of inflammation, oxidative stress and apoptosis[J]. Biomed Pharmacother, 2019, 110: 9-19. DOI:10.1016/j.biopha.2018.11.045 |
| [13] |
TIAN H, WU M, ZHOU P, HUANG C, YE C, WANG L. The long non-coding RNA MALAT1 is increased in renal ischemia-reperfusion injury and inhibits hypoxia-induced inflammation[J]. Ren Fail, 2018, 40: 527-533. DOI:10.1080/0886022X.2018.1487863 |
 2019, Vol. 40
2019, Vol. 40


