2. 甘肃省肿瘤医院, 甘肃省医学科学研究院病理科, 兰州 730030
2. Department of Pathology, Gansu Provincial Cancer Hospital, Gansu Provincial Academic Institute for Medical Research, Lanzhou 730030, Gansu, China
失巢凋亡是细胞与细胞外基质及其他细胞失去接触而发生的一种不依赖半胱氨酸蛋白酶(Caspase)途径的特殊细胞凋亡形式。癌细胞具有的脱离细胞外基质而不发生凋亡的能力被称为失巢凋亡抗性[1],这种特性是肿瘤侵袭和转移的关键因素。Bcl2转录抑制因子1(Bcl2 inhibitor of transcription 1,Bit1)是失巢凋亡的诱导因子,癌细胞可能通过绕过Bit1途径获得失巢凋亡抗性,从而获得锚定独立性和恶性转化[2]。除了在细胞凋亡中的作用外,Bit1还对肿瘤细胞的上皮-间质转化(epithelial-mesenchymal transformation,EMT)发挥抑制作用,Bit1表达增高可以促进间质表型的恶性肿瘤细胞向上皮细胞转变,并上调E-钙黏蛋白表达[3]。但是Bit1在宫颈癌中的表达及其与EMT的关系鲜见报道。目前认为,几乎所有宫颈癌都与人乳头瘤病毒(human papilloma virus,HPV)感染有关,而P16INK4a的表达被认为是HPV感染的标志[4-7],那么在不同的P16INK4a表达情况下,Bit1及EMT标志蛋白E-钙黏蛋白的表达是否不同呢?目前还不清楚。
肿瘤出芽是肿瘤侵袭过程的组织病理学标志,存在于肿瘤浸润前沿或癌巢周围,其反映了具有浸润和转移潜力的肿瘤细胞亚群侵袭的动态过程[8]。本研究选取宫颈鳞状细胞癌标本为研究对象,采用免疫组织化学法检测肿瘤出芽区Bit1、E-钙黏蛋白及P16INK4a的表达情况,并以肿瘤中央区为对照探讨宫颈鳞状细胞癌在浸润和转移过程中获得高侵袭能力的可能机制。
1 资料和方法 1.1 标本来源收集甘肃省肿瘤医院病理科2014 - 2018年宫颈鳞状细胞癌石蜡包埋标本77例,其中角化型鳞状细胞癌40例,非角化型鳞状细胞癌37例。患者年龄为25~67岁,中位年龄为48岁;国际妇产科协会(Federation International of Gynecology and Obstetrics,FIGO)分期Ⅰ期38例,Ⅱ~Ⅲ期39例。标本收集时排除宫颈癌根治性手术前后接受过放射治疗与化学治疗等非手术治疗的患者,以及肿瘤浸润前沿及癌巢周围不存在肿瘤出芽的患者,所有标本的H-E染色切片由2位经验丰富的病理科医师判断并达成一致诊断意见。本研究通过甘肃省肿瘤医院伦理委员会审批。
1.2 试剂及方法所有标本经10%甲醛溶液常规固定,石蜡包埋,制成4 μm厚切片,常规行H-E染色及免疫组织化学染色(MaxVisionTM法)。鼠抗人单克隆抗体E-钙黏蛋白(货号MAB-0589,稀释比例1 : 100)、鼠抗人单克隆抗体P16INK4a(MAB-0673,1 : 200)及免疫组织化学MaxVisionTM试剂盒(KIT-5920)均购自福州迈新生物技术开发有限公司,Bit1浓缩型兔抗人Bit1单克隆抗体(ab62554,1 : 100)购自英国Abcam公司。
1.3 结果判定免疫组织化学染色结果由2位经验丰富的病理科医师采用双盲法独立阅片后做出判断。P16INK4a表达以细胞质及细胞核、Bit1表达以细胞质、E-钙黏蛋白表达以细胞膜呈黄色或黄褐色颗粒为阳性细胞。判读标准:(1)根据显色细胞的比例评分。0分为显色细胞占比为0,1分为显色细胞占比≤ 10%,2分为显色细胞占11%~25%,3分为显色细胞占26%~50%,4分为显色细胞占51%~75%,5分为显色细胞占比≥ 76%。(2)根据细胞染色强度评分。0分为癌细胞无显色,1分为浅黄色,2分为棕黄色,3分为黄褐色。2种记分方法得分相乘结果为最终免疫组织化学评分结果,评分<1分定义为阴性,≥ 1分但<5分为+,≥ 5分但<10分为┼┼,≥ 10分为┼┼┼。参考Rodrigues等[9]的判定方法,将每个肿瘤灶分为2个区域:肿瘤中央区和肿瘤出芽区。肿瘤中央区,定义为最大的扩展肿瘤区域,随机选择3个区域进行评估,每个区域计数100个细胞,计算其中阳性细胞数所占的百分比,取3个区域的算术平均值为显色细胞的比例评分,与染色强度评分相乘后得出最终评分结果。肿瘤出芽区,即肿瘤侵袭边缘出现的单个肿瘤细胞或不超过5个肿瘤细胞的瘤巢,其广泛地渗入邻近的基质。结合宫颈癌出芽的具体情况,在Rodrigues等[9]方法基础上适当改进肿瘤出芽区的确定及评判方法:所有包括宫颈癌成分的切片置于100倍镜下整体扫描,选取出芽最丰富的5个区域;切换至400倍下对每个肿瘤芽中的细胞进行评估,计算阳性细胞占总细胞数的百分比,如果存在肿瘤芽的区域少于5个,则对每个存在肿瘤芽的区域进行评估,最终评分方法同肿瘤中央区。以肿瘤中央区及出芽区各蛋白质表达评分的中位数作为分界点将标本分为高表达组和低表达组:P16INK4a表达评分值≥ 9.2为P16INK4a高表达,<9.2为低表达;E-钙黏蛋白表达评分值≥ 4.2为E-钙黏蛋白高表达,<4.2为低表达;Bit1表达评分值≥ 4.6为Bit1高表达,<4.6为低表达。
1.4 统计学处理采用SPSS 20.0软件进行统计学分析。计数资料以例数和百分数表示,组间比较采用χ2检验或连续校正χ2检验,相关性分析采用Spearman等级相关分析。检验水准(α)为0.05。
2 结果 2.1 P16INK4a在宫颈鳞状细胞癌肿瘤中央区和出芽区的表达情况见表 1、图 1,77例宫颈鳞状细胞癌标本中,肿瘤中央区P16INK4a高表达者占32.5%(25/77)、低表达者占67.5%(52/77),肿瘤出芽区高表达者占67.5%(52/77)、低表达者占32.5%(25/77),差异有统计学意义(χ2 = 18.935,P<0.01)。
|
|
表 1 P16INK4a、E-钙黏蛋白及Bit1在宫颈鳞状细胞癌肿瘤中央区与出芽区的表达 Tab 1 Expression of P16INK4a, E-cadherin and Bit1 in central tumor and tumor budding of cervical squamous cell carcinoma |

|
图 1 P16INK4a在宫颈鳞状细胞癌肿瘤中央区及出芽区的表达 Fig 1 Expression of P16INK4a in central tumor and tumor budding of cervical squamous cell carcinoma Positive immunostaining for P16INK4a in central tumor (A) and tumor budding (B, C). Arrows indicate tumor buds. MaxVision staining. Original magnification: ×100 (A, B), ×400 (C) |
2.2 E-钙黏蛋白在肿瘤中央区和出芽区的表达情况及与临床病理特征之间的关系
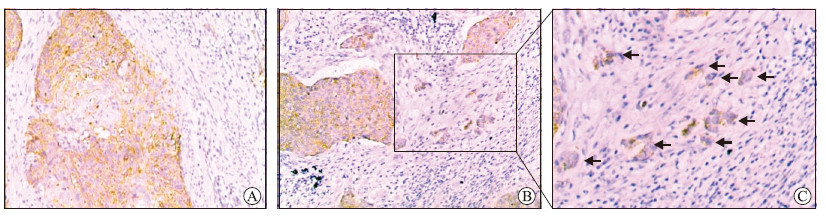
见表 1、图 2,77例宫颈鳞状细胞癌标本中,肿瘤中央区E-钙黏蛋白高表达及低表达率分别为67.5%(52/77)、32.5%(25/77),肿瘤出芽区分别为33.8%(26/77)、66.2%(51/77),差异有统计学意义(χ2 = 17.561,P<0.01)。见表 2,进一步分析发现,无论是在肿瘤中央区还是出芽区,P16INK4a高表达组与P16INK4a低表达组E-钙黏蛋白的表达差异均无统计学意义(P均>0.05)。见表 3,分析E-钙黏蛋白表达水平与临床病理特征之间的关系,结果显示肿瘤出芽区E-钙黏蛋白的表达与淋巴结转移有关(χ2 = 5.580,P = 0.018)。
|
图 2 E-钙黏蛋白在宫颈鳞状细胞癌肿瘤中央区及出芽区的表达 Fig 2 Expression of E-cadherin in central tumor and tumor budding of cervical squamous cell carcinoma Positive immunostaining for E-cadherin at central tumor (A) and tumor budding (B, C). Arrows indicate tumor buds. MaxVision staining. Original magnification: ×100 (A, B), ×400 (C) |
|
|
表 2 宫颈鳞状细胞癌肿瘤中央区和出芽区不同P16INK4a表达情况下E-钙黏蛋白及Bit1表达的差异 Tab 2 Difference of E-cadherin and Bit1 expression under different expression of P16INK4a in central tumor and tumor budding of cervical squamous cell carcinoma |
|
|
表 3 宫颈鳞状细胞癌肿瘤中央区和出芽区E-钙黏蛋白表达与患者临床病理特征的关系 Tab 3 Relationship between E-cadherin expression in central tumor and tumor budding and clinicopathological characteristics of cervical squamous cell carcinoma patients |
2.3 Bit1在肿瘤中央区和出芽区的表达情况及与临床病理特征之间的关系
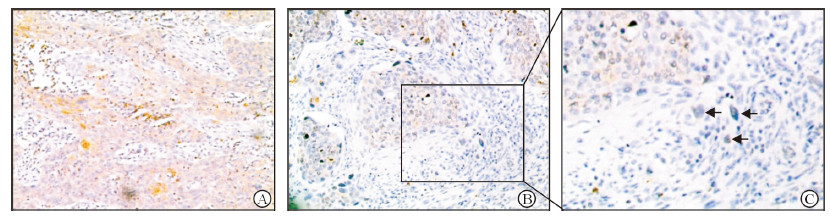
见表 1、图 3,77例宫颈鳞状细胞癌标本中,肿瘤中央区Bit1高表达及低表达率分别为63.6%(49/77)、36.4%(28/77),肿瘤出芽区分别为37.7%(29/77)、62.3%(48/77),差异有统计学意义(χ2 = 10.391,P<0.01)。见表 2,进一步分析发现,无论是在肿瘤中央区还是出芽区,P16INK4a高表达组与P16INK4a低表达组Bit1的表达差异均无统计学意义(P均>0.05)。见表 4,分析Bit1表达水平与患者临床病理特征之间的关系,结果显示肿瘤中央区Bit1的表达水平与脉管内癌栓及淋巴结转移有关(χ2 = 5.053、4.400,P = 0.025、0.036),肿瘤和出芽区其表达水平与淋巴结转移有关(χ2 = 7.573,P = 0.006)。
|
图 3 Bit1在宫颈鳞状细胞癌肿瘤中央区及出芽区的表达 Fig 3 Expression of Bit1 at central tumor and tumor budding of cervical squamous cell carcinoma Positive immunostaining for Bit1 in central tumor (A) and tumor budding (B, C). Arrows indicate tumor buds. Bit1: Bcl2 inhibitor of transcription 1. MaxVision staining. Original magnification: ×100 (A, B), ×400 (C) |
|
|
表 4 宫颈鳞状细胞癌肿瘤中央区和出芽区Bit1表达与临床病理特征的关系 Tab 4 Relationship between Bit1 expression in central tumor and tumor budding and clinicopathological characteristics of cervical squamous cell carcinoma patients |
2.4 肿瘤中央区和出芽区E-钙黏蛋白与Bit1表达的相关性分析
见表 5,无论在肿瘤中央区还是在肿瘤出芽区,E-钙黏蛋白与Bit1表达均呈正相关(r = 0.287,P = 0.011;r = 0.236,P = 0.039)。
|
|
表 5 宫颈鳞状细胞癌肿瘤中央区及出芽区E-钙黏蛋白与Bit1表达的Spearman等级相关分析 Tab 5 Spearman rank correlation analysis between E-cadherin and Bit1 expression in central tumor and tumor budding of cervical squamous cell carcinoma |
3 讨论
研究显示在大肠癌肿瘤出芽区中E-钙黏蛋白表达下调,同时伴随着β-连环蛋白(β-catenin)的核移位、细胞极性丧失及表现为成纤维细胞的形态特征[10]。Kohler等[11]将E-钙黏蛋白表达缺失作为EMT的生物学标志,发现E-钙黏蛋白在胰腺导管腺癌的肿瘤出芽区表达降低,在大肠癌中目前已知的EMT诱导因子如转录因子锌指E盒结合同源盒蛋白(zinc-finger E-box binding homeobox protein,ZEB)1和ZEB2的表达也有所上调[12]。最近Meyer等[13]研究发现大肠癌的肿瘤芽存在既表达上皮表型又表达间质表型的现象,并提出肿瘤芽代表着发生部分EMT的细胞亚群。Grigore等[14]也提出肿瘤出芽是EMT的形态学表现的观点。本研究结果显示,与肿瘤中央区相比,肿瘤出芽区E-钙黏蛋白表达降低(P<0.01),说明宫颈鳞状细胞癌肿瘤出芽区细胞同样具有向间质细胞转化的特征,提示宫颈癌的侵袭能力增加可能与EMT有关。进一步分析E-钙黏蛋白表达与患者临床病理特征的关系,肿瘤出芽区E-钙黏蛋白的表达与淋巴结转移有关,而在肿瘤中央区则无此相关性,提示肿瘤出芽区E-钙黏蛋白表达降低的患者预后更差,肿瘤出芽区E-钙黏蛋白的表达情况可能是预测宫颈癌预后的一项较好的指标。
获得抗失巢凋亡能力是肿瘤侵袭和转移的关键因素。研究发现Bit1可以通过抑制肿瘤细胞的迁移和侵袭促进失巢凋亡[15],因此恶性肿瘤细胞可能通过下调Bit1实现抗失巢凋亡,如在非小细胞肺癌[2]和乳腺癌[16]的晚期阶段Bit1均被选择性下调,而Bit1表达下调后非小细胞肺癌细胞的失巢凋亡抗性和不依赖贴壁的生长能力增强[2]。在卵巢癌中雌激素也可通过减少Bit1释放影响卵巢癌细胞系Caov-3的失巢凋亡[17]。本研究结果显示,宫颈癌肿瘤出芽区Bit1的表达低于肿瘤中央区(P<0.01),提示宫颈癌肿瘤出芽区细胞亚群的高侵袭性可能与Bit1的表达降低有关,推测宫颈癌细胞可能通过抑制Bit1的表达获得失巢凋亡抗性从而具有了更高的侵袭能力。进一步分析Bit1表达与患者临床病理特征的关系发现,肿瘤中央区Bit1低表达与脉管内癌栓有关(P<0.05),并且无论是肿瘤中央区还是肿瘤出芽区Bit1低表达均与患者的淋巴结转移有关,说明Bit1表达降低的患者更容易发生局部侵犯和转移,这一结果也与前述抑制Bit1表达增强宫颈癌侵袭能力的推测相吻合。
研究发现,Bit1除了在细胞凋亡中发挥作用外,还对非小细胞肺癌中的EMT发挥抑制作用[3]。抑制内源性Bit1表达可以诱导细胞间充质表型,包括增强的成纤维细胞样形态和迁移潜能,伴随上皮标志物E-钙黏蛋白表达的抑制。增加外源性Bit1表达可促进肿瘤向上皮细胞转变,异位Bit1被证明可有效阻断体内非小细胞肺癌细胞的转移潜能,Bit1诱导的E-钙黏蛋白表达是Bit1依赖的失巢凋亡和EMT抑制的必要分子事件[3, 18]。在胰腺癌中,EMT也被证明可能参与Bit1依赖的失巢凋亡的整个调节过程[15]。那么在宫颈癌中Bit1的表达是否与EMT标志物E-钙黏蛋白的表达有关呢?本研究结果显示,在肿瘤中央区和肿瘤出芽区E-钙黏蛋白与Bit1表达均呈正相关(r = 0.287,P = 0.011;r = 0.236,P = 0.039),提示Bit1表达的抑制与宫颈癌细胞同质性黏附能力降低并向间质特征转化有关,宫颈癌细胞可能通过抑制Bit1表达获得失巢凋亡抗性并通过影响EMT提高其侵袭能力,从而发生浸润和转移,这一结果与Yao等[3]的研究结果相吻合。
宫颈癌的发生与HPV感染密切相关,但是HPV须持续存在并最终整合到宿主基因组中才会导致宫颈上皮细胞发生肿瘤转化,而P16INK4a的免疫组织化学表达被建议作为HPV诱导的肿瘤转化的替代指标[4-7]。为了探讨宫颈癌细胞的侵袭性是否与P16INK4a表达有关,本研究检测了P16INK4a在肿瘤中央区及肿瘤出芽区的表达,结果显示肿瘤出芽区P16INK4a的表达高于中央区,提示P16INK4a表达增高与宫颈的侵袭能力增强有关,这与Kanthiya等[19]及Zhang等[20]的研究结果相符。那么,P16INK4a高表达是否与宫颈癌获得失巢凋亡抗性及EMT的发生有关呢?在本研究中,分别将肿瘤中央区及肿瘤出芽区分为P16INK4a高表达组与P16INK4a低表达组,分析不同P16INK4a表达情况下Bit1及E-钙黏蛋白表达的变化情况,结果显示无论是在中央肿瘤区还是出芽区二者在P16INK4a高表达组与P16INK4a低表达组的表达差异均无统计学意义(P均>0.05),提示P16INK4a的表达可能与宫颈癌是否获得失巢凋亡抗性及EMT过程中同质性黏附能力降低无关,推测P16INK4a可能未参与失巢凋亡抗性及EMT的过程。
综上所述,本研究结果提示宫颈癌侵袭性的增高可能与Bit1、E-钙黏蛋白表达降低及P16INK4a表达增加有关,宫颈癌细胞可能通过抑制Bit1获得失巢凋亡抗性并影响EMT的发生而获得更高的侵袭能力,但P16INK4a并未参与此过程。Bit1与E-钙黏蛋白之间作用的具体机制仍有待进一步研究。
| [1] |
KAKAVANDI E, SHAHBAHRAMI R, GOUDARZI H, ESLAMI G, FAGHIHLOO E. Anoikis resistance and oncoviruses[J]. J Cell Biochem, 2018, 119: 2484-2491. DOI:10.1002/jcb.26363 |
| [2] |
YAO X, JENNINGS S, IRELAND S K, PHAM T, TEMPLE B, DAVIS M, et al. The anoikis effector Bit1 displays tumor suppressive function in lung cancer cells[J/OL]. PLoS One, 2014, 9: e101564. doi: 10.1371/journal.pone.0101564.
|
| [3] |
YAO X, PHAM T, TEMPLE B, GRAY S, CANNON C, CHEN R, et al. The anoikis effector Bit1 inhibits EMT through attenuation of TLE1-mediated repression of E-cadherin in lung cancer cells[J/OL]. PLoS One, 2016, 11: e0163228. doi: 10.1371/journal.pone.0163228.
|
| [4] |
SARWATH H, BANSAL D, HUSAIN N E, MOHAMED M, SULTAN A A, BEDRI S. Introduction of P16INK4a as a surrogate biomarker for HPV in women with invasive cervical cancer in Sudan[J/OL]. Infect Agent Cancer, 2017, 12: 50. doi: 10.1186/s13027-017-0159-0.
|
| [5] |
VON KNEBEL DOEBERITZ M, REUSCHENBACH M, SCHMIDT D, BERGERON C. Biomarkers for cervical cancer screening:the role of p16INK4a to highlight transforming HPV infections[J]. Expert Rev Proteomics, 2012, 9: 149-163. DOI:10.1586/epr.12.13 |
| [6] |
CHEAH P L, LOOI L M, TEOH K H, MUN K S, NAZARINA A R. p16INK4a is a useful marker of human papillomavirus integration allowing risk stratification for cervical malignancies[J]. Asian Pac J Cancer Prev, 2012, 13: 469-472. DOI:10.7314/APJCP.2012.13.2.469 |
| [7] |
HALEC G, SCHMITT M, DONDOG B, SHARKHUU E, WENTZENSEN N, GHEIT T, et al. Biological activity of probable/possible high-risk human papillomavirus types in cervical cancer[J]. Int J Cancer, 2013, 132: 63-71. DOI:10.1002/ijc.27605 |
| [8] |
ZLOBEC I, LUGLI A. Epithelial mesenchymal transition and tumor budding in aggressive colorectal cancer:tumor budding as oncotarget[J]. Oncotarget, 2010, 1: 651-661. |
| [9] |
RODRIGUES I S, LAVORATO-ROCHA A M, DE M MAIA B, STIEPCICH M M, DE CARVALHO F M, BAIOCCHI G, et al. Epithelial-mesenchymal transition-like events in vulvar cancer and its relation with HPV[J]. Br J Cancer, 2013, 109: 184-194. DOI:10.1038/bjc.2013.273 |
| [10] |
BRABLETZ T, JUNG A, REU S, PORZNER M, HLUBEK F, KUNZ-SCHUGHART L A, et al. Variable beta-catenin expression in colorectal cancers indicates tumor progression driven by the tumor environment[J]. Proc Natl Acad Sci USA, 2001, 98: 10356-10361. DOI:10.1073/pnas.171610498 |
| [11] |
KOHLER I, BRONSERT P, TIMME S, WERNER M, BRABLETZ T, HOPT U T, et al. Detailed analysis of epithelial-mesenchymal transition and tumor budding identifies predictors of long-term survival in pancreatic ductal adenocarcinoma[J]. J Gastroenterol Hepatol, 2015, 30(Suppl 1): 78-84. |
| [12] |
DE SMEDT L, PALMANS S, ANDEL D, GOVAERE O, BOECKX B, SMEETS D, et al. Expression profiling of budding cells in colorectal cancer reveals an EMT-like phenotype and molecular subtype switching[J]. Br J Cancer, 2017, 116: 58-65. DOI:10.1038/bjc.2016.382 |
| [13] |
MEYER SN, GALVÁN J A, ZAHND S, SOKOL L, DAWSON H, LUGLI A, et al. Co-expression of cytokeratin and vimentin in colorectal cancer highlights a subset of tumor buds and an atypical cancer-associated stroma[J]. Hum Pathol, 2019, 87: 18-27. DOI:10.1016/j.humpath.2019.02.002 |
| [14] |
GRIGORE A D, JOLLY M K, JIA D, FARACH-CARSON M C, LEVINE H. Tumor budding: the name is EMT. Partial EMT[J/OL]. J Clin Med, 2016, 5: E51. doi: 10.3390/jcm5050051.
|
| [15] |
黄帅, 袁达, 郭俊超, 张太平, 赵玉沛. Bit1蛋白对胰腺癌细胞恶性生物学行为的影响及其临床指标的相关性分析[J]. 中华外科杂志, 2017, 55: 857-862. |
| [16] |
KARMALI P P, BRUNQUELL C, TRAM H, IRELAND S K, RUOSLAHTI E, BILIRAN H. Metastasis of tumor cells is enhanced by downregulation of Bit1[J/OL]. PLoS One, 2011, 6: e23840. doi: 10.1371/journal.pone.0023840.
|
| [17] |
ZHENG J, ZHOU J, XIE X, XIE B, LIN J, XU Z, et al. Estrogen decreases anoikis of ovarian cancer cell line Caov-3 through reducing release of Bit1[J]. DNA Cell Biol, 2014, 33: 847-853. DOI:10.1089/dna.2014.2453 |
| [18] |
YAO X, PHAM T, TEMPLE B, GRAY S, CANNON C, HARDY C, et al. TLE1 inhibits anoikis and promotes tumorigenicity in human lung cancer cells through ZEB1-mediated E-cadherin repression[J]. Oncotarget, 2017, 8: 72235-72249. |
| [19] |
KANTHIYA K, KHUNNARONG J, TANGJITGAMOL S, PURIPAT N, TANVANICH S. Expression of the p16 and Ki67 in cervical squamous intraepithelial lesions and cancer[J]. Asian Pac J Cancer Prev, 2016, 17: 3201-3206. |
| [20] |
ZHANG C Y, BAO W, WANG L H. Downregulation of p16ink4a inhibits cell proliferation and induces G1 cell cycle arrest in cervical cancer cells[J]. Int J Mol Med, 2014, 33: 1577-1585. DOI:10.3892/ijmm.2014.1731 |
 2019, Vol. 40
2019, Vol. 40


