开展军事医学研究实验的目的在于减轻战争和恐怖主义袭击对武装部队及群众的影响,并提高对伤员的救治效率。由于爆炸等原因造成的血管创伤是导致伤员急性失血并引起战场伤亡和死亡率升高的重要原因,如何救治战时血管创伤成为研究关键,因此用于血管创伤实验的动物模型至关重要。血管创伤动物模型主要分为创伤性血管疾病模型和创伤性出血模型两大类,目前常用的动物种类为兔类、鼠类、猪类。本文综述了有关血管创伤的动物模型,介绍了模型的建立方法、研究内容及适用范围,总结及展望了血管创伤动物模型的发展与困境。
1 创伤性血管疾病模型在现代战场上,因爆炸等引起的颅脑、躯体和肢体创伤往往与血管损伤合并存在[1-2]。这些损伤常须在战区内进行紧急血管修复后才能在战后进行重建治疗[2]。目前据此构建的、具有较为成熟造模方法的创伤性血管疾病动物模型包括创伤性动脉瘤动物模型、创伤性动静脉瘘动物模型和创伤性肢体深静脉血栓动物模型3类。
1.1 创伤性动脉瘤动物模型创伤性动脉瘤,又称假性动脉瘤,是因动脉管壁被撕裂或穿破后血液自此破口流至动脉中膜和外膜之间而形成的搏动性血肿。其不同于真性动脉瘤,真性动脉瘤拥有完整的内膜、中膜及外膜。血管损伤时假性动脉瘤的发生率约为9%[3],最常发生于股动脉[4]。实验室中创伤性动脉瘤动物模型的造模血管主要有股动脉和颈动脉。
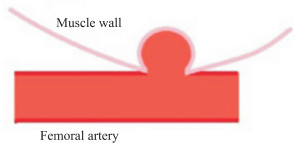
1.1.1 股动脉创伤性动脉瘤模型股动脉是创伤性动脉瘤的首发部位,尤其是贯穿伤[5]。股动脉创伤性动脉瘤动物模型于1998年首次构建成功[6],示意图见图 1。该模型使用日本白兔,体质量为2.5~3.0 kg,雌雄均可。模型构建方法:将动物麻醉、消毒后,于腹股沟处做切口,分离暴露股动脉后使用血管夹夹闭其近心端以阻断血流。于股动脉远心端做长3 mm的纵向切口,使用双极电凝器在相应位置肌壁上烧灼造成一直径和深度均为5 mm的圆形小洞,然后在显微镜下用9-0无损伤缝线将股动脉纵向切口与肌壁上的圆形小洞吻合,形成一个比肌壁上烧灼的圆形小洞稍大的血肿。若无渗血且在吻合口的远心端能够扪及动脉搏动,提示造模成功。与大型动物模型相比,用兔类建立的模型可节约更多的研究成本,且操作简便,有利于开展假性动脉瘤相关实验。
|
图 1 日本白兔股动脉创伤性动脉瘤模型示意图 Fig 1 Schematic diagram of femoral artery traumatic aneurysm model in Japanese white rabbits |
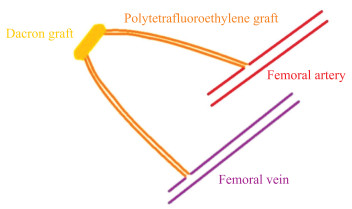
2003年另有一种使用家猪建立的股动脉创伤性动脉瘤模型构建成功[7],示意图见图 2。研究者造模使用的家猪体质量为45~50 kg。将家猪麻醉、消毒后,在双侧腹股沟韧带下2 cm处做切口,暴露股动脉和股静脉后静脉推注肝素50 U/kg,然后用血管钳阻断血流。使用6 mm扩张性聚四氟乙烯移植物在皮下空间与股动脉、股静脉端侧吻合,形成30 cm的环形动静脉分流,并在此移植物中间插入一段直径12 mm、长4 cm的Dacron移植物造成假性动脉瘤。
|
图 2 家猪股动脉创伤性动脉瘤模型示意图 Fig 2 Schematic diagram of traumatic femoral artery aneurysm model in pigs |
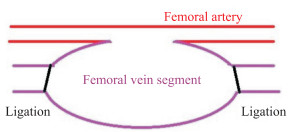
2010年,Geutjes等[8]在上述家猪股动脉创伤性动脉瘤模型的基础上,构建了一种大小可控且能够定位的股动脉假性动脉瘤模型(图 3)。他们将家猪麻醉、消毒后,分离暴露股动脉和静脉,使用血管钳阻断血流,在股动脉和股静脉上的相应位置分别纵向切开4 mm,并用6-0聚四氟乙烯缝线吻合股动脉和股静脉切口,取下股静脉血管钳并在该位置近、远端结扎,形成假性动脉瘤。在该模型建立时不仅在建模流程上予以简化改进,研究者还能根据研究目的控制动物模型中的瘤体大小,便于建造更适合的动物模型。
|
图 3 改进家猪股动脉创伤性动脉瘤模型示意图 Fig 3 Schematic diagram of modified improved traumatic femoral artery aneurysm model in pigs |
1.1.2 颈动脉创伤性动脉瘤模型
我国学者将颈动脉创伤性动脉瘤的形成过程分为4期:动脉损伤血肿形成期、假性动脉瘤形成前期、假性动脉瘤形成期、瘤体增大期[9]。颈动脉创伤性动脉瘤的瘤腔增大速率较真性动脉瘤更快,且其破裂的风险也更大,一旦确诊应尽早治疗。此类模型的建立常使用兔类,例如Herting等[10]用体质量为3.0~3.5 kg的日本大耳兔建立的颈动脉创伤性动脉瘤模型。建模方法:将兔麻醉、消毒后,在显微镜下分离暴露颈总动脉,于右侧胸头肌的中点处,沿内缘用双极电凝烧灼一直径为2~3 mm的圆孔,开口向内侧,深约5 mm。动脉夹夹闭颈总动脉近心端以阻断血流,在与肌肉灼烧圆孔相对的颈总动脉壁上做纵向切口,长4~5 mm。用含25 U/mL肝素的生理盐水冲洗颈总动脉管腔至无血凝块后,再用9-0无损伤缝线吻合动脉纵向切口与肌肉灼烧圆孔,从而形成假性动脉瘤。若无渗出则提示造模成功。
1.1.3 其他创伤性动脉瘤模型Bai等[11]用小动物构建了主动脉及下腔静脉假性动脉瘤模型,采用6~8周龄的Wistar大鼠进行心包补片植入。将大鼠麻醉、消毒后,在显微镜下分离暴露下腔静脉,于肾静脉平面下缘及其下2 mm处用血管钳夹闭血管阻断血流,并用6-0缝线结扎离断此范围内的所有腰椎静脉,在前壁做长3 mm的纵向切口。采用连续缝合法以10-0缝线将心包补片与切口边缘缝合,缝合后松开血管钳恢复下腔静脉血流。缝合腹部切口,完成下腔静脉假性动脉瘤造模。主动脉假性动脉瘤模型以相似的方式植入皮下贴片造模。
1.2 创伤性动静脉瘘动物模型动静脉瘘是动脉和静脉之间的异常连接,动静脉间没有毛细血管存在[12]。动静脉瘘可以是自发性的,也可以是创伤或手术造成的,会导致心力衰竭、血栓形成、血管瘤等多种危及生命的严重并发症。绝大多数后天性动静脉瘘是由创伤所致,且以股部为多发部位[13]。因此,创伤性动静脉瘘动物模型的造模位置常在股动脉,常用的动物主要是兔类和鼠类。
1.2.1 兔类创伤性动静脉瘘模型相较鼠类,兔类体型相对较大,其动脉解剖结构也与人类更相近,易于造模[14]。兔类创伤性动静脉瘘模型一般使用新西兰大白兔[15],体质量为2.2~2.4 kg。经耳缘静脉注射3%戊巴比妥钠(1 mL/kg)麻醉后,仰卧位固定并消毒。在一侧腹股沟韧带下缘2 cm处做皮肤切口,分离暴露股动脉和股静脉,用血管钳夹闭动脉、静脉两端以阻断血流。取动脉、静脉相邻侧各做长5~6 mm的纵向切口,注射肝素(100 U/mL)冲洗,然后在显微镜下用12-0缝线进行动静脉侧侧吻合。松开血管钳,吻合血管通畅无渗漏则动静脉瘘模型成功建立。
1.2.2 鼠类创伤性动静脉瘘模型鼠类因其繁殖速度快,饲养条件要求又相对较低,被广泛用在科研工作中。与其他模型动物相比,鼠类成本低、体型适中,使得建立的动物模型更加简单且易操作[14]。但鼠类血管较为细小,与人类在生理及解剖结构上存在差异。鼠类创伤性动静脉瘘模型一般使用大鼠,体质量为350~415 g。将大鼠麻醉、消毒后做右腹股沟切口,暴露并夹闭股动脉和股静脉两端。在股动脉侧壁做切口后结扎离断股静脉远端。用10-0缝线在股静脉离断端与股动脉侧壁切口之间进行端侧吻合,使用多普勒超声验证血流通畅后用4-0缝线缝合皮肤[16]。
1.3 创伤性肢体深静脉血栓动物模型深静脉血栓形成是静脉血栓栓塞的主要表现之一,其高发病率是导致人类死亡率增高的主要原因之一。最近研究报道,仅在美国,静脉血栓的发病率就高达每年90万例,其中1/4的病例是致命的[17-18]。战场上创伤后的肢体制动是使深静脉血栓高发的主要危险因素[19],为探索其发生机制及制定具体的预防措施,创伤性肢体深静脉血栓动物模型的建立不可或缺。虽然早先已存在多种静脉血栓形成的动物模型,但这些模型是以直接损伤血管而导致的急性血栓形成模型,并不适用于研究创伤后肢体制动导致的亚急性或慢性深静脉血栓形成[20]。在动物种类使用方面,由于Virchow最初使用犬类建立模型以模仿人类的发病情况,所以当时的研究大多使用大型哺乳动物[21-23];后因转基因技术的发展,人们较多地使用小型的啮齿类动物,如鼠类、兔类。
1.3.1 兔类创伤性肢体深静脉血栓模型一般使用8~10个月龄的新西兰大白兔,体质量为(3.0±0.2)kg。耳缘静脉注射3%戊巴比妥钠(1 mL/kg)麻醉后,将兔子以右侧俯卧位固定。使用打击装置在左侧股骨大转子至大转子下1.5 cm范围内以7.5 J的能量进行击打,击打接触面积约为1 cm2。然后利用石膏将左下肢固定于屈髋屈膝位,检查右髋能够自由活动后,成俯卧位,再行石膏定型。于造模后第7天使用彩色多普勒超声观察股静脉血栓情况,如血栓形成则造模成功[20]。
1.3.2 鼠类创伤性肢体深静脉血栓模型目前研究通常使用Drawley大鼠,体质量为(280±15)g。将造模大鼠双下肢固定后,在两侧下肢的近端(距大转子约1.0 cm处)外侧使用打击装置施加5 J的能量击打。确认击打导致骨折后用石膏固定,25 h后使用超声检查观察造模大鼠是否发生深静脉血栓形成,判断造模有效性[24-25]。
2 创伤性出血动物模型不可控的大量失血是战场上发生死亡的主要原因之一[26],高达90%的可预防死亡都是由大出血引起的,其中超过1/3的死亡是由肢体损伤后急性失血导致的[27],绝大多数不受控制的大出血死亡发生在伤员运输途中[28]。因此,早期控制出血是救治伤员的最有效策略之一,手术技术和其他止血方法的改进对于保护伤员的生命至关重要,而相关研究很大程度上需要依靠建立动物出血模型以模拟相应损伤情况来开展。目前,动物出血模型已被广泛使用于战场创伤研究,建立方法有直接损伤血管法、肝脏损伤法、脾切除后血管抽取法、脾脏损伤法等。
直接离断或损伤血管而建立的创伤性出血动物模型主要使用猪类。早先,研究者常采用体质量为42~55 kg的约克夏猪进行复杂的腹股沟损伤血管,建立出血模型。该过程包括大腿近端半横切和股动脉及股静脉的完全离断,在损伤后15 min开始复苏,成功复苏则造模成功。同时监测血流动力学180 min,记录伤口的温度及动脉、静脉、神经和肌肉的损伤情况,实验以造模动物的失血死亡为观察终点[29]。而目前的创伤性出血动物模型建立过程已简化,如Stuart等[30]建立的一种用于研究战场止血的创伤性出血模型,使用体质量为35~45 kg的约克夏猪。将猪麻醉、消毒后,分离暴露股动脉、腋窝动脉和颈动脉,使用6 mm的穿孔活组织检查设备进行动脉切开术。体外失血量利用止血垫与纱布的质量测量,使用侵入性设备持续监测动物的生命体征,当平均血压降低至20 mmHg(1 mmHg=0.133 kPa)以下且末端潮汐二氧化碳含量低于15 mmHg连续2 min时判定造模动物死亡,结束实验观测。
3 展望和困境血管创伤动物模型的建立与使用在很大程度上有助于军事医学血管创伤研究的开展,也可辅助研究者更好地理解战时血管创伤的发生并及时革新更高效的预防和治疗措施,从而达到减少战争伤亡的目的。随着基因研究工作的发展,为了节约成本和简化实验操作,未来更多的动物模型可能将倾向于使用小型啮齿类代替大型哺乳动物,鼠类可能会逐渐成为动物模型建立的主要使用动物种类。
动物模型的发展也常常涉及到许多伦理方面的问题。例如,美国国防部对使用动物进行创伤研究的方式已经提出意见,特别是在用活体动物开展模拟实验时动物可能没有完全麻醉,这完全违反了动物伦理[31]。如何解决动物模型相关的科学研究与伦理问题之间的困境将是未来动物实验的发展重点,在将来的军事研究中也可能更多地应用动物模型的替代方案,如用于碰撞和冲击研究的模拟人等。这些方法多已被用于实验,且早在1970年就有研究者将创伤研究的模型分为人体、人类学模型、活体动物和非物理模型4类[32],人类学模型和非物理模型在创伤研究中的应用可能会成为未来的发展方向。
| [1] |
SHIN D H, HOOTEN K G, SINDELAR B D, CORLISS B M, CARLTON W R Y, CARROLL C P, et al. Direct enhancement of readiness for wartime critical specialties by civilian-military partnerships for neurosurgical care: residency training and beyond[J/OL]. Neurosurg Focus, 2018, 45: E17. doi: 10.3171/2018.8.FOCUS18387.
|
| [2] |
CASEY K, SABINO J, JESSIE E, MARTIN B D, VALERIO I. Flap coverage outcomes following vascular injury and repair: chronicling a decade of severe war-related extremity trauma[J]. Plast Reconstr Surg, 2015, 135: 301-308. DOI:10.1097/PRS.0000000000000769 |
| [3] |
MOUSA A, ZAKARIA O M, HANBAL I, SULTAN T A, EL-GIBALY A M, ZAKARIA M Y, et al. Operative management of non-iatrogenic pediatric and adolescence peripheral arterial trauma: an experience from a resource challenged setting[J]. Asian J Surg, 2019, 42: 761-767. DOI:10.1016/j.asjsur.2018.09.012 |
| [4] |
FLUMIGNAN R, GUEDES NETO H, ARAUJO S, GIULIO Y D, PORTA C, AMORIM J, et al. Fibrin sealant repair of a double-necked femoral pseudoaneurysm[J]. Rev Assoc Med Bras (1992), 2018, 64: 1069-1072. DOI:10.1590/1806-9282.64.12.1069 |
| [5] |
RAWAT S K, SINGH D, SURESH BABU P, GEORGE R, MONGIA P. Traumatic pseudoaneurysm: a life-threatening complication after surgical extraction of impacted maxillary third molar[J]. J Maxillofac Oral Surg, 2019, 18: 57-60. DOI:10.1007/s12663-018-1118-z |
| [6] |
SUN H T, LIAO S Z, CHEN H, FENG W F, XU Y N, ZHENG Y M. Production of animal model of traumatic pseudoaneurysm[J]. Microsurgery, 1998, 18: 103-109. DOI:10.1002/(SICI)1098-2752(1998)18:2<103::AID-MICR8>3.0.CO;2-N |
| [7] |
LIN P H, JOHNSON C K, PULLIUM J K, KOFFRON A J, CONKLIN B, TERRAMANI T T, et al. Transluminal stent graft repair with Wallgraft endoprosthesis in a porcine arteriovenous graft pseudoaneurysm model[J]. J Vasc Surg, 2003, 37: 175-181. DOI:10.1067/mva.2002.87 |
| [8] |
GEUTJES P J, VAN DER VLIET J A, FARAJ K A, VRIES Nd, VAN MOERKERK H T, WISMANS R G, et al. An animal model for femoral artery pseudoaneurysms[J]. J Vasc Interv Radiol, 2010, 21: 1078-1083. DOI:10.1016/j.jvir.2010.01.040 |
| [9] |
郑玉明, 徐永年, 孙鸿涛, 陈庄洪, 马廉亭. 假性动脉瘤形戚机理及破裂出血的实验研究[J]. 中国急救医学, 1997, 17: 5-7. |
| [10] |
HERTING S M, DING Y, BOYLE A J, DAI D, NASH L D, ASNAFI S, et al. In vivo comparison of shape memory polymer foam-coated and bare metal coils for aneurysm occlusion in the rabbit elastase model[J]. J Biomed Mater Res B Appl Biomater, 2019, 107: 2466-2475. DOI:10.1002/jbm.b.34337 |
| [11] |
BAI H, LEE J S, HU H, WANG T, ISAJI T, LIU S, et al. Transforming growth factor-β1 inhibits pseudoaneurysm formation after aortic patch angioplasty[J]. Arterioscler Thromb Vasc Biol, 2018, 38: 195-205. DOI:10.1161/ATVBAHA.117.310372 |
| [12] |
XU K, JI T, LI C, YU J. Current status of endovascular treatment for dural arteriovenous fistulae in the anterior cranial fossa: a systematic literature review[J]. Int J Med Sci, 2019, 16: 203-211. DOI:10.7150/ijms.29637 |
| [13] |
BISWAS S, HRISTOV B. Endovascular management of a penetrating zone Ⅲ retroperitoneal gunshot wound injury; a case report[J]. Bull Emerg Trauma, 2017, 5: 303-306. DOI:10.18869/acadpub.beat.5.4.482 |
| [14] |
韩同磊, 孙羽东, 秦锋, 赵志青, 景在平. 动脉粥样硬化动物模型的研究进展[J]. 血管与腔内血管外科杂志, 2017, 3: 962-967. |
| [15] |
SU P L, BAO K, PENG H G, MAO W, WANG G S, YANG N Z, et al. Effects of Tongmai oral liquid in femoral ateriovenous fistula[J/OL]. BMC Complement Altern Med, 2015, 15: 311. doi: 10.1186/s12906-015-0844-8.
|
| [16] |
JALAEEFAR A, MOHAMMADI TOFIGH A, GHARIB A, KHANDAGHY M, RAHIMI M R. Effects of N-acetylcysteine on arterial neo-intimal hyperplasia in rat model of arteriovenous fistula[J]. J Vasc Access, 2019, 20: 190-194. DOI:10.1177/1129729818793368 |
| [17] |
MINGES K E, BIKDELI B, WANG Y, ATTARAN R R, KRUMHOLZ H M. National and regional trends in deep vein thrombosis hospitalization rates, discharge disposition, and outcomes for medicare beneficiaries[J]. Am J Med, 2018, 131: 1200-1208. DOI:10.1016/j.amjmed.2018.04.033 |
| [18] |
COSCIA C, JAUREGUIZAR A, QUEZADA CA, MURIEL A, MONREAL M, VILLéN T, et al. Comparison of all-cause mortality following VTE treatment between propensity score-adjusted observational studies and matched randomized controlled trials: meta-epidemiologic study[J]. Chest, 2019, 155: 689-698. DOI:10.1016/j.chest.2018.10.016 |
| [19] |
SABINO J M, SLATER J, VALERIO I L. Plastic surgery challenges in war wounded Ⅰ: flap-based extremity reconstruction[J]. Adv Wound Care (New Rochelle), 2016, 5: 403-411. DOI:10.1089/wound.2015.0656 |
| [20] |
何飞, 胡敏, 王兵, 赵宏斌, 张春强, 赵智, 等. 构建创伤性肢体深静脉血栓动物模型及其应用评价[J]. 中国临床康复, 2005, 9: 112-113. |
| [21] |
DIAZ J A, OBI A T, MYERS D D Jr, WROBLESKI S K, HENKE P K, MACKMAN N, et al. Critical review of mouse models of venous thrombosis[J]. Arterioscler Thromb Vasc Biol, 2012, 32: 556-562. DOI:10.1161/ATVBAHA.111.244608 |
| [22] |
JESKE W P, IQBAL O, FAREED J, KAISER B. A survey of venous thrombosis models[J]. Methods Mol Med, 2004, 93: 221-237. DOI:10.1385/1-59259-658-4:221 |
| [23] |
DIDISHEIM P. Animal models useful in the study of thrombosis and antithrombotic agents[J]. Prog Hemost Thromb, 1972, 1: 165-197. |
| [24] |
MO J W, ZHANG D F, JI G L, LIU X Z, FAN B. TGF-β1 and Serpine 1 expression changes in traumatic deep vein thrombosis[J]. Genet Mol Res, 2015, 14: 13835-13842. DOI:10.4238/2015.October.29.3 |
| [25] |
SCHÖNFELDER T, JÄCKEL S, WENZEL P. Mouse models of deep vein thrombosis[J]. Gefasschirurgie, 2017, 22(Suppl 1): 28-33. |
| [26] |
DELTOFF M N. Managing life-threatening traumatic hemorrhage: a new solution for a changing world paradigm[J]. J J Emergen Med, 2018, 4: 38. |
| [27] |
ANDERSON K L, MORA A G, BLOOM A D, MADDRY J K, BEBARTA V S. Cardiac massage for trauma patients in the battlefield: an assessment for survivors[J]. Resuscitation, 2019, 138: 20-27. DOI:10.1016/j.resuscitation.2019.02.029 |
| [28] |
HART D, RUSH R, RULE G, CLINTON J, BEILMAN G, ANDERS S, et al. Training and assessing critical airway, breathing, and hemorrhage control procedures for trauma care: live tissue versus synthetic models[J]. Acad Emerg Med, 2018, 25: 148-167. DOI:10.1111/acem.13340 |
| [29] |
ALAM H B, UY G B, MILLER D, KOUSTOVA E, HANCOCK T, INOCENCIO R, et al. Comparative analysis of hemostatic agents in a swine model of lethal groin injury[J]. J Trauma, 2003, 54: 1077-1082. DOI:10.1097/01.TA.0000068258.99048.70 |
| [30] |
STUART S M, ZAROW G, WALCHAK A, MCLEAN J, ROSZKO P. Pilot study of a novel swine model for controlling junctional hemorrhage using the iTClamp in conjunction with hemostatic agents[J]. Mil Med, 2019, 184(Suppl 1): 367-373. |
| [31] |
COMBES R D. A critical review of anaesthetised animal models and alternatives for military research, testing and training, with a focus on blast damage, haemorrhage and resuscitation[J]. Altern Lab Anim, 2013, 41: 385-415. DOI:10.1177/026119291304100508 |
| [32] |
PINCE B W. Simulations of the human body for the study of trauma[J]. J Trauma, 1970, 10: 232-239. DOI:10.1097/00005373-197003000-00005 |
 2019, Vol. 40
2019, Vol. 40


